Токсическое поражение печени – частое побочное действие химиотерапии онкозаболеваний, существенно ограничивающее достижение максимального терапевтического эффекта цитостатической терапии.
Токсическая гепатопатия нередко усугубляет иммуносупрессию, связанную с опухолевым ростом и применением цитостатиков. Предупреждение и лечение такой комбинированной иммунодепрессии представляет сложную клиническую задачу, поэтому нуждается в экспериментальных исследованиях.
Поражение печени тетрахлорметаном (ТХМ) – классическая модель токсического поражения печени [10, 13]. Особого внимания заслуживает проблема коррекции повреждающего воздействия ТХМ на фагоцитарное звено, поскольку оно осуществляет неспецифическую защиту организма, реагирует на малейшие изменения состояния организма, а также активно участвует в процессах как врожденного, так и приобретенного иммунитета, что позволяет использовать фагоцитарные реакции в качестве индикатора для оценки состояния всей иммунной системы в целом [4, 6].
Состояние нейтрофилов и мононуклеарных фагоцитов представляет особый интерес еще и потому, что в последние годы их деятельности отводится немаловажная роль в процессах репаративной регенерации печени [11, 14, 15].
В связи с этим целью исследования явилось изучение эффективности реальдирона (рекомбинантный альфа – 2b интерферон), обладающего способностью стимулировать мононуклеарные фагоциты, а также собственной противоопухолевой активностью, для коррекции иммунотоксических эффектов ТХМ [2].
Материалы и методы исследования
Эксперименты выполнены на 90 белых неинбредных крысах массой 180–200 г, содержавшихся в стандартных условиях вивария. Животные были разделены на 3 группы (по 10 животных в группе): контроль, ТХМ, ТХМ+Р (реальдирон). Животным на протяжении 4 суток (в – 4, – 3, – 2 и – 1 дни) вводили ТХМ внутрижелудочно в дозе 1,25 мл/кг 50 % раствора в оливковом масле [5]. Реальдирон вводили в дозе 100 000 ЕД на крысу [3] внутримышечно 3-кратно (в 0, 3 и 6 дни) после окончания введения токсиканта.
Животные содержались в стандартных условиях вивария с естественным световым режимом, на стандартной диете лабораторных животных (ГОСТР 50258-92), с соблюдением Международных рекомендаций Европейской конвенции по защите позвоночных животных, используемых при экспериментальных исследованиях, а также правил лабораторной практики при проведении доклинических исследований в РФ (ГОСТ З 51000.3-96 и 51000.4-96) и Приказу МЗ РФ № 267 от 19.06.2003 г. «Об утверждении правил лабораторной практики» (GLP).
Определяли количество лейкоцитов, нейтрофилов и лимфоцитов в периферической крови, интенсивность кислородзависимого метаболизма (спонтанный и индуцированный НСТ-тест), поглотительную способность полиморфноядерных лейкоцитов (ПМЯЛ) и перитонеальных макрофагов (ПМФ), антимикробную активность ПМЯЛ и ПМФ в условиях функционирования и блокады (азидом натрия) кислородзависимых факторов микробицидности в отношении грибов Candida albicans, активность миелопероксидазы (МП) и содержание катионных белков (КБ) в фагоцитах [7, 9]. Результаты регистрировали на 7, 14 и 28 сутки.
Статистическую обработку проводили с использованием методов вариационной статистики [1], пакета программ Statistica 8.0. Проверку на нормальность распределения данных выполняли с помощью критерия Шапиро-Вилка. Оценку значимости различий проводили, вычисляя медиану и межквартильный интервал. Дисперсионный анализ проводили с помощью Н-критерия Краскела-Уоллиса, для множественных сравнений использован Q-критерий Дана. Критический уровень значимости р для статистических критериев принимали равным 0,05.
Данные в тексте представлены в процентах к контролю (неинбредные животные).
Результаты исследования и их обсуждение
Воздействие ТХМ приводило на 7 сутки к глубокой лейкопении (до 60,68 %, р = 0,0328), формирование которой было обусловлено снижением числа лимфоцитов (до 52,58 %, р = 0,0008). Наблюдалось глубокое угнетение как оксидантных, так и неоксидантных микробицидных систем ПМЯЛ. Так, интенсивность кислородзависимого киллинга снизилась почти в 2 раза (индекс инактивации (ИИ) составил 59,47 %), что цитохимически подтверждалось снижением активности МП ПМЯЛ (табл. 1). Это сопровождалось усилением кислородзависимого метаболизма в спонтанном НСТ-тесте, что отражает тяжесть токсического воздействия ТХМ. В то же время в условиях индукции отмечено снижение интенсивности оксидантного метаболизма ПМЯЛ (индуцированный НСТ-тест): ПА лат – 72,58 % (р = 0,6282), ИА лат – 71,53 % (р = 0,2228), что отражает снижение резервного потенциала нейтрофилов.
Полученные данные могут свидетельствовать об угнетении как пероксидазозависимых, так и пероксидазонезависимых факторов оксидантного киллинга ПМЯЛ при воздействии ТХМ.
В условиях блокады оксидантных механизмов микробицидности азидом натрия ИИ снизился более чем в 2,5 раза (ИИ – 48,70 %), а цитохимически наблюдалось почти трехкратное снижение уровня КБ в ПМЯЛ (табл. 2). Отмечено и снижение поглотительной способности ПМЯЛ.
Мононуклеарные фагоциты оказались более устойчивыми к действию ТХМ: на 7 сутки наблюдалось угнетение только неоксидантного киллинга ПМФ (ИИ – 75,59 %), что цитохимически сопровождалось снижением уровня КБ в ПМФ.
Применение реальдирона ослабило выраженность лейкопении за счет увеличения числа нейтрофилов (до 134,76 %, p = 0,0023) при сохранявшейся лимфопении (количество лимфоцитов составило 52,82 %, p = 0,0004), а также в 1,5 раза (по отношению к ТХМ) повысило активность неоксидантных микробицидных систем ПМЯЛ (ИИ – 62,34 %). Цитохимически это проявилось двукратным (по отношению к ТХМ) повышением уровня КБ в нейтрофилах (табл. 2).
На 14 сутки сохранялась индуцированная ТХМ лейкопения (65,37 %, р = 0,0002), формирование которой было уже связано со снижением числа как нейтрофилов, так и лимфоцитов (до 62,82 % (р = 0,0021) и 67,64 % (р = 0,0002) соответственно).
Как и на 7 сутки, наблюдалась депрессия кислородзависимых механизмов киллинга ПМЯЛ (ИИ – 63,23 %), что сопровождалось подавлением кислородзависимого метаболизма ПМЯЛ (индуцированный НСТ-тест) и активности МП (табл. 1). В условиях блокады оксидантных механизмов фунгицидность ПМЯЛ несколько повышалась (по сравнению с 7-ми сутками), хотя оставалась сниженной (ИИ – 63,23 %), как и уровень КБ в нейтрофилах (табл. 2).
Воздействие ТХМ привело на 14 сутки к подавлению оксидантных факторов микробицидности ПМФ (ИИ – 86,93 %), что сочеталось со снижением интенсивности кислородзависимого метаболизма ПМФ как в спонтанном, так и в индуцированном НСТ-тесте. Это свидетельствует о существенном истощении резервного потенциала ПМФ и способности к образованию активных форм кислорода, которым, как известно, принадлежит ведущая роль в механизмах оксидантного киллинга ПМФ. Также наблюдалось снижение активности МП в мононуклеарных фагоцитах: процент МП – позитивных макрофагов составил 67,92 % (р = 0,0009), а СЦК – 72,19 % (р = 0,0022).
Таблица 1
Влияние тетрахлорметана и его комбинации с реальдироном на активность миелопероксидазы в ПМЯЛ (СЦК, в % к контролю)
|
Сутки наблюдения |
ТХМ |
ТХМ + Р |
|
7 |
70,24 [53,57–73,81] Р1 = 0,0003 |
75,60 [70,83–80,95] |
|
14 |
77,14 [72,86 – 82,86] Р1 = 0,0010 |
88,57 [82,86–100,0] |
|
28 |
72,12 [67,31–94,23] |
117,31 [101,92–125,0] Р2 = 0,0040 |
Примечание. Достоверность отличий Р1 – от контроля, Р2 – от ТХМ.
Таблица 2
Влияние тетрахлорметана и его комбинации с реальдироном на содержание катионных белков в ПМЯЛ (СЦК, в % к контролю)
|
Сутки наблюдения |
ТХМ |
ТХМ+Р |
|
7 |
38,95 [35,79–43,16] Р1 << 0,00001 |
78,95 [69,47–88,42] Р2 = 0,0104 |
|
14 |
69,05 [64,29–72,62] Р1 = 0,0228 |
116,67 [114,29–125,0] Р2 = 0,0001 |
|
28 |
74,04 [69,23–76,92] Р1 = 0,0001 |
92,31 [86,54–98,08] Р2 = 0,0164 |
Примечание. Достоверность отличий Р1 – от контроля, Р2 – от ТХМ.
Сохранялась депрессия ТХМ неоксидантного киллинга мононуклеаров (ИИ составил 77,06 %), что сопровождалось снижением содержания КБ в ПМФ: процент КБ – положительных клеток составил 59,69 (р = 0,0082) %, а СЦК – 64,08 % (р = 0,0368). На 14 сутки наблюдалось увеличение как количества ПМФ, участвующих в фагоцитозе, так и их поглотительной способности: ФЧ составило 127,94 % (р = 0,2698), а ФИ – 131,67 % (р = 0,0012).
Использование реальдирона (14 сутки) полностью восстанавливало активность оксидантных и неоксидантных микробицидных систем ПМЯЛ (ИИ составил 103,23 % и 114,73 % соответственно). При этом реальдирон устранял депрессию ТХМ кислородзависимого метаболизма ПМЯЛ. Это согласуется с данными других авторов об активирующем влиянии реальдирона на оксидантный метаболизм нейтрофильных гранулоцитов, и может свидетельствовать о повышении резервного потенциала ПМЯЛ [8, 12].
Реальдирон устранял депрессию активности МП в ПМЯЛ (табл. 1). Следовательно, применение реальдирона обеспечивало повышение активности пероксидазозависимых и пероксидазонезависимых оксидантных механизмов киллинга ПМЯЛ.
Восстановление активности неоксидантных факторов микробицидности ПМЯЛ (ИИ – 114,73 %) под влиянием реальдирона (14-е сутки) сопровождалось двукратным (по сравнению с 7 сутками) повышением уровня КБ в ПМЯЛ (табл. 2).
Реальдирон снижал до нормы число фагоцитирующих ПМЯЛ (ФЧ – 90,0 %, р = 1,00) при восстановлении их поглотительной активности (ФИ – 89,39 %, р = 1,00).
На 14-е сутки реальдирон устранял индуцированную ТХМ депрессию как кислородзависимых, так и кислороднезависимых механизмов микробицидности ПМФ (ИИ составил 100,15 % и 132,97 % соответственно). Восстанавливались интенсивность оксидантного метаболизма, уровень МП и КБ в мононуклеарных фагоцитах.
Реальдирон снижал до нормы число ПМФ, участвующих в фагоцитозе (ФЧ – 85,29 %, р = 0,1324) при сохранении их поглотительной способности на уровне интактных животных (ФИ – 93,33 %, р = 1,0).
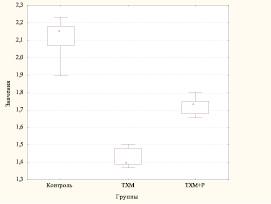 А)
А)
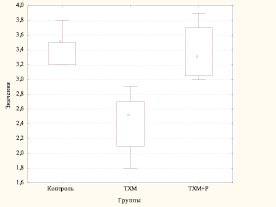 Б)
Б)
Влияние ТХМ и его комбинации с реальдироном на содержание КБ (СЦК) (А) и поглотительную способность (ФИ) (Б) в ПМФ (28 сутки наблюдения)
К 28 суткам после интоксикации ТХМ выраженность лейкопении уменьшалась (76,44 %, р = 0,2165) за счет повышения до нормы числа лимфоцитов (83,75 %, p = 0,7144) при сохранявшейся нейтропении (61,25 %, p = 0,0005). Микробицидность ПМЯЛ как в условиях функционирования, так и блокады кислородзависимых механизмов повышалась, но не восстанавливалась (ИИ составил 79,19 % и 75,53 % соответственно). Это согласовалось с глубоким снижением активности оксидантного метаболизма и МП в нейтрофильных гранулоцитах (табл. 1).
Усугублялась депрессия токсикантом кислороднезависимых факторов микробицидности ПМФ (ИИ составил 60,52 %), что подтверждалось снижением уровня КБ в них: процент КБ – положительных клеток составил 68,0 % (p<<0,00001), а СЦК – 64,65 % (p<<0,00001). На 28-е сутки сохранялось увеличение числа ПМФ, участвующих в фагоцитозе (ФЧ – 123,53 %, р = 1,00) при значимом снижении их поглотительной способности (ФИ – 71,43 %, р = 0,0430).
На 28 сутки сохранялись индуцированные токсикантом лейкопения (68,44 %, р = 0,1093), обусловленная снижением числа лимфоцитов (до 69,17 %, р = 0,0652).
На 28-е сутки, так же, как и на 14-е сутки, реальдирон устранял депрессию токсикантом кислородзависимых и кислороднезависимых факторов микробицидности ПМЯЛ (ИИ составил 101,16 % и 110,97 % соответственно). Восстанавливался оксидантный метаболизм ПМЯЛ и повышалась активности МП ПМЯЛ (табл. 1), что свидетельствует об активации реальдироном пероксидазозависимых и пероксидазонезависимых механизмов киллинга ПМЯЛ.
Восстановление активности неоксидантных механизмов киллинга ПМЯЛ подтверждалось повышением до нормы уровня КБ в них (табл. 2). Реальдирон нормализовал поглотительную способность в нейтрофилах.
На 28-е сутки реальдирон восстанавливал активность оксидантных механизмов киллинга ПМФ (ИИ – 103,76 %) за счет повышения активности кислородзависимого метаболизма ПМФ, что свидетельствует об активации реальдироном пероксидазонезависимых оксидантных микробицидных систем ПМФ.
В то же время применение реальдирона не устраняло вызванное ТХМ угнетение неоксидантных механизмов киллинга ПМФ (ИИ – 76,01 %). Однако цитохимически наблюдалось повышение (по отношению к ТХМ) уровня КБ в ПМФ (рис. А).
Использование реальдирона снижало число ПМФ, участвующих в фагоцитозе, при повышении до нормы их поглотительной активности (рис. Б).
Заключение
Таким образом, воздействие ТХМ на организм, которое рассматривается как экспериментально-химический стресс [Халимов], приводит к формированию глубокой лейкопении, угнетению микробицидности фагоцитов, особенно в условиях блокады оксидантного киллинга (что коррелирует со снижением в них активности миелопероксидазы и уровня катионных белков). Применение реальдирона существенно корректирует/нивелирует повреждающее действие ТХМ на клетки фагоцитарного звена: восстанавливает микробицидность фагоцитов, что сопровождается повышением в них оксидантного метаболизма, активности миелопероксидазы и уровня неферментных катионных белков, а также предупреждает падение их поглотительной способности.
Рецензенты:
Медведев Ю.А., д.м.н., профессор, старший научный сотрудник лаборатории № 9 Научно-исследовательского технологического института гербицидов и регуляторов роста растений Академии наук республики Башкортостан, г. Уфа;
Сакаева Д.Д., д.м.н., заместитель главного врача по химиотерапии ГБУЗ «Республиканского клинического онкологического диспансера» Министерства здравоохранения республики Башкортостан, г. Уфа.



