Актуальность исследования. Классическое понимание адаптации предполагает, что основным условием завершения приспособительного процесса к воздействию внешнего фактора является возвращение параметров гомеостатических систем к исходному уровню либо стабилизация их на новом уровне [5]. При адаптации к холоду в настоящее время человек все меньшее время проводит на улице при низких температурах, так как большинство работ идет в теплой кабине различных машин, а отдых человек проводит в комфортных условиях при достаточно высоких температурах. Поэтому возникает вопрос, а происходит ли физиологическая адаптация к холоду, или постоянно зимой идет процесс адаптации и дезадаптации к холоду? Очень важно знать, как отличается процесс полной адаптации к холоду и неполной адаптации к холоду и как эти циклы адаптации влияют на рецепторные механизмы регуляции сердечно-сосудистой системы. Согласно длительным исследованиям многих авторов, у жителей Арктики тенденция к понижению давления усиливается по мере увеличения продолжительности их проживания на Севере. Около 30 % жителей Заполярья имели уровень АД ниже своих возрастных норм [1–4]. Согласно гипотезе Г.М. Данишевского [4], артериальная гипотония на Севере может рассматриваться как результат приспособительной реакции охранительного торможения вазомоторных центров в ответ на действие чрезвычайных раздражителей и формирования гипосимпатикотонии в период акклиматизации. Анализ многочисленных исследований показал, что до настоящего времени не исследованы физиологические механизмы на уровне рецепторов, что ведет к повышению артериального давления при адаптации к холоду или его снижению. Поэтому целью настоящей работы явилось изучение адренореактивности системного давления и тонуса артериальных сосудов кожно-мышечной области задней конечности при незавершенной 10-дневной и завершенной 30-дневной холодовой адаптации.
Материалы и методы исследования
Для решения поставленных задач проведены исследования на кроликах-самцах (массой 2,5–3,5 кг) под наркозом. Контрольную группу составили кролики, содержавшиеся при температуре окружающей среды (+)18–22 °С в течение 10 и 30 дней. Холодовое воздействие проводилось ежедневно по 6 часов в охлаждающей камере при температуре (–)10’C, в остальное время кролики находились при температуре (+)18–22 °C. Регистрация системного давления и перфузионного давления конечности проводилась с помощью датчиков MPX100DP и через АЦП ADS1286 записывалась и автоматически обрабатывалась компьютером. Для оценки параметров взаимодействия адренорецепторов с медиатором были применены методы количественной оценки взаимодействия «медиатор-рецептор». Для построения графика «доза-эффект» в двойных обратных координатах, экспериментальные точки соединены прямой, с использованием метода наименьших квадратов и экстраполировали до пересечения с осями ординат и абсцисс. Пересечение с осью ординат давало отрезок, который соответствовал 1/Рм, обратная величина которого отражала максимально возможную реакцию перфузионного давления (Рм–мм рт. ст.) и соответствовала количеству активных адренорецепторов; пересечение с осью абсцисс отсекало отрезок, который был равен величине 1/К и отражал чувствительность адренорецепторов к агонисту, а обратная величина (К-мкг.кг) была равна дозе, вызывающей 50 % от максимально возможной реакции перфузионного давления. Анализ параметров взаимодействия адренорецепторов с медиатором позволил получить количественную оценки взаимодействия «медиатор-рецептор» в виде количества активных рецепторов (Рм) и чувствительности взаимодействия норадреналина с адренорецепторами [2].
Результаты исследования и их обсуждение
После 10 дней холодовой адаптации (рис. 1) максимально возможная прессорная реакция артериального давления на норадреналин уменьшилась с Рм = 157 мм рт. ст. в контроле до Рм = 76,9 мм рт. ст., т.е. уменьшилась на 51 %. Чувствительность же прессорной реакции системного давления на норадреналин увеличилась с 1/К = 0,06 в контроле до 1/К = 0,2 после 10 дней холодовой адаптации, т.е. увеличилась на 233 %. Поэтому можно сделать заключение, что прессорная реакция артериального давления на норадреналин после 10 дней холодовой адаптации на низкие дозы была больше, чем в контрольной группе, на средние дозы не отличалась от контроля, а на высокие дозы становится уже меньше контрольной группы.
После 10 дней холодовой адаптации максимально возможная прессорная реакция артериального русла кожно-мышечной (рис. 2) области задней конечности достоверно не отличалась от контроля и была Рм = 154 мм рт. ст. (Pm = 172,41 мм рт. ст. контрольной группы). Чувствительность альфа-адренорецепторов к норадреналину увеличилась на 50 % с 1/К = 1,2 в контроле до 1/К = 1,8 после 10-дневного охлаждения. Чувствительность прессорной реакции (1/К) системного давления была больше контроля на 233 %, а тонуса артерий больше контроля только на 50 %.
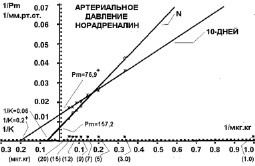
Рис. 1. Повышение артериального давления кролика на норадреналин в двойных обратных координатах в контрольной группе (N) и после 10 дней холодовой адаптации
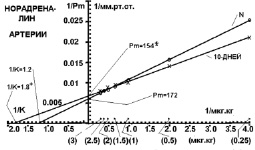
Рис. 2. Повышение перфузионного давления артериального русла задней конечности кролика на норадреналин в двойных обратных координатах в контрольной группе (N) и после 10 дней холодовой адаптации
Такие изменения реактивности артерий на 10-й день холодовой адаптации к норадреналину способствуют большей прессорной реакции периферических артерий на действие холода. При действии холода теплоотдача уменьшится, увеличится время выживания на холоде. Но такая реакция будет способствовать переохлаждению конечности, и при продолжительном холоде могут возникнуть отморожения. Это связано с тем, что на 10-й день холодовой адаптации еще не достаточно включились процессы термогенеза и выработки тепла. Если интерпретировать эти данные на человека, то на 10-й день холодовой адаптации при любом стрессе увеличивается выброс норадреналина, а так как реактивность артерий повышена, будет отмечаться больший спазм артерий, чем без 10 дневной адаптации к холоду. Увеличение чувствительности адренорецепторов к норадреналину на 10-й день адаптации увеличивает спазм артерий уже на низкие дозы норадреналина.
В то же время, на 10-й день холодовой адаптации снижается количество адренорецепторов в артериях (рис. 2), что уменьшает прессорное действие норадреналина на большие дозы по сравнению с контрольной группой.
Максимально возможная прессорная реакция (Рм) в артериях кожно-мышечной области была меньше контроля на 10 %, а системного давления меньше контроля на 51 %. В результате эффективность (Е) реактивности системного давления к норадреналину на 10-й день адаптации к холоду соответствовала норме, а артерий конечности – была на 58 % больше контроля. Таким образом, было установлено, что стабилизация эффективности реактивности системного давления к норадреналину на 10-й день холодовой адаптации гораздо выше, чем реактивность тонуса артерий задней конечности к норадреналину. Изменение реактивности системного давления на 10-й день адаптации к холоду имеет ту же направленность, что и в артериальном периферическом русле задней конечности животного. Системное давление отражает общую реакцию всех сосудов и реакцию сердца. На 10-й день холодовой адаптации реактивность сердца к норадреналину снизилась на высокие дозы норадреналина за счет уменьшения количества бета-адренорецепторов в сердце (рис. 1). Но одновременно повысилась их чувствительность, что привело к увеличению реактивности сердца на низкие дозы норадреналина.
После 30 дней холодовой адаптации (рис. 3) максимально возможная прессорная реакция артериального давления на норадреналин уменьшилась с Рм =157 мм рт. ст. в контроле до Рм = 102 мм рт. ст., т.е. уменьшилась на 35 %.
Чувствительность прессорной реакции системного давления на норадреналин увеличилась с 1/К = 0,06 в контроле до 1/К = 0,2 после 30 дней холодовой адаптации, т.е. увеличилась на 233 %.
На 30-й день адаптации к холоду на все дозы норадреналина прессорная реакция системного давления была больше, чем при 10 днях адаптации. Это произошло исключительно за счет увеличения количества бета-адренорецепторов в сердце на 30-й день адаптации по сравнению с контролем, так как в артериальном русле на все дозы была меньшая прессорная реакция на норадреналин (рис. 4). Чувствительность бета-адренорецепторов в сердце на 30-й день холода была такой же, как и на 10-й день холода (рис. 2).
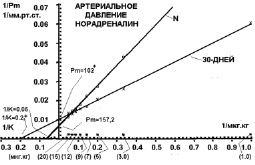
Рис. 3. Повышение артериального давления кролика на норадреналин в двойных обратных координатах в контрольной группе (N) и после 30 дней холодовой адаптации
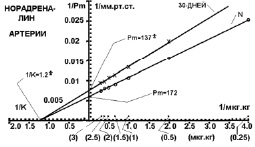
Рис. 4. Повышение перфузионного давления артериального русла задней конечности кролика на норадреналин в двойных обратных координатах в контрольной группе (N) и после 30 дней холодовой адаптации
Реактивность артерий кожно-мышечной области задней конечности к норадреналину на 30-й день адаптации к холоду (рис. 4) была меньше контрольной группы на все дозы, что было обусловлено исключительно уменьшением количества активных адренорецепторов периферических артерий и соответственно уменьшением максимально-возможной прессорной реакцией (Рм) на 20 %. Чувствительность (1/К) же прессорной реакции артерий кожно-мышечной области на 30-й день холодовой адаптации нормализовалась. На 30-й день холода на все дозы норадреналина прессорная реакция периферических артерий была меньше, чем на 10-й день холода, как за счет уменьшения количества адренорецепторов, так и за счет уменьшения их чувствительности. Такие изменения реактивности прессорных альфа-адренорецепторов артерий конечности на 30-й день холода приводят к тому, что при термогенезе даже большие дозы норадреналина сокращают артерии меньше чем в контроле, и на 10-й день холода. Меньший спазм артерий позволяет лучше прогревать ткани при холоде и в конечном результате улучшает выживаемость на холоде. Физиологические механизмы таких изменений лиганд-рецепторных взаимоотношений на 30-й день адаптации к холоду происходят, по нашему мнению, потому, что уже на 30-й день адаптации резко увеличивается термогенез, и организм может не так резко ограничивать теплоотдачу за счет спазма артерий. Поэтому организм и уменьшает количество прессорных альфа-адренорецепторов в артериях конечности для уменьшения спазма на норадреналин и для увеличения кровотока и прогрева, что и получено при анализе результатов наших опытов.
Полученные нами данные достоверно (Р < 0,05) показали, что при незавершенной 10-дневной холодовой адаптации реактивность артерий и системного давления на норадреналин в значительной степени отличалась от реактивности этих показателей на 30-й день холодовой адаптации. Эти изменения реактивности артерий конечности и системного давления произошли за счет различных механизмов регуляции чувствительности адренорецепторов и изменения их количества. Сравнительный анализ реактивности системного давления и тонуса артерий кожно-мышечной области задней конечности к возрастающим дозам норадреналина показал, что после 10 дней адаптации к холоду реактивность увеличилась за счет увеличения чувствительности (1/К) прессорных альфа-адренорецепторов на низкие дозы норадреналина, одновременно уменьшилось количество активных прессорных (Рм) адренорецепторов, что привело к уменьшению прессорной реакции на большие дозы норадреналина.
Сравнительный анализ реактивности системного давления и тонуса артерий кожно-мышечной области задней конечности к возрастающим дозам норадреналина показал, что после 30 дней адаптации к холоду реактивность изменилась в большей степени за счет изменения чувствительности, чем за счет изменения максимально возможной величины прессорной реакции.
Выводы
В результате можно сделать заключение, что на 30-й день холодовой адаптации системное давление отвечает большей прессорной реакцией на норадреналин по сравнению с контролем, а периферические артериальные сосуды сокращаются меньше на норадреналин, чем в контрольной группе. Стабилизация эффективности реактивности к норадреналину системного давления и регионального кровообращения достигается в результате часто разнонаправленного изменения показателей чувствительности (1/К) и максимально-возможной (Рм) прессорной реакции в обоих исследуемых регионах кровообращения.
Рецензенты:
Торшин В.И., д.б.н., профессор, заведующий кафедрой нормальной физиологии Медицинского института ФГАУ ВО «Российского университета дружбы народов», г. Москва;
Северин А.Е., д.м.н., профессор кафедры нормальной физиологии Медицинского института ФГАУ ВО «Российского университета дружбы народов», г. Москва.



