Урацил является нуклеиновым основанием и входит в состав РНК. Это объясняет широкий спектр биологической активности соединений, в основе которых лежит остаток урацила. В нашей лаборатории успешно проводятся работы по поиску новых противовирусных агентов производных урацила, содержащих у атома азота в положении 1 полиметиленовый мостик, который связывает ароматический фрагмент и пиримидиновое основание. Так, нами был разработан эффективный удобный метод синтеза 1-[2-(фенокси)этил]производных урацила 1, который заключался в сплавлении при 180–185 °С эквимолярных количеств 2,4-бис(триметилсилилокси)пиримидина и соответствующего 1-бром-2-(фенокси)этана, что вело к целевым соединениям 1, выход которых составлял 55–71 % [1]. Опираясь на соединения 1 были найдены высокоактивные серии соединений – бензофенонпроизводные урацила 2 [5, 6, 10] и 3-бензилпроизводные 1-[2-(фенокси)этил]урацила 3 [11] (рис. 1), проявившие мощную анти-ВИЧ-1 активность как в отношении обратной транскриптазы дикого типа и мутантных вариантов, так и в клеточной культуре.
Дальнейшие исследования показали, что увеличение числа метиленовых групп до четырех-восьми в составе мостика ведет к существенному снижению анти-ВИЧ-1 активности [2, 3] и усилению ингибиторных свойств в отношении цитомегаловируса [9].
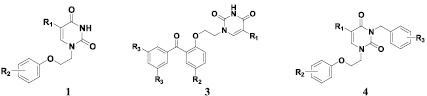
Рис. 1. Описанные в литературе производные 1-[2-(фенокси)этил]урацила
Цель исследования. В этой связи с целью дальнейшего поиска биологически активных соединений в ряду 1-[ω-(фенокси)алкил]производных урацила были разработаны условия и осуществлен синтез серии 1-[3-(фенокси)пропил]производных урацила 5a–5f, содержащих в ароматическом кольце различные заместители.
Результаты исследования и их обсуждение
Синтез целевых соединений 5a–5f был осуществлен путем нагревания эквимолярных количеств 2,4-бис(триметилсилилокси)пиримидина (6), который получали путем кипячения исходного урацила в избытке гексаметилдисилазана [7, 12], и 1-бром-3-(фенокси)пропана (7) полученного в условиях, опубликованными Гензером и др. [7], при 160–170 °С в течение 1 ч с защитой от влаги воздуха без использования какого-либо растворителя в соответствии с ранее описанным методом [1], как это представлено на рис. 2. При этом выход конечных 1-[3-(фенокси)пропил]производных урацила 5a–5f составил 76–85 %. Образования побочных продуктов N3-моно- и N1,N3-дизамещенных урацилов согласно данным ТСХ обнаружено не было.
Следует отметить тот факт, что описанная ранее конденсация 2,4-бис(триметилсилилокси)пиримидина (6) с 1-бром-2-(фенокси)этаном (8) требовала жестких условий – 180–185 °С [1]. В то время как аналогичная реакция триметилсилил-производного 6 с бромидом 7 с успехом протекала в более мягких условиях (160–170 °С). Объяснить данное явление можно следующим образом. Известно, что атом кислорода способен стабилизировать образовавшийся в результате гетеролиза ион за счет взаимодействия с катионным центром и, следовательно, должен увеличивать скорость диссоциации. Стабилизация карбкатиона в этом случае обуславливается наличием неподеленной пары электронов у атома кислорода. В результате такого анхимерного содействия образуется циклическая структура 9 (рис. 3) [8, 13]. Следствием этого является то, что реакционная способность бромида 7 заметно выше низкореакционноспособного 1-бром-2-(фенокси)этана (8) [4], у которого в составе мостика лишь две метиленовые группы и вследствие этого его атом кислорода не способен стабилизировать карбкатион, который мог бы образовываться в результате диссоциации связи С-Br.
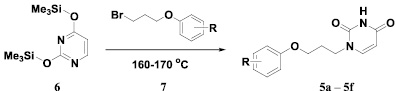
Рис. 2. Синтез 1-[3-(фенокси)пропил]производных урацила 5a–5f
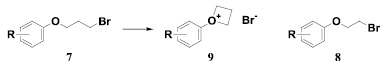
Рис. 3. Анхимерное содействие атома кислорода при синтезе 1-[3-(фенокси)пропил]производных урацила 5a–5f
Физико-химические свойства синтезированных соединений
|
Соед |
R |
Выход, % |
Т.пл., °C |
Rf* |
|
5a |
2–Me |
76 |
154–156 |
0,45 |
|
5b |
2,3–Me2 |
82 |
141–142 |
0,46 |
|
5c |
2,4–Me2 |
85 |
109–110 |
0,46 |
|
5d |
2,5–Me2 |
80 |
106–108 |
0,47 |
|
5e |
2–Cl |
79 |
183–185 |
0,41 |
|
5f |
2–Br |
84 |
163–165 |
0,41 |
Примечание. * этилацетат.
Чистоту полученных соединений определяли методом тонкослойной хроматографии, строение – 1Н и 13С ЯМР-спектроскопией. Физико-химические свойства представлены в таблице.
Материалы и методы исследования
Спектры ЯМР 1Н и 13С регистрировали на спектрометре «Bruker Avance 400» (400 МГц для 1H и 100 МГц для 13С) в ДМСО-D6, внутренний стандарт тетраметилсилан. Тонкослойную хроматографию выполняли на пластинах «Merk TLS Silica gel 60 F254» (Германия), используя в качестве элюента этилацетат. Пластины проявляли с помощью УФ-лампы VL-6.LC (Франция). Температуры плавления были измерены в стеклянных капиллярах на приборе «Mel-Temp3.0» (Laboratory Devices Inc., США).
Общая методика получения 1-[3-(фенокси)пропил]урацилов 5a–5f
К 2,4-бис(триметилсилилокси)пиримидину, полученному кипячением 1,5 г (13,38 ммоль) урацила в избытке гексаметилдисилазана в присутствии каталитического количества хлорида аммония, прибавили 4,0 г (13,61 ммоль) 1-бром-3-(фенокси)пропана. Полученную смесь нагревали при 160–170 °С в течение 1 ч с защитой от влаги воздуха. Реакционную массу охладили до комнатной температуры, растворили в 50 мл этилацетата и обработали 10 мл изопропанола. Через 30 мин выпавший осадок отфильтровали и перекристаллизовали из смеси 20 мл изопропанола, 10 мл ДМФА и 10 мл воды. Кристаллический продукт отфильтровали и сушили на воздухе на чашке Петри.
1-[3-(2-Метилфенокси)пропил]урацил (5a). 1H ЯМР-спектр (ДМСО-D6), δ, м.д., J (Гц): 2,05 кв (2H, J = 6,4, CH2), 2,13 с (3H, CH3), 3,85 т (2H, J = 6,8, NCH2), 3,97 т (2H, J = 6,0, OCH2), 5,52 д (1H, J = 7,9, H-5), 6,81 дт (1H, J = 8,3 и 1,0, H-4′), 6,86 дд (1H, J = 7,9, H-3′), 7,09–7,13 м (2H, H-5′, H-6′), 7,59 д (1H, J = 7,8, H-6), 11,20 с (1H, NH). 13С ЯМР-спектр (ДМСО-D6), δ, м.д.: 16,1; 28,5; 45,7; 65,2; 101,2; 111,4; 120,5; 126,1; 127,2; 130,7; 146,0; 151,3; 156,8; 164,1.
1-[3-(2,3-Диметилфенокси)пропил]урацил (5b). 1H ЯМР-спектр (ДМСО-D6), δ, м.д., J (Гц): 2,04 м (5H, 3-CH3, CH2), 2,18 с (3H, 2-CH3), 3,85 т (2H, J = 6,5, NCH2), 3,93 т (2H, J = 5,5, OCH2), 5,52 дд (1H, J = 7,9 и 2,0, H-5), 6,72 д (2H, J = 7,8, H-4′, H-6′), 6,99 т (1H, J = 7,8, H-5′), 7,59 д (1H, J = 7,8, H-6), 11,22 с (1H, NH). 13С ЯМР-спектр (ДМСО-D6), δ, м.д.: 11,6; 20,0; 28,6; 45,8; 65,5; 101,2; 109,3; 122,4; 124,5; 126,2; 137,5; 146,0; 151,3; 156,5; 164,1.
1-[3-(2,4-Диметилфенокси)пропил]урацил (5c). 1H ЯМР-спектр (ДМСО-D6), δ, м.д., J (Гц): 2,01 кв (2H, J = 6,1, CH2), 2,09 с (3H, 3-CH3), 2,17 с (3H, 2-CH3), 3,84 т (2H, J = 6,6, NCH2), 3,92 т (2H, J = 5,3, OCH2), 5,52 дд (1H, J = 7,9 и 2,0, H-5), 6,73 д (1H, J = 7,6, H-6′), 6,88–6,90 м (2H, H-3′, H-5′), 7,58 д (1H, J = 7,9, H-6), 11,22 с (1H, NH). 13С ЯМР-спектр (ДМСО-D6), δ, м.д.: 16,1; 20,4; 28,5; 45,7; 65,2; 101,2; 111,4; 125,8; 127,3; 129,1; 131,4; 146,0; 151,3; 154,7; 164,1.
1-[3-(2,5-Диметилфенокси)пропил]урацил (5d). 1H ЯМР-спектр (ДМСО-D6), δ, м.д., J (Гц): 2,04 кв (2H, J = 6,1, CH2), 2,07 с (3H, 3-CH3), 2,23 с (3H, 2-CH3), 3,84 т (2H, J = 6,4, NCH2), 3,95 т (2H, J = 5,5, OCH2), 5,52 дд (1H, J = 7,9 и 1,6, H-5), 6,61 д (1H, J = 7,1, H-3′), 6,68 с (1H, H-6′), 6,96 д (1H, J = 7,4, H-4′), 7,59 д (1H, J = 7,8, H-6), 11,22 с (1H, NH). 13С ЯМР-спектр (ДМСО-D6), δ, м.д.: 15,8; 21,4; 28,5; 45,7; 65,1; 101,2; 112,2; 121,0; 122,8; 130,4; 136,4; 146,0; 151,3; 156,6; 164,1.
1-[3-(2-Хлорфенокси)пропил]урацил (5e). 1H ЯМР-спектр (ДМСО-D6), δ, м.д., J (Гц): 2,07 кв (2H, J = 6,3, CH2), 3,85 т (2H, J = 6,8, NCH2), 4,07 т (2H, J = 5,8, OCH2), 5,51 дд (1H, J = 7,8 и 2,1, H-5), 6,93 дт (1H, J = 7,6 и 1,2, H-4′), 7,10 дд (1H, J = 8,3 и 1,6, H-6′), 7,27 дт (1H, J = 7,6 и 1,8, H-5′), 7,39 дд (1H, J = 7,8 и 1,7, H-3′), 7,58 д (1H, J = 7,8, H-6), 11,18 с (1H, NH). 13С ЯМР-спектр (ДМСО-D6), δ, м.д.: 28,3, 45,7, 66,4, 101,3, 114,2, 121,8, 121,9, 128,6; 130,2; 145,9; 151,3; 154,0; 164,1.
1-[3-(2-Бромфенокси)пропил]урацил (5f). 1H ЯМР-спектр (ДМСО-D6), δ, м.д., J (Гц): 2,07 кв (2H, J = 6,3, CH2), 3,85 т (2H, J = 6,8, NCH2), 4,06 т (2H, J = 5,8, OCH2), 5,52 дд (1H, J = 7,8 и 2,0, H-5), 6,87 дт (1H, J = 7,6 и 1,3, H-4′), 7,07 дд (1H, J = 8,3 и 1,2, H-6′), 7,31 дт (1H, J = 8,4 и 1,8, H-5′), 7,53–7,58 м (2H, H-6, H-3′), 11,19 с (1H, NH). 13С ЯМР-спектр (ДМСО-D6), δ, м.д.: 28,3; 45,7; 66,4; 101,4; 111,4; 114,1; 122,5; 129,3; 133,2; 145,9; 151,3; 154,9; 164,1.
Выводы
В ходе выполненной работы разработаны условия и осуществлен синтез 6 новых производных урацила, содержащих у атома азота в положении 1 пиримидинового цикла 3-(фенокси)пропильный фрагмент. Полученные соединения представляют интерес в качестве потенциальных противовирусных агентов.
Настоящая работа выполнена при поддержке гранта Российского фонда фундаментальных исследований № 13-04-01391.
Рецензенты:Ганичева Л.М., д.фарм.н., доцент кафедры управления и экономики фармации, медицинского и фармацевтического товароведения, Волгоградский государственный медицинский университет, г. Волгоград;
Симонян А.В., д.фарм.н., профессор кафедры фармацевтической технологии и биотехнологии, Волгоградский государственный медицинский университет, г. Волгоград.
Работа поступила в редакцию 01.04.2015.



