При активации многокомпонентного энзима плазматических мембран нейтрофилов и мембран секреторных гранул – НАДФН-оксидазы в клетках повышается содержание пероксида водорода, который, в свою очередь, инактивирует тирозин-фосфатазы и активирует тирозин-киназы, регулируя тем самым степень фосфорилирования многих клеточных ферментов и, следовательно, их активность [12]. В условиях нормы энзиматическая активность НАДФ-Н оксидазы ограничена в пространстве фагосомой и во времени аутодеактивацией [6]. Принято говорить о двух механизмах ее регуляции: о разделении мембранных и цитозольных субъединиц в покоящейся клетке и модификации белок-белковых и белок-липидных взаимодействий. При стимуляции фагоцита фактором корпускулярной или растворимой природы, действующим через рецепторы или по рецептор-независимому механизму, происходит быстрая самосборка энзима. Снижение активности НАДФН-оксидазы наблюдается при ряде врожденных и наследственных заболеваний, при термических ожогах и обморожениях, при лучевой терапии, при опухолевых заболеваниях, у новорожденных недоношенных детей и др. [1]. Актуальным является изучение механизмов регуляции НАДФН-оксидазы и поиск стимуляторов активности указанного энзима [7].
Целью данной работы явилось изучение влияния факторов различной природы на степень активности НАДФН-оксидазы нейтрофилов периферической крови человека.
Материалы и методы исследования
В качестве объекта исследования использовали лейкоциты крови человека, полученные из крови доноров-добровольцев (39 ± 10 лет) путем цитафереза (2500 об/мин c охлаждением 5 минут, Sorvall, США) с их информированного согласия. Количество лейкоцитного концентрата в среднем составляло 21,0 ± 2,0 мл. Данная трансфузионная среда с высоким содержанием лейкоцитов (27 000 – 32 000 в 1 мкл) имела незначительную примесь эритроцитов, тромбоцитов, стволовых клеток и плазмы.
В работе использованы следующие вещества: адреналин («Эпинефрин», ФГУП «Московский эндокринный завод») в концентрации 10–6 г/л; инсулин растворимый человеческий генно-инженерный (препарат инсулина короткого действия «Актрапид НМ», Ново Нордиск А/С, Дания) в концентрации 10–8 г/л; эстроген («Прогинова», Байер Шеринг Фарма АГ, Германия) в концентрации 10–5 г/л; прогестерон («Дюфастон», Эбботт Биолоджикалз Б.В., Нидерланды) в концентрации 5∙10–5 г/л; гистамин (Дигидрохлорид гистамина, Сигма) в концентрации 10–4 моль/л; иммуноглобулин G («Иммуновенин», НПО «Микроген», Уфа) в концентрации 5 г/л. Для приготовления растворов указанных выше веществ использован раствор Хенкса стерильный (ООО «БиолоТ», СПб). При выборе концентраций ориентировались на опубликованные данные [4, 5, 9–11]. Исследования выполнены в осенне-зимний период. В пробах с половыми гормонами использовалась кровь небеременных женщин-доноров (лютеиновая фаза) репродуктивного возраста.
Степень активности НАДФН-оксидазы клеток оценивали с помощью метода индуцированной (перекисью водорода с сульфатом железа) хемилюминесценции на биохемилюминометре БХЛ-07 (ЦНИЛ НГМА; «ИМБИО», Нижний Новгород). В связи с тем, что среди клеток крови основным продуцентом активных форм кислорода, обладающих бактерицидным действием, являются нейтрофилы, при оценке хемилюминесценции венозной или капиллярной крови интенсивностью свечения моноцитов и лимфоцитов пренебрегали [8].
В измерительную кювету прибора вносили 0,1 мл лейкоцитного концентрата с одним из вышеуказанных препаратов в соответствующей концентрации и 0,4 мл фосфатного буфера (рН = 7,5), добавляли 0.4 мл 0,01 мМ раствора сульфата железа (ОАО «Спектр-Хим» г. Москва) и помещали в измерительную кювету. После чего в нее быстро вносили 0,2 мл 2 % раствора перекиси водорода (ЗАО «СП Химпром», г. Самара) и регистрировали сигнал в течение 30 с. Оценивали следующие параметры: Imax (мВ) – максимальную интенсивность быстрой вспышки, отражающей потенциальную способность биологического объекта к свободно радикальному окислению; S (мВ∙с) – светосумму за 30 с, отражающую содержание радикалов RO2; tg(–2α) – тангенс угла наклона кривой оси времени (характеризует максимальную крутизну спада кривой, со знаком «–»), чем выше значение показателя tg(–2α), тем выше активность ферментативных систем клеток, регулирующих содержание гидроперекисей.
В качестве температурного воздействия использовали следующие температуры: +45 °С, +2 °С и –2 °С. В опытах с температурами +45 °С и +2 °С лейкоцитный концентрат разливали по 2 мл в микропробирки и выдерживали при указанных температурах в течение 30 мин, используя для этих целей соответственно термостат для микропробирок «Гном» и бытовой электрический холодильник «Саратов-1615М».
В опытах с температурой –2 °С лейкоцитный концентрат в пластикатной пробирке в объеме 5 мл помещали в электрический морозильник «Derby» (Дания) на –20 °С. С помощью цифрового дистантного термометра «Checktemp 1» (Румыния) контролировали температуру охлаждаемой клеточной взвеси. Средняя скорость снижения температуры составляла 2,3 °С/мин. Отмечалось плавное снижение температуры без выброса кристаллизационного тепла с сохранением вязкого состояния биообъекта. Общее время охлаждения составляло 9–10 мин. Сохранность клеток, подвергнутых охлаждению до –2 °С, оценивали с помощью метода световой микроскопии (Nikon H550S, Япония) в пробах с 1,0 % раствором суправитального красителя эозина, считая признаком повреждения клеточной мембраны диффузное окрашивание цитоплазмы в розовый цвет. Необходимо отметить, что данное температурное охлаждение во всех случаях не вызывало статистически значимой гибели клеток.
При статистической обработке данных вычисляли среднее арифметическое значение ± среднее квадратичное отклонение (M ± δ). Для выявления статистической значимости различий (p < 0,05) между группами применяли непараметрический критерий Вилкоксона [3] с использованием компьютерной программы для медико-биологической статистики «BIOSTAT».
Результаты исследования и их обсуждение
На первом этапе исследования оценивалось влияние различных веществ и температур на способность нейтрофилов продуцировать кислородные метаболиты и, в частности, перекись водорода. Подтверждено, что при воздействии иммуноглобулина G в концентрации 5 г/л и инсулина в концентрации 10–8 г/л (уровень в крови при генерализованных воспалительных процессах) отмечается статистически значимый рост показателей активности нейтрофилов (таблица). В отношении остальных исследуемых факторов изменений активности клеток не выявлено. Вероятно, выявить описанные в литературе эффекты нам не удалось по ряду причин: использование аналогов веществ в близких концентрациях, влияние сезона года или иное.
На следующем этапе исследования изучено влияние температурного воздействия (+45 °С, +2 °С и –2 °С) на эффекты используемых в работе веществ (рисунок). Установлено, что экспозиция лейкоцитов 30 минут при +2 °С или их охлаждение до –2 °С не изменяют чувствительность рецепторов нейтрофилов к инсулину, адреналину, гистамину и эстрогену (у небеременных женщин). Охлаждение крови небеременных женщин до –2 °С повышает чувствительность нейтрофилов к прогестерону и не изменяет ее к эстрогену. Известно, что прогестерон в концентрации 20–100 нг/мл, что соответствует концентрации I и III триместра беременности, вызывает угнетение окислительной активности нейтрофилов [4], нами выявлена способность прогестерона (50 нг/мл) стимулировать НАДФН-оксидазу нейтрофилов только их после кратковременного охлаждения до –2 °С, т.е. до начала кристаллизации воды. Вероятно, снижение гидрофобных взаимодействий структурных компонентов мембран и их перестройка при охлаждении [2] влияют на изменение количества рецепторов к прогестерону.
Влияние факторов различной природы на активность НАДФН-оксидазы нейтрофилов периферической крови практически здоровых доноров-добровольцев по показателям хемилюминограмм
|
Серия |
n |
Показатели хемилюминограммы |
||
|
Iмах (мВ) |
S (мВ∙с) |
tg(–2α) |
||
|
Нейтрофилы |
12 |
290 ± 38,2 |
1576 ± 176,4 |
77,8 ± 15,9 |
|
+ иммуноглобулин |
433 ± 40,4 * |
2283 ± 303,5 * |
158,1 ± 20,0 * |
|
|
Нейтрофилы |
15 |
285 ± 59,9 |
1678 ± 283,9 |
82,7 ± 8,7 |
|
+ гистамин |
273 ± 56,9 |
1562 ± 205,2 |
81,4 ± 7,1 |
|
|
Нейтрофилы НБЖ |
15 |
205 ± 15,8 |
1335 ± 185,8 |
48,2 ± 7,4 |
|
+ прогестерон |
219 ± 23,3 |
1385 ± 218,9 |
55,0 ± 9,9 |
|
|
Нейтрофилы НБЖ |
15 |
205 ± 15,8 |
1335 ± 185,8 |
48,2 ± 7,4 |
|
+ эстроген |
223 ± 29,2 |
1274 ± 90,4 |
54,4 ± 11,8 |
|
|
Нейтрофилы |
10 |
166 ± 18,1 |
1048 ± 32,8 |
37,5 ± 7,9 |
|
+ инсулин |
193 ± 18,7* |
1172 ± 72,8* |
44,3 ± 7,3 |
|
|
Нейтрофилы |
10 |
218 ± 47,0 |
1312 ± 199,9 |
49,5 ± 12,5 |
|
+ адреналин |
234 ± 14,7 |
1439 ± 139,1 |
56,6 ± 8,9 |
|
|
Нейтрофилы |
12 |
178 ± 22,4 |
1104 ± 220,0 |
46,9 ± 4,7 |
|
после +2 °С |
187 ± 31,7 |
1147 ± 277,1 |
50,4 ± 8,2 |
|
|
Нейтрофилы |
15 |
285 ± 59,9 |
1678 ± 283,9 |
82,7 ± 8,7 |
|
после +45 °С |
281 ± 58,5 |
1637 ± 260,9 |
85,2 ± 5,7 |
|
|
Нейтрофилы |
12 |
238 ± 13,8 |
1705 ± 257,2 |
49,4 ± 6,3 |
|
после –2 °С |
245 ± 10,9 |
1765 ± 260,0 |
49,0 ± 5,8 |
|
Примечания: * – p < 0,05 от значения нейтрофилов; n – количество исследованных образцов лейкоцитных концентратов, НБЖ – небеременные женщины.
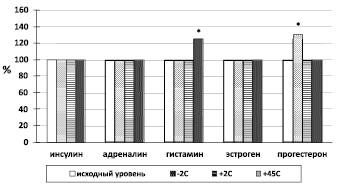
Влияние гормонов на активность НАДФН-оксидазы нейтрофилов после температурного воздействия по показателю хемилюминограмм S: * – p < 0,05 от исходного значения показателя S, принятого условно за 100 %
Экспозиция периферической крови здоровых доноров-добровольцев в течение 30 минут при +45 °С, согласно показателям хемилюминограмм, повышает чувствительность рецепторов нейтрофилов к гистамину, не влияет на чувствительность рецепторов нейтрофилов к инсулину, адреналину, а также рецепторов нейтрофилов крови небеременных женщин к эстрогену и прогестерону. Возможно, при повышении температуры окружающей среды до +45 °С на мембране нейтрофилов увеличивается количество гистаминовых, предположительно Н1-рецепторов [5] за счет синтеза новых или вовлечения резерва имеющихся в клетке, или иного, что влияет на активность НАДФН-оксидазы и вызывает респираторный взрыв.
Таким образом, полученные данные свидетельствуют о том, что температурный фактор имеет важное значение в регуляции бактерицидного механизма нейтрофилов. Возможность температурной модуляции активности НАДФН-оксидазы нейтрофилов через рецепторы к прогестерону у женщин и гистамину у женщин и мужчин может стать новым путем управления эффекторными механизмами иммунитета.
Рецензенты:Шардаков В.И., д.м.н., профессор, руководитель лаборатории иммунологии лейкозов, ФГБУН «Кировский НИИ гематологии и переливания крови» ФМБА России, г. Киров;
Хлыбова С.В., д.м.н., профессор, зав. кафедрой акушерства и гинекологии ИПО, ГБОУВПО «Кировская государственная медицинская академия» МЗ РФ, г. Киров.
Работа поступила в редакцию 18.03.2015.



