В последнее время интерес к проблеме применения пробиотиков в ветеринарной практике значительно повысился. Идет поиск новых видов микроорганизмов, перспективных для использования в составе пробиотических препаратов, совершенствуется технология их производства, создаются новые биопрепараты оригинального состава. Наблюдается устойчивая тенденция замещения пробиотическими препаратами антибиотиков, которые наиболее широко применяются в животноводстве с целью профилактики и лечения кишечных инфекций.
Основу большинства пробиотиков составляют различные виды антагонистически активных микроорганизмов: лактобацилл, бифидобактерий, энтерококков и др., выделенных из организма человека, продуктов питания или объектов внешней среды. Однако в последнее время интерес исследователей привлекают гомопробиотические микроорганизмы, предназначенные для использования в отношении того вида животных, из организма которых они были выделены [7].
Преимущества использования гомопробиотических штаммов в составе биопрепаратов связаны с тем, что выживаемость гомологичных бактерий в желудочно-кишечном тракте макроорганизма выше, чем чужеродных, из-за несоответствия новым условиям структуры адгезивных рецепторов, спектра вырабатываемых ферментов. Кроме того, часто чужеродные бактерии несовместимы с аутохтонной микрофлорой хозяина, поэтому их персистенция в желудочно-кишечном тракте кратковременна и не всегда обеспечивает положительный эффект от применения пробиотического препарата [5].
Лечебное действие биопрепарата зависит не только от входящего в его состав пробиотического штамма, но и от стабильности сохранения им полезных свойств на протяжении срока хранения пробиотика. Препараты, в состав которых входят лиофильно высушенные бактерии, способны достаточно долго храниться (до 1 года) и не очень требовательны к кратковременным изменениям температурных условий хранения. Но у них есть существенный недостаток – требуется 8–10 часов для их перехода от анабиоза к активному физиологическому состоянию. К тому же в процессе высушивания клетки теряют специфические рецепторы, которые обеспечивают их адгезию к эпителию слизистой кишечника, и время их пребывания в организме снижается. Также следует отметить, что лиофилизированные формы пробиотиков значительно дороже жидких биопрепаратов.
Бактериальные клетки в составе жидких препаратов остаются в физиологически активном состоянии и способны к колонизации желудочно-кишечного тракта уже через 2 часа после попадания в организм. Жидкие биопрепараты, кроме бактерий, содержат продукты их метаболизма, которые являются дополнительными лечебными факторами.
Качество бакпрепаратов формируется на этапах их изготовления и во многом зависит от компонентного состава и питательной ценности сред, используемых для культивирования микроорганизмов, особенностей технологического процесса получения биомассы для любых форм пробиотиков – как жидких, так и сухих [2].
Технология получения пробиотического препарата представляет собой многоэтапный процесс, включающий инокуляцию питательного бульона регидратированной сухой эталонной культурой, получение бульонной культуры во флаконах объемом 150–200 мл, получение посевных культур микроорганизмов путем выращивания в колбах объемом 500–1000 мл, глубинное культивирование в биореакторах разного объема, концентрирование суспензии и т.д. Для оптимизации технологической цепочки производства биопрепарата возможно сокращение количества этапов культивирования микроорганизмов. С этой целью, как правило, оптимизируют этап приготовления посевных культур [4].
Исходя из изложенного, наиболее высоким пробиотическим потенциалом обладают биопрепараты в жидкой форме на основе гомопробиотических микроорганизмов. Целью данного исследования является оптимизация технологии приготовления жидкой формы биопрепарата на основе гомопробиотического штамма Lactobacillus paracasei, предназначенного для лечения и профилактики дисбактериозов у поросят-отъемышей.
Материалы и методы исследования
Объектом исследования является штамм Lactobacillus paracasei, выделенный в 2012 г. из кишечного содержимого молочного поросенка. Штамм депонирован во Всероссийской коллекции промышленных микроорганизмов ГосНИИГенетики (г. Москва) в 2014 г. Данный штамм признан перспективным для создания пробиотического препарата ветеринарного назначения, так как обладает высокой антагонистической и адгезивной активностями, высоким уровнем кислотообразования, хорошим потенциалом накопления биомассы, а также устойчивостью к ряду антимикробных препаратов, используемых для профилактики и лечения дисбиотических состояний у поросят [6].
Для приготовления на основе штамма L. paracasei жидкой формы ветеринарного пробиотического препарата необходимо было провести ряд исследований, в частности выбрать питательную среду, отработать режим глубинного культивирования и условия получения концентрированных культур лактобактерий, осуществить выбор стабилизирующих добавок, обеспечивающих высокую выживаемость лактобацилл в биопрепарате в процессе длительного хранения.
В экспериментах по выбору питательной среды для глубинного выращивания штамма Lactobacillus paracasei использовали две жидкие питательные среды с разными концентрациями водородных ионов: 5,0; 6,3 и 8,0 ед. рН: среду МРС на капустном отваре [3] и готовую коммерческую среду МРС-1 производства HiMedia Laboratories. Одновременно изучали влияние интенсивности аэрации культуральной жидкости на скорость накопления биомассы. Суточные агаровые культуры в концентрации (4,0–4,5)∙1010 м.к./мл в объёме 0,1 мл засевали в жидкие питательные среды МРС на капустном отваре и МРС-1 во флаконах объемом 100 мл. Объем питательной среды во флаконах составлял 40 мл. Инкубирование осуществляли в течение одних суток при температуре (37 ± 1) °С в статических условиях или при встряхивании на шуттель-аппарате. Концентрацию микробов определяли с помощью спектрофотометрического метода с использованием спектрофотометра КФК-2 (Россия) при длине волны 540 нм.
Для получения посевных культур лактобактерии выращивали в жидкой питательной среде МРС на капустном отваре в колбах ёмкостью 500 мл. Объем питательной среды в колбе составлял 100 мл. Инкубирование осуществляли при шуттелировании (100 об/мин) в течение 18 часов при температуре (37 ± 1) °С. Для концентрирования суспензии лактобацилл колбы с выращенной культурой помещали в холодильник при температуре (8 ± 2) °С на 48 часов. Надосадочную жидкость декантировали, а к полученной суспензии добавляли стерильный глицерин до конечной концентрации 10 %, перемешивали. Суспензию разливали по 50 мл в стеклянные флаконы и помещали в низкотемпературный холодильник на хранение при температуре минус (70 ± 1) °С.
Отработку режимов глубинного культивирования лактобацилл проводили на биореакторе типа LiFlus GX производства Bio-Tron Inc (Республика Корея) емкостью 5,0 л. Для выращивания лактобацилл использовали жидкую питательную среду МРС-1, рН 7,0. Объем питательной среды в ферментере составлял 2,5 л. В качестве посевного материала использовали хранящуюся в замороженном состоянии в течение 1 месяца суспензию L. paracasei, приготовленную как указано выше. В 2,5 л стерильной жидкой питательной среды вносили 100 мл замороженной суспензии с биологической концентрацией 1,5∙1010 КОЕ/мл. Биологическую концентрацию определяли чашечным методом (среда МРС-1, (37 ± 1) °С, 2 сут). Культивирование лактобацилл проводили при температуре (37 ± 1) °С с аэрированием (4 л/мин) со скоростью вращения мешалки 60 об./мин в течение 24 часов. В качестве источника углерода использовали глюкозу, раствор которой вносили в питательную среду в процессе ее приготовления до конечной концентрации 2 %. Корректировку рН в культуральной жидкости в процессе выращивания лактобацилл не проводили, через каждые 3 часа отбирали пробы для определения концентрации живых микроорганизмов в культуре. По завершении процесса глубинного культивирования отбирали пробы нативной культуры и определяли показатель концентрации водородных ионов, оценивали морфологию бактерий в фиксированных мазках, окрашенных по методу Грама, и определяли оптическую и биологическую концентрации микроорганизмов.
Для изучения выживаемости лактобактерий в процессе хранения полученную нативную культуру разливали по 100 мл во флаконы. В каждый флакон вносили одну из следующих стабилизирующих добавок: хлорид натрия, глицерин, лактозу, сахарозу до конечной концентрации 10 %. Аскорбиновую кислоту добавляли до конечной концентрации 0,3 %. В качестве контроля использовали нативную культуру без стабилизирующих добавок. Флаконы с суспензией хранили в бытовом холодильнике при температуре (8 ± 2) °С. Через каждые 7 суток хранения делали высевы для определения концентрации живых лактобацилл в суспензии. Срок наблюдения составил 35 суток. Статистическую обработку результатов проводили согласно руководству И.П. Ашмарина и А.А. Воробьева [1].
Результаты исследований и их обсуждение
Данные по влиянию аэрации и рН питательных сред на накопление биомассы лактобацилл представлены в табл. 1 и 2.
Полученные результаты свидетельствуют о том, что максимальное накопление биомассы лактобактерий происходит при культивировании с аэрацией в жидкой питательной среде МРС на капустном отваре при исходной концентрации водородных ионов 8 ед. рН.
С целью оптимизации этапа культивирования лактобактерий была изучена возможность получения посевных культур, которые можно было бы хранить в замороженном состоянии длительное время и использовать по мере необходимости. Была выращена биомасса L. paracasei, биологическая концентрация которой перед заморозкой составляла (1,7 ± 0,4)∙1010 КОЕ/мл.
Для оценки сохраняемости живых лактобацилл в замороженной суспензии в течение года через каждые 4 месяца хранения делали высевы на плотную питательную среду МРС на капустном отваре. Результаты экспериментов представлены в табл. 3.
Представленные в табл. 3 данные свидетельствуют о хорошей сохраняемости лактобацилл в стабилизированных суспензиях в замороженном состоянии в течение одного года. Выживаемость микроорганизмов в замороженных суспензиях с глицерином составила более 70,6 %.
При изучении динамики содержания живых микробов в культуре при глубинном выращивании лактобактерий в биореакторе при температуре (37 ± 1) °С с аэрацией каждые три часа проводили отбор проб, в которых определяли биологическую концентрацию бактерий. Результаты представлены в табл. 4 и на рис. 1.
Таблица 1
Накопление биомассы лактобацилл при выращивании в жидких питательных средах с различной рН без аэрации (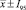 , n = 3)
, n = 3)
|
Питательная среда |
Оптическая плотность культуральной жидкости (OD540) при исходной концентрации водородных ионов в среде выращивания…, ед. рН |
||
|
5,0 |
6,3 |
8,0 |
|
|
МРС на капустном отваре |
0,74 ± 0,09 |
1,04 ± 0,29 |
1,15 ± 0,29 |
|
МРС-1 коммерческая |
0,55 ± 0,12 |
0,89 ± 0,06 |
0,86 ± 0,11 |
Таблица 2
Накопление биомассы лактобацилл при выращивании в жидких питательных средах с различной рН с аэрацией (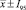 , n = 3)
, n = 3)
|
Питательная среда |
Оптическая плотность культуральной жидкости (OD540) при исходной концентрации водородных ионов в среде выращивания…, ед. рН |
||
|
5,0 |
6,3 |
8,0 |
|
|
МРС на капустном отваре |
0,94 ± 0,08 |
1,29 ± 0,06 |
1,34 ± 0,11 |
|
МРС-1 коммерческая |
0,72 ± 0,15 |
0,93 ± 0,16 |
0,94 ± 0,13 |
Таблица 3
Выживаемость лактобацилл в процессе хранения с 10 % глицерином при температуре минус (70 ± 1)°С (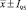 , n = 3)
, n = 3)
|
Срок хранения, мес. |
0 исходная |
4 |
8 |
12 |
|
Концентрация живых бактерий в суспензии, КОЕ/мл |
(1,7 ± 0,4)·1010 |
(1,4 ± 0,3)·1010 |
(1,2 ± 0,3)·1010 |
(1,2 ± 0,4)·1010 |
Таблица 4
Динамика содержания живых микробов в глубинной культуре Lactobacillus paracasei (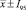 , n = 3)
, n = 3)
|
Время забора проб от начала культивирования, ч |
Биологическая концентрация бактерий в культуре, КОЕ/мл |
|
0 |
(0,9 ± 0,1)·108 |
|
3 |
(1,8 ± 0,1)·108 |
|
6 |
(5,8 ± 0,6)·108 |
|
9 |
(4,3 ± 0,2)·109 |
|
12 |
(4,7 ± 0,3)·109 |
|
15 |
(5,0 ± 0,2)·109 |
|
18 |
(5,4 ± 0,4)·109 |
|
21 |
(5,8 ± 0,7)·109 |
|
24 |
(6,1 ± 0,6)·109 |
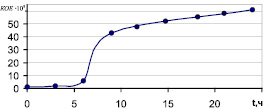
Рис. 1. График зависимости концентрации живых лактобактерий в глубинной культуре от времени выращивания
Таблица 5
Характеристики культуры Lactobacillus paracasei, выращенной в биореакторе, ( , n = 3)
, n = 3)
|
Концентрация водородных ионов, ед. рН |
Концентрация бактерий, n∙109 м.к./мл |
Объем культуры, л |
|
|
оптическая |
биологическая |
||
|
3,37 ± 0,12 |
9,77 ± 0,53 |
6,1 ± 0,21 |
2,50 ± 0,13 |
Графическое отображение динамики роста лактобактерий при культивировании в биореакторе представлено на рис. 1.
В табл. 5 представлены характеристики полученной нативной культуры.
Кроме того, была изучена морфология бактерий в нативных культурах методом микроскопии мазков, окрашенных по Граму: лактобациллы во всех препаратах сохраняли типичную морфологию и тинкториальные свойства.
Полученные результаты свидетельствовали о том, что выбранные условия выращивания лактобацилл в биореакторе обеспечивают получение нативной культуры Lactobacillus paracasei, пригодной для приготовления биопрепарата.
При выборе стабилизирующих добавок, обеспечивающих высокую выживаемость лактобацилл в биопрепарате при хранении, были изучены следующие вещества: хлорид натрия, глицерин, лактоза, сахароза в конечной концентрации 10 % и аскорбиновая кислота в конечной концентрации 0,3 %. Концентрацию живых бактерий в процессе хранения при температуре (8 ± 2) °С нативной культуры с внесенными добавками определяли через каждые 7 суток путем высева на плотную питательную среду МРС с капустным отваром. Результаты определений представлены в табл. 6 и на рис. 2.
Таблица 6
Выживаемость лактобактерий в суспензии с различными стабилизирующими добавками при хранении при температуре (8 ± 2) °С, ( , n = 3)
, n = 3)
|
Срок хранения, сут |
Концентрация лактобактерий КОЕ/мл в в суспензии с добавлением… |
|||||
|
хлорида натрия |
глицерина |
лактозы |
сахарозы |
аскорбиновой кислоты |
контроль (без добавок) |
|
|
0 |
(5,4 ± 0,3)∙1010 |
(5,7 ± 0,5)∙1010 |
(5,2 ± 0,2)∙1010 |
(5,9 ± 0,3)∙1010 |
(5,6 ± 0,3)∙1010 |
(5,5 ± 0,2)∙109 |
|
7 |
(4,5 ± 0,3)∙109 |
(8,3 ± 0,1)∙109 |
(2,3 ± 0,4)∙1010 |
(9,1 ± 0,4)∙109 |
(2,3 ± 0,2)∙1010 |
(1,3 ± 0,1)∙109 |
|
14 |
(9,7 ± 0,3)∙108 |
(2,4 ± 0,1)∙109 |
(1,4 ± 0,2)∙1010 |
(3,7 ± 0,3)∙109 |
(2,0 ± 0,2)∙1010 |
(9,4 ± 0,5)∙108 |
|
21 |
(5,2 ± 0,4)∙108 |
(1,8 ± 0,2)∙109 |
(4,1 ± 0,3)∙109 |
(4,1 ± 0,3)∙109 |
(7,1 ± 0,2)∙108 |
(4,1 ± 0,2)∙108 |
|
28 |
(5,0 ± 0,1)∙107 |
(1,8 ± 0,1)∙107 |
(2,1 ± 0,2)∙108 |
(8,4 ± 0,5)∙109 |
(2,5 ± 0,2)∙107 |
(2,7 ± 0,3)∙107 |
|
35 |
(2,3 ± 0,3)∙107 |
(1,1 ± 0,2)∙107 |
(1,3 ± 0,4)∙107 |
(7,4 ± 0,6)∙108 |
(1,3 ± 0,2)∙107 |
(1,1 ± 0,1)∙106 |

Рис. 2. Динамика снижения биологической концентрации лактобактерий в суспензии с разными стабилизирующими добавками при хранении при температуре (8 ± 2) °С (представлены среднеарифметические значения)
На рис. 2 представлена биологическая концентрация лактобактерий в суспензии с разными стабилизирующими добавками в зависимости от сроков хранения при температуре (8 ± 2) °С.
Из представленных в табл. 6 и на рис. 2 данных следует, что в течение 14 суток хранения наибольшую выживаемость лактобацилл в суспензии обеспечивали аскорбиновая кислота в концентрации 0,3 % (количество живых бактерий осталось практически на исходном уровне) и сахароза в концентрации 10 % – количество живых микроорганизмов уменьшилось с (5,9 ± 0,3)∙1010 до (3,7 ± 0,3)∙109 КОЕ/мл. При дальнейшем хранении наиболее высокая выживаемость лактобактерий наблюдалась в суспензии с добавлением сахарозы; через 28 суток хранения этот показатель составил (8,4 ± 0,5)∙109 КОЕ/мл. При использовании в качестве стабилизирующей добавки аскорбиновой кислоты концентрация живых лактобацилл в культуральной жидкости через 14 суток хранения начала быстро снижаться и к 28 суткам составила (2,5 ± 0,2)∙107 КОЕ/мл.
Таким образом, было установлено, что для обеспечения высокой выживаемости лактобацилл в суспензии при хранении в бытовом холодильнике не более двух недель целесообразно использовать сахарозу в конечной концентрации 10 % или аскорбиновую кислоту в конечной концентрации 0,3 %, а для сохранения бактерий в жизнеспособном состоянии в течение 28–35 суток в нативную культуру необходимо вносить сахарозу до конечной концентрации 10 %. Указанные стабилизирующие добавки целесообразно использовать при изготовлении конечной формы жидкого пробиотического препарата на основе штамма Lactobacillus paracasei.
Заключение
Таким образом, отработаны следующие условия приготовления жидкой формы биопрепарата на основе штамма Lactobacillus paracasei: наибольший выход биомассы достигается при глубинном культивировании лактобактерий при температуре (37 ± 1) °С в течение 18 часов в аэрируемых условиях (4 л/мин) при скорости вращения мешалки 60 об/мин в жидкой питательной среде МРС на капустном отваре при начальной концентрации водородных ионов 8 ед. рН.
Наибольшую выживаемость лактобацилл в течение первых 14 суток хранения жидкой стабилизированной суспензии обеспечивают аскорбиновая кислота в концентрации 0,3 % и сахароза в концентрации 10 %: количество живых бактерий практически остается на исходном уровне; при хранении в течение 35 суток наибольшая выживаемость лактобактерий достигается при внесении в биопрепарат сахарозы до конечной концентрации 10 %.
С целью сокращения продолжительности и трудоемкости этапа приготовления посевных культур лактобацилл были отработаны условия выращивания, концентрирования и стабилизации микробной суспензии для хранения в замороженном состоянии. При использовании в качестве криопротектора глицерина в концентрации 10 % микробные культуры могут храниться при температуре минус (70 ± 1) °С до 1 года, и после размораживания использоваться в качестве посевных материалов, что позволяет сократить срок получения конечной формы биопрепарата до одних суток и обеспечить возможность получения кондиционной нативной культуры при глубинном выращивании лактобацилл.
Рецензенты:Романов В.Е., д.м.н., профессор кафедры хирургии, акушерства и заразных болезней, ФГБОУ ВПО «Вятская ГСХА», г. Киров;
Егошина Т.Л., д.б.н., профессор кафедры экологии и зоологии, ФГБОУ ВПО «Вятская ГСХА», г. Киров.
Работа поступила в редакцию 18.03.2015.



