Оксидные соединения железа обладают богатой палитрой окраски, благодаря чему находят широкое применение в строительной отрасли (производство лакокрасочных продуктов с хорошими результатами по маслоемкости и укрывистости поверхностей; приготовление цементно-песчаных окрашенных смесей и др.) [1, 10]. Однако качество произведенных продуктов существенным образом зависит от влагопоглощающей способности пигментов (использование в лакокрасочных продуктах органических растворителей требует пигмент с гидрофобными свойствами; водная среда затворения цементно-песочных композиций диктует использование пигмента с гидрофильными свойствами) [1, 11].
При многотоннажном объеме производства пигментов становится актуальным поиск экспрессных методик оценки их влагопоглощающей способности.
Одним из экспрессных методов является метод рН-метрии, обладающий с практической точки зрения рядом преимуществ: доступность и дешевизна инструментального оформления, экспрессность получения результатов, простота обработки и интерпретации результатов исследования [5]. Исследования методом рН-метрии позволяют выявить взаимосвязь значений рН системы «твердое тело – жидкость» с иными физико-химическими свойствами порошкообразных веществ, что неоднократно подтверждалось на других оксидных системах [3–8, 12].
Для оценки влагопоглощающей способности твердых тел результаты рН-метрии до настоящего времени не применялись. Однако теоретические предпосылки к этому имеются и заключаются в следующем. Известно [8], что взаимодействие в системе «твердое тело – вода» носит кислотно-основной характер и состоит из последовательных стадий развития или продвижения реакционной зоны (ионно-обменная адсорбция, гидратация, гидролиз), которые различаются по скорости массо- и тепло-переноса. Поскольку реакционная зона возникает не на всей поверхности сразу, а лишь на активных центрах поверхности, то кислотно-основное взаимодействие зависит от природы, силы и концентрации активных центров и предопределено изначально биографией твердого тела. Подвод к активным центрам поверхности молекул воды и отвод в среду продуктов реакции Н+ или ОН– –ионов формирует превалирующее направление диффузионных потоков и определяет скорость массо- и тепло-переноса. Исследование изменения скорости массо- и тепло-переноса (набор и спад в каждый конкретный момент времени) позволяет судить о причинах торможения диффузионных потоков и о влагопоглощающей способности твердого тела (гидрофобность или гидрофильность).
В настоящей работе представлены результаты исследований, целью которых является оценка влагопоглощающей способности дисперсных материалов по кинетическим изменениям значений рН водной суспензии.
В качестве аналитического сигнала скорости массопереноса «WрН» в данной работе впервые рассматривается изменение рН суспензии в единицу времени (WрН = ΔpHi/Δτ, мин). Условия эксперимента: прибор «рН-метр 150М», дистиллированная вода кислотностью 6,7...6,9 ед. рН по ГОСТ 6709–72, время эксперимента составляет от 5 минут до 2 часов.
Результаты исследования и их обсуждение
Получение железооксидных пигментов основано на использовании природного сырья или отходов производств [1], поэтому в их состав входят различные примеси. В качестве объектов исследования нами выбраны пигменты нанометрического уровня дисперсности с преобладающими фазами гематита α-Fe2O3 (образец № 1) и магнетита Fe3O4 (образец № 2), полученные из шламов водоподготовки [10, 12].
Экспериментальные результаты показывают, что наибольшие изменения аналитического сигнала наблюдаются в первые 3–5 минут контакта. Различный ход и расположение кинетических кривых рН водной суспензии относительно уровня нейтральности (рис. 1), а также различие в наборе и спаде скорости массопереноса «WрН» (рис. 2) зависят от особенности внутренней структуры образцов.
● Гематит α-Fe2O3. Активными центрами поверхности в гематите α-Fe2O3 являются катионы Fe3+, находящиеся в октаэдрической координации по кислороду. В таком окружении плотность отрицательного заряда повышена. Из-за частичной гидратации реальной поверхности на первичных центрах Льюиса сформирован естественный двумерный гидратно-гидроксильный покров адсорбированных из воздушной среды молекул воды, который представляет собой вторичные основные центры бренстедовского типа (О2¯… Н+/ОН¯). Вследствие этого при контакте с водой протекает подщелачивание суспензии [5, 8].
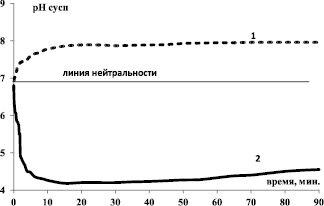
Рис. 1. Изменение во времени рН водной суспензии образцов: 1 – α-Fe2O3; 2 – Fe3O4
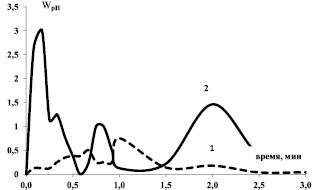
Рис. 2. Изменение скорости массопереноса (WрН) во времени для образцов: 1 – α-Fe2O3; 2 – Fe3O4
Набор скорости ионообменного взаимодействия (рис. 2, кривая 1) протекает более дискретно и длительно, чем спад, что свидетельствует о внешнедиффузионном торможении реакции [8–9]. Торможение обусловлено естественно сформированной экранирующей гидратно-гидроксильной поверхностной пленкой за счет нековалентных (водородных) связей между основными центрами бренстедовского типа. Электростатическое и донорно-акцепторное взаимодействие, а также эффекты среды (сольвофобные взаимодействия) [2] приводят к снижению процесса смачивания, препятствуют диффузии молекул воды через узкие сужения в расположенные за ними полости. Снижение доступной поверхности и степени объемного заполнения адсорбционного пространства пор оксида металла молекулами воды характеризует гидрофобность поверхности.
● Магнетит Fe3O4. Магнетит [1, 11–12] относится к числу координационных кристаллов, которые содержат атомы переходного металла в двух различных состояниях Fe3+[Fe2+Fe3+]O4. Исходя из принципа реализации минимальной электростатической энергии кристалла (которая определяется кулоновской энергией притяжения-отталкивания заряженных частиц и их размерами), расположение катионов Fe2+ наиболее выгодно в тетраэдрических позициях шпинели, а Fe3+ – в октаэдрических узлах. Превалирующими активными центрами поверхности Fe3O4 являются нестехиометрические Fe2+-катионы. Свежеобразованная поверхность с разорванными связями обладает избыточной энергией, поэтому практически мгновенно происходит насыщение связей за счет адсорбции молекул из окружающей среды (Fe2+…ОН¯/Н+), так как энергетически выгоднее покрытие ионами ОН– и молекулами воды, чем хемосорбция ионов О2–. В этом случае плотность положительного заряда поверхности повышена, обеспечивается её кислотная функция за счет образования кислотных центров Бренстеда [8]. Вследствие этого при контакте с водой наблюдается подкисление суспензии (рис. 1, кривая изменения рН суспензии лежит ниже уровня нейтральности).
Набор скорости массопереноса резкий, а спад – медленный и дискретный (рис. 2, кривая 2). Это свидетельствует о перемещении зоны взаимодействия в глубину: протекание ионо-обменной реакции на разных по глубине участках зерна изменяет условия транспорта реагентов и продуктов. При достижении некоторой (критической) концентрации двумерный гидратно-гидроксильный покров претерпевает фазовый переход, на поверхности возникает ансамбль трехмерных островков жидкой фазы, островки жидкой фазы сливаются в сплошной слой, протекает процесс гидратации (смачивания). А затем процесс смачивания продвигается вглубь зерна твердого тела, скорость дискретно изменяется за счет поэтапного повышения-снижения доступной для взаимодействия поверхности. Такая последовательность набора и спада скорости массопереноса согласуется с принятым в литературе [8–9, 11] механизмом объемного заполнения пористого пространства адсорбента раствором адсорбата (механизм внутридиффузионного торможения) и характеризует гидрофильность поверхности твердого тела
Заключение
Таким образом, влагопоглощающая способность твердого тела зависит от механизма торможения кислотно-основного взаимодействия в системе «твердое тело – вода» и предопределена изначально типом функциональных групп естественно сформированного гидратно-гидроксильного покрова. Исследование кислотно-основного взаимодействия в системе «твердое тело – вода» методом рН-метрии позволяет получить сведения о скорости массопереноса, механизм набора и спада которой определяет влагопоглощающую способность твердого тела (гидрофобность или гидрофильность). Использование результатов рН-метрии упрощает и ускоряет процесс оценки гидрофилизации поверхности, что экономически выгодно и ресурсно малозатратно.
Рецензенты:Козик В.В., д.т.н., профессор, заведующий кафедрой неорганической химии, ХФ ТГУ, г. Томск;
Саркисов Ю.С., д.т.н., профессор, заведующий кафедрой химии, ООФ ТГАСУ, г. Томск.
Работа поступила в редакцию 18.03.2015.



