Настоящая работа является продолжением наших исследований, посвященных тестированию ингибиторов окисления различного химического строения кинетическими методами [4, 5]. По результатам антиоксидантной активности ряда лекарственных препаратов, независимо от спектра их фармакологического действия, было выявлено наиболее эффективное соединение – осалмид (2-гидрокси-N-(4-гидроксифенил)бензамид). В Новосибирском институте органической химии им. Н.Н. Ворожцова СО РАН на базе структуры осалмида направленным синтезом была получена группа замещенных амидов салициловой кислоты, имеющих в орто-положении экранирующие трет-бутильные заместители [3]. Ранее сравнительного анализа ингибирующих свойств соединений с целью выявления среди них активных антиоксидантов (АО) не проводилось. Представлялось актуальным изучить антиоксидантные свойства новых амидов салициловой кислоты в зависимости от структуры, указать перспективы дальнейшей химической модификации соединений с рациональной комбинацией нескольких активных центров.
Цель исследования – тестирование антирадикальной активности, брутто-ингибирующего действия новых амидов салициловой кислоты в сравнении со стандартными антиоксидантами: дибунолом и α-токоферолом, установление взаимосвязи между их строением и антиоксидантной активностью.
Материалы и методы исследования
Антиоксидантную активность (АОА) изучали волюмометрическим методом поглощения кислорода в модифицированной установке типа Варбурга при окислении метилолеата (МО) в среде инертного растворителя хлорбензола. Процесс инициировали за счет термического разложения 3∙10−3 М 2,2′-азобисизобутиронитрила (АИБН) в пробе при t = (60 ± 0,2) °С, Wi = 4,2∙10−8 М∙с−1. В качестве критериев оценки антиоксидантных свойств соединений использовали – периоды индукции (t), начальные и максимальные скорости окисления (Wнач, Wmax). Антиоксидантную активность количественно определяли по формуле АОА = ti – tS/tS, где tS и ti – периоды индукции окисления субстрата в отсутствие и в присутствии исследуемого АО соответственно. Антирадикальную активность (АРА) соединений тестировали в системе инициированного окисления этилбензола хемилюминесцентным методом (ХЛ) по известной методике [8]. Окисление инициировалось АИБН при t = (60 ± 0,2) °С, Wi = 2,3∙10-8 М∙с–1 [6]. Кинетику накопления гидропероксидов изучали при аутоокислении линолевой кислоты (ЛК) методом обратного йодометрического титрования в среде хлорбензола, t = (60 ± 0,2) °С.
Результаты исследования и их обсуждение
На рис. 1 показаны формулы исследуемых соединений (I–IV), представляющие собой амидные производные салициловой кислоты. Большинство из указанных соединений содержат орто-трет-бутильные заместители и являются пространственно затрудненными фенолами. В качестве стандартных АО использовались α-токоферол (V) и дибунол (VI).
Методом хемилюминесценции в группе исследуемых соединений была оценена величина константы скорости реакции k7 АО с пероксильными радикалами [8].
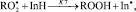
где InH – ингибитор окисления; In· – радикал ингибитора;  – пероксильный радикал. Определен фактор ингибирования f, показывающий количество свободных радикалов, реагирующих с молекулой ингибитора (табл. 1). При исследовании кинетики изменения интенсивности ХЛ в присутствии исследуемых соединений было установлено, что все АО оказывают ингибирующее действие на процесс окисления модельного субстрата. Наибольшую активность в реакциях с пероксильными радикалами из производных салициловой кислоты проявлял осалмид (табл. 1).
– пероксильный радикал. Определен фактор ингибирования f, показывающий количество свободных радикалов, реагирующих с молекулой ингибитора (табл. 1). При исследовании кинетики изменения интенсивности ХЛ в присутствии исследуемых соединений было установлено, что все АО оказывают ингибирующее действие на процесс окисления модельного субстрата. Наибольшую активность в реакциях с пероксильными радикалами из производных салициловой кислоты проявлял осалмид (табл. 1).
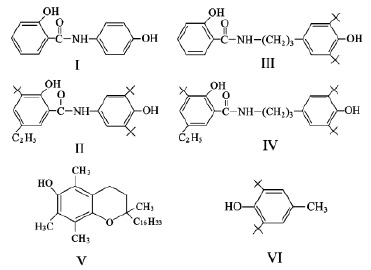
Рис. 1. Химические формулы изучаемых соединений
Таблица 1
Кинетические характеристики АО различного химического строения
|
№ п/п |
Название АО |
k7∙104, М–1∙с–1 |
f |
|
I |
2-гидрокси-N-(4-гидроксифенил)бензамид, Осалмид, Амид I |
6,86 |
2,4 |
|
II |
3-трет-бутил-N-(3,5-ди-трет-бутил-4-гидроксифенил)-5-этил-2-гидроксибензамид, Амид II |
1,69 |
2,6 |
|
III |
N-[3-(3,5-ди-трет-бутил-4-гидроксифенил)пропил]-2-гидроксибензамид, Амид III |
0,52 |
3,3 |
|
IV |
3-трет-бутил-N-[3-(3,5-ди-трет-бутил-4-гидроксифенил)пропил]-5-этил-2-гидроксибензамид, Амид IV |
0,85 |
3,6 |
|
V |
a-Токоферол (2,5,7,8-тетраметил-2-(4,8,12-триметилтридецил)хроман-6-ол) |
360 |
2,0 |
|
VI |
Дибунол (1-гидрокси-2,6-ди-трет-бутил-4-метилбензол) |
1,40 |
2,0 |
Высокая константа скорости реакции k7 осалмида связана с наличием p-r-сопряжения между амидной группой и фенолом. Анализ значений констант скорости реакций k7 структур, отличающихся степенью экранированности ОН-группы, показывает, что введение экранирующих заместителей приводит к существенному снижению антирадикальной активности АО (табл. 1). Сопоставление антирадикальной активности исследуемых нами аминофенолов, у которых амидная группа находится на разном удалении от бензольного кольца, показывает, что по мере удаления этих групп снижается возможность p-r-сопряжения и значение константы уменьшается вдвое (табл. 1).
Таким образом, существует тесная взаимосвязь между значением константы скорости реакции k7 и природой заместителя в пара-положении. Полученные нами данные о характере влияния заместителей разной природы согласуются со сведениями, приводимыми в известных монографиях и обзорах [1, 2, 7, 9].
Сравнение констант скорости реакции k7 исследуемых фенолов и a-токоферола показывает, что основной природный АО более активен в реакциях с пероксильными радикалами (практически в 360 раз). Стехиометрический фактор ингибирования f для большинства изучаемых соединений был близок или равен 3 (табл. 1).
При помощи компьютерной программы Current Gaussian 09 Revision D.01 были рассчитаны длины связей между атомами в молекуле осалмида, возможность образования внутримолекулярной водородной связи (ВВС), дипольные моменты (µ) и энергии активации молекул (Еа). Показано, что длина связи O–H в ароматическом кольце А соединения (0,98787∙10–10 м) больше, чем длина связи O–H в кольце Б (0,96282∙10–10 м) (рис. 2). Наиболее активными O–H группами в реакциях с пероксильными радикалами являются гидроксильные группы из кольца А. Длина ВВС между группами O-H...O = C составляла 1,67786∙10–10 м. Длина связи C–N в молекуле осалмида составляла 1,36458∙10–10 м. Дипольный момент и энергия активации молекулы осалмида составляет 2,6778 D и –782,6772869 кДж/моль соответственно. Показано, что осалмид не образует ВВС между группами N–H...O–H, по расчетам длина связи будет составлять 2,12221∙10–10 м, а дипольный момент µ = 3,3548 D, поэтому существование такой молекулы не является оптимальным. Введение трет-бутильного заместителя в бензольное кольцо А увеличивает длину связи O–H в соединениях. Длина ВВС между группами O–H...O = C уменьшается с введением в орто-положение трет-бутильных заместителей (табл. 2). В молекулах амидов салициловой кислоты с увеличением заместителей в орто- и пара-положении длина связи C–N изменяется от 1,36458∙10–10 м (осалмид) до 1,35994∙10–10 м (Амид IV).
Ингибирующее действие всех указанных соединений тестировалось в широком диапазоне концентраций (5∙10–5–3∙10–3 М) и сравнивалось с действием известных АО – дибунолом, a-токоферолом. Было показано, что исследуемые АО увеличивают периоды индукции окисления модельного субстрата МО. На рис. 3 приведены кинетические кривые окисления МО в присутствии равных концентраций различных АО. Для всех синтетических антиоксидантов наблюдалась линейная зависимость между периодом индукции и концентрацией (рис. 4). Периоды индукции с добавками α-токоферола нарастали до концентрации 2,5∙10–3 М, свыше которой происходило постепенное снижение эффективности торможения процесса. Брутто-ингибирующая активность пространственно затрудненных фенолов была выше практически в 2 раза пространственно незатрудненных АО (табл. 3). Осалмид, имеющий высокое значение константы скорости реакции k7 взаимодействия с  -радикалами, проявлял наименьшую антиоксидантную активность, что обусловлено отсутствием в его структуре экранирующих трет-бутильных заместителей. Осалмид образует достаточно активные феноксильные радикалы (In·), которые участвуют в реакциях продолжения цепей с молекулами субстрата (RH):
-радикалами, проявлял наименьшую антиоксидантную активность, что обусловлено отсутствием в его структуре экранирующих трет-бутильных заместителей. Осалмид образует достаточно активные феноксильные радикалы (In·), которые участвуют в реакциях продолжения цепей с молекулами субстрата (RH):
In· + RH → R· + InH.
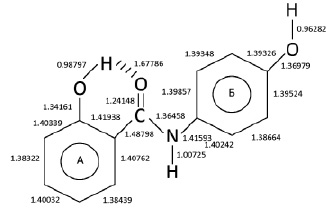
Рис. 2. Длины связей между атомами в молекуле осалмида
Таблица 2
Расчетные параметры длины связей между атомами, дипольного момента и энергии активации молекул антиоксидантов при помощи компьютерной программы Current Gaussian 09 Revision D.01, номер антиоксиданта соответствует рис. 1
|
Название АО |
Длина связи O–H (бензольное кольцо А), ∙10–10 м |
Длина связи O–H (бензольное кольцо Б), ∙10–10 м |
Энергия активации Еа молекулы АО, кДж/моль |
Дипольный момент, µ, D |
Длина связи O–H ... O = C, ∙10–10 м |
|
Амид I |
0,98787 |
0,96282 |
–782,6772869 |
2,6778 |
1,67786 |
|
Амид II |
0,99792 |
0,96073 |
–1332,8884321 |
2,0732 |
1,60562 |
|
Амид III |
0,99633 |
0,96117 |
–1214,9407749 |
2,1775 |
1,63868 |
|
Амид IV |
1,00105 |
0,96115 |
–1450,8413009 |
2,0449 |
1,59062 |
|
Дибунол |
0,96093 |
– |
–661,3149206 |
1,8521 |
– |
Сопоставление между собой ряда структур амидов салициловой кислоты (II, III, IV) (табл. 3) показывает, что разделение между собой тремя метиленовыми группами амидного и фенольного фрагментов молекулы приводит к повышению брутто-ингибирующего действия АО. Очевидно, этот эффект связан с отсутствием p-r-сопряжения между амидной группой и бензольным ядром. В литературе были получены аналогичные закономерности для других групп соединений [2, 7, 9]. Было установлено, что структуры (III, IV) близки по своему антиоксидантному действию (табл. 3). Ингибиторы «гибридной» структуры либо близки (I, II), либо превосходят (III, IV) по своему действию природный АО – a-токоферол, а структура (IV) соизмеримы с эффективностью дибунола (табл. 3, рис. 4).
Показано, что ОН-группа, расположенная в орто-положении к карбоксильной СООН-группе, независимо от степени ее экранирования, не вносит существенного вклада в эффективность ингибирования (табл. 3). На основании полученных данных можно рекомендовать осуществление синтеза потенциальных АО, у которых экранированная фенольная ОН-группа должна находиться в пара-положении к амидной группе, что исключит возможность образования внутримолекулярной водородной связи. Направленный синтез указанных соединений позволит создать новую группу высокоэффективных ингибиторов окисления.
В работе была проанализирована закономерность изменения начальной (Wo2нач) и максимальной (Wo2max) скорости окисления в присутствии различных концентраций АО. Изучение показало, что указанные кинетические параметры практически не изменяются с ростом концентрации дибунола и α-токоферола, но существенно уменьшаются при введении ингибиторов, содержащих амидную группу (табл. 3). По всей вероятности, выявленная закономерность связана с участием амидных производных салициловой кислоты в реакции нерадикального разрушения гидропероксидов. Для подтверждения гипотезы о возможном разрушении гидропероксидов под действием «гибридных» АО были проведены эксперименты по прямому тестированию кинетики накопления гидропероксидов (ROOH) после введения в частично окисленную линолевую кислоту каждого из исследуемых АО (рис. 5). Влияние всех АО было однотипным: после внесения ингибитора в течение первого часа наблюдалось снижение концентрации гидропероксидов практически до исходного уровня, который в дальнейшем не возрастал в течение всего периода наблюдений (8 часов). В контроле гидропероксиды продолжали накапливаться. По масштабу разрушения гидропероксидов исследуемые АО были сравнимы между собой, однако у осалмида указанные свойства были наиболее выражены. Установлено, что все исследуемые соединения способствовали разрушению гидропероксидов на 70–75 % (табл. 4).
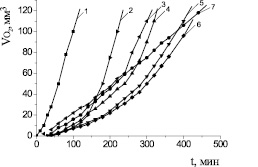
Рис. 3. Кинетические кривые поглощения кислорода МО в среде хлорбензола в присутствии АО: 1 – контроль; 2 – a-токоферол; 3 – дибунол; 4 – Амид (II); 5 – Амид (III); 6 – Амид (IV); 7 – Амид (I); С(АО) = 2∙10–4 М, Wi = 4,2∙10–8 М∙c–1, t = 60 °С. Номер антиоксиданта соответствует рис. 1
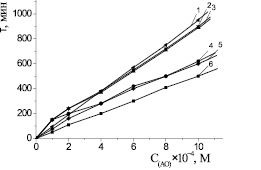
Рис. 4. Зависимость периодов индукции от концентрации АО: 1 – дибунол; 2 – Амид (IV); 3 – Амид (III); 4 – Амид (II); 5 – a-токоферол; 6 – Амид (I); Wi = 4,2∙10–8 М∙c–1, t = 60 °С. Номер антиоксиданта соответствует рис. 1
Таблица 3
Кинетические параметры инициированного окисления метилолеата в присутствии различных концентраций исследуемых антиоксидантов, номер антиоксиданта соответствует рис. 1, Wi = 4,2∙10–8 М∙c–1, t = 60 °С
|
С(АО)∙10–4, М |
tинд, мин |
Wo2 нач∙10–7, M∙c–1 |
Wo2 max∙10–7, M∙c–1 |
Wo2 max MO/Wo2 max AO |
АОА = ti – tS/tS |
|
Метилолеат |
|||||
|
0 |
26 |
1,90 |
8,00 |
– |
– |
|
Амид I |
|||||
|
1 |
50 |
1,24 |
3,10 |
2,6 |
1,9 |
|
2 |
110 |
1,06 |
2,19 |
3,7 |
4,2 |
|
4 |
200 |
0,76 |
1,98 |
4,0 |
7,7 |
|
6 |
300 |
0,62 |
1,30 |
6,2 |
11,5 |
|
8 |
410 |
0,46 |
1,18 |
6,8 |
15,8 |
|
10 |
500 |
0,37 |
1,12 |
7,1 |
19,2 |
|
Амид II |
|||||
|
1 |
150 |
1,06 |
7,14 |
1,1 |
5,8 |
|
2 |
200 |
0,62 |
4,60 |
1,7 |
7,7 |
|
4 |
280 |
0,47 |
3,40 |
2,4 |
10,8 |
|
6 |
420 |
0,32 |
3,39 |
2,4 |
16,2 |
|
8 |
500 |
0,29 |
3,26 |
2,5 |
19,2 |
|
10 |
620 |
0,27 |
2,38 |
3,4 |
23,8 |
|
Амид III |
|||||
|
1 |
150 |
1,76 |
3,72 |
2,2 |
5,8 |
|
2 |
240 |
0,83 |
3,26 |
2,5 |
9,2 |
|
4 |
370 |
0,73 |
3,12 |
2,6 |
14,2 |
|
6 |
540 |
0,61 |
2,87 |
2,8 |
20,8 |
|
8 |
710 |
0,52 |
2,46 |
3,3 |
27,3 |
|
10 |
890 |
0,35 |
2,11 |
3,8 |
34,2 |
|
Амид IV |
|||||
|
1 |
150 |
1,73 |
3,65 |
2,2 |
5,8 |
|
2 |
240 |
0,64 |
3,24 |
2,5 |
9,2 |
|
4 |
380 |
0,48 |
3,10 |
2,6 |
14,6 |
|
6 |
550 |
0,33 |
2,84 |
2,8 |
21,2 |
|
8 |
720 |
0,31 |
2,26 |
3,5 |
27,7 |
|
10 |
900 |
0,27 |
2,05 |
3,9 |
34,6 |
|
a-Токоферол |
|||||
|
1 |
75 |
0,78 |
6,52 |
1,2 |
2,9 |
|
2 |
160 |
0,78 |
6,51 |
1,2 |
6,2 |
|
4 |
280 |
0,76 |
6,42 |
1,2 |
10,8 |
|
6 |
400 |
0,77 |
6,50 |
1,2 |
15,4 |
|
8 |
500 |
0,76 |
6,34 |
1,2 |
19,2 |
|
10 |
600 |
0,76 |
6,42 |
1,2 |
23,1 |
|
Дибунол |
|||||
|
1 |
95 |
0,72 |
6,43 |
1,2 |
3,7 |
|
2 |
190 |
0,68 |
6,32 |
1,3 |
7,3 |
|
4 |
380 |
0,69 |
6,21 |
1,3 |
14,6 |
|
6 |
570 |
0,67 |
6,40 |
1,3 |
21,9 |
|
8 |
750 |
0,68 |
6,12 |
1,3 |
28,9 |
|
10 |
950 |
0,69 |
6,30 |
1,3 |
36,5 |
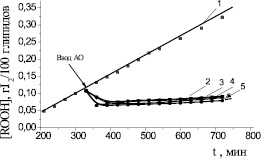
Рис. 5. Кинетика накопления гидропероксидов при аутоокислении линолевой кислоты в присутствии равных концентраций АО: 1 – контроль; 2 – Амид (II); 3 – Амид (III); 4 – Амид (IV); 5 – Амид (I). Стрелкой показан ввод АО. С(АО) = соnst = 2∙10–4 M, t = 60 °C. Номер антиоксиданта соответствует рис. 1
Таблица 4
Кинетика разрушения гидропероксидов при аутоокислении линолевой кислоты в присутствии равных концентраций АО, С(АО) = соnst = 2∙10–4M, номер антиоксиданта соответствует рис. 1, t = 60 °C
|
№ п/п |
Состав |
WROOH∙10–4, гI2/100 г лип.∙с–1 |
Процент разрушения ROOH за 7 часов |
|
1 |
ЛК (контроль) |
5,52 |
– |
|
2 |
ЛК + Амид (I) |
3,81 |
72,9 |
|
3 |
ЛК + Амид (II) |
3,33 |
71,7 |
|
4 |
ЛК + Амид (III) |
3,42 |
71,9 |
|
5 |
ЛК + Амид (IV) |
3,48 |
72,2 |
Следовательно, изучаемые соединения в процессе окисления способны как эффективно уничтожать пероксильные радикалы, так и разрушать гидропероксиды молекулярным путем. Вероятно, что антирадикальная активность ингибиторов обусловлена присутствием в их химической структуре фенольного гидроксила, а способность разрушения гидропероксидов связана с наличием амидной группы. Полученные результаты могут служить методологической основой для оценки комплексного действия антиоксидантов, перспективных для стабилизации окисления пищевых и биологически активных липидов, лекарственных препаратов, косметических средств. Исследуемые АО малотоксичные и могут использоваться в медицине, косметологии, пищевой технологии. Антиоксидантные свойства новых перспективных амидов салициловой кислоты защищены патентами на изобретение.
Выводы
1. Изучена кинетика окисления модельного субстрата в присутствии новых перспективных производных салициловой кислоты. Показано, что все амиды салициловой кислоты (I–IV) эффективно тормозят процесс окисления метилолеата.
2. Хемилюминесцентным методом определены значения констант скорости реакции k7 антиоксидантов (I–IV) с пероксильными радикалами (0,52–6,86)∙104 М–1∙с–1.
3. Установлено, что введение экранирующих орто-трет-бутильных заместителей и разделение ароматических фрагментов тремя метиленовыми группами приводит к увеличению антиоксидантной активности соединений.
4. Показано, что введение экранирующих орто-трет-бутильных заместителей и разделение ароматических фрагментов тремя метиленовыми группами приводит к уменьшению значений констант скорости реакции k7 с антиоксидантами.
5. Установлена способность амидов салициловой кислоты (I–IV) при аутоокислении линолевой кислоты разрушать гидропероксиды до 70–75 % без образования свободных радикалов.
6. На основе полученных данных можно рекомендовать осуществление синтеза потенциальных антиоксидантов, у которых экранированная фенольная ОН-группа должна находиться в пара-положении к амидной группе, что исключит возможность образования внутримолекулярной водородной связи.
7. Антиоксидантные свойства новых перспективных амидов салициловой кислоты защищены патентами на изобретение. Изобретения относятся к получению состава, стабилизирующего процесс окисления липидов, липидосодержащих пищевых добавок, лечебно-косметических средств, лекарственных препаратов. Технический результат изобретения – расширение ассортимента эффективных синтетических антиоксидантов, достижение высоких эффектов ингибирования при меньших концентрациях соединений.
Рецензенты:Ерёмин Д.И., д.б.н., профессор кафедры почвоведения и агрохимии, ФГБОУ ВПО «Государственный аграрный университет Северного Зауралья», г. Тюмень;
Грехова И.В., д.б.н., профессор кафедры общей химии, ФГБОУ ВПО «Государственный аграрный университет Северного Зауралья», г. Тюмень.
Работа поступила в редакцию 26.02.2015.



