Одной из крупнейших групп органических соединений, представляющих повышенную экологическую опасность, являются текстильные и другие промышленные красители. От 1 до 20 % всего мирового производства красителей со сточными водами попадают в окружающую среду. Это приводит к ухудшению эстетических показателей водных объектов, а также препятствует проникновению в них света и интенсивному развитию водорослей. В результате различных химических процессов, таких как окисление, гидролиз и др., возможно возникновение опасных побочных продуктов. Поэтому в последнее время все большее внимание уделяется очистке сточных вод от органических красителей.
Недостатком традиционных физических методов (адсорбция на активированных углях, ионный обмен на синтетических смолах, коагуляция, обратный осмос, ультрафильтрация и т.д.) является то, что они всего лишь переводят загрязнитель из одной (водной) фазы в другую, тем самым создавая вторичное загрязнение.
В последнее время в качестве перспективного метода очистки сточных вод от красителей рассматривается фотокатализ, поскольку приводит к полной минерализации загрязнителей. Наиболее распространенным фотокатализатором распада углеводородов является полупроводниковый TiO2 [2, 4]; при этом, степень адсорбции и фотодеградации красителя зависит от величины рН водного раствора [2].
Величина водородного показателя раствора определяет поверхностный заряд частиц катализатора и потенциал каталитических реакций, то есть при изменении рН меняется сорбция красителя и, соответственно, скорость реакции. В кислых и щелочных средах поверхность диоксида титана может быть протонированной и депротонированной за счет протекания следующих реакций [2, 4]:
TiOH + H+ → TiOH2+; (1)
TiOH + OH– → TiO– + H2O. (2)
Когда рН раствора находится в изоэлектрической точке (точке нулевого заряда), поверхность катализатора нейтральная. Ниже этой точки, в кислой среде, поверхность диоксида титана заряжена положительно, в щелочной среде – отрицательно [4, 6].
Кроме того, от концентрации протонов в растворе зависит форма красителя (ионизированная и неионизированная). При pH ниже pKa красителя органическое соединение существует в нейтральном состоянии. Выше этого pKa органическое соединение приобретает отрицательный заряд. При этом некоторые соединения в водных растворах могут существовать в положительных, нейтральных и отрицательных формах [5].
Масштабное использование диоксида титана в качестве фотокатализатора сдерживается нежелательной электронно-дырочной рекомбинацией и его активностью только в ультрафиолетовой области спектра. Одно из направлений улучшения фотокаталитической активности TiO2 заключается в допировании TiO2 ионами переходных металлов, такими как Ag+, Cu2+, Zn2+, Cr3+, Fe3+ [2]. Однако исследования влияния рН на фотокаталитический процесс в присутствии модифицированного диоксида титана носят единичный характер.
В предыдущих исследованиях было показано, что в качестве перспективных фотокатализаторов выступают слоистые титанаты щелочных металлов [1, 12], в частности полититанаты калия (ПТК), представляюшие обширный класс соединений, структура которых сформирована из блоков спаренных титанкислородных октаэдров. Частицы этих соединений имеют большое межслойное расстояние, в результате чего, их сорбционная емкость значительно выше, чем у других производных оксида титана, имеющих слоистую структуру [15].
Было также показано [11], что композитные наноматериалы, полученные на основе ПТК, модифицированного при обработке в водных растворах солей переходных металлов, увеличивают фотокаталитическую активность полититаната калия при разложении красителей под действием солнечного излучения в видимом диапазоне спектра.
В связи с вышесказанным целью настоящей работы является оценка влияния водородного показателя раствора на сорбционную и фотокаталитическую активность полититаната калия и его производных при фотодеградации органических красителей на примере метиленового синего.
Экспериментальная часть
Образцы базового полититаната калия (ПТК) получены при обработке порошка оксида титана (анатаз 99 %, ALDRICH, средний размер частиц 7 мкм) в солевом расплаве. Реакционную смесь, содержащую TiO2 (10 масс. %), и расплав, состоящий из KOH по ГОСТ 24363-80 (10 масс. %) и KNO3 по ГОСТ 4217-77 (80 масс. %), выдерживали в алундовом тигле в муфельной печи (SNOL) при температуре 500 °С в течение 2 ч. Полученный продукт отмывали от водорастворимых соединений в дистиллированной воде, взятой к содержимому тигля в соотношении 20:1, и отфильтровывали с помощью бумажного фильтра Whathman № 40. В результате получено аморфное вещество с мольным соотношением TiO2:K2O = 3,91 [15].
Модификацию полититанатов калия переходными металлами проводили следующим образом: порошок ПТК (навеска 20 г) помещали в термостатированный при 23 °С сосуд, содержащий водный раствор соли соответствующего металла (Fe3+, Mn2+, Ni2+ и Zn2+). При помощи магнитной мешалки полученные суспензии перемешивали в течение различных промежутков времени (от 3 до 18 ч). После этого твердую часть отделяли центрифугированием и просушивали при 40 °С в сушильном шкафу.
Точка нулевого заряда определялась в соответствии с методикой работы [13].
При изучении влияния водородного показателя раствора на фотокаталитическую активность модифицированных полититанатов калия в качестве модельного красителя использовали метиленовый синий (МС) (рисунок).
Адсорбция и фотодеградация метиленового синего под действием солнечного излучения изучались в суспензиях модифицированных полититанатов калия, содержащих 1 г/л ПТК и 0,02 г/л МС (0,04 г/л МС в случае использования ПТК-Fe) при рН равном 6, 7, 8 и 9. Метиленовый синий представляет собой катионный краситель, который хорошо адсорбируется на отрицательно заряженных поверхностях [3]. Из литературных данных [14] известно, что изменение величины рН в пределах от 3 до 10 не влияет на цвет раствора МС в отсутствие фотокатализатора; заметное изменение окраски раствора наблюдается лишь при рН > 10. В нашем исследовании величина рН изменялась в пределах от 6 до 9, и можно предположить, что в условиях эксперимента концентрация МС постоянна и полученные результаты – нормированы.
Для определения влияния водородного показателя раствора на сорбционные и фотокаталитические свойства модифицированных полититанатов калия навеску фотокатализатора (0,2 г) помещали в стакан из химически стойкого стекла (Pyrex, объем 250 мл), добавляли 100 мл дистиллированной воды и перемешивали суспензию с помощью магнитной мешалки. Затем добавляли 100 мл водного раствора МС. Величину рН дисперсии регулировали добавлением небольшого количества 30 % раствора H2SO4 или 10 % раствора КOH. Далее полученную дисперсию выдерживали в темноте при непрерывном перемешивании в течение 1 ч для установления адсорбционного равновесия. Время выдержки в темноте было выбрано на основании результатов предварительных исследований. По истечении 1 часа из раствора отбирали пробу объемом 5 мл Взвешенные частицы катализатора отделяли центрифугированием в течение 15 мин при скорости 6000 об./мин, и спектрофотометрическим методом при λ = 665 нм, соответствующей максимуму поглощения в спектре метиленового синего, оценивали адсорбционную емкость частиц фотокатализатора. Далее рабочую суспензию помещали в фотореактор, представлявший собой воздушный термостат, оснащенный магнитной мешалкой, где она подвергалась действию излучения, идентичного по интенсивности и спектральному составу солнечному. Поток излучения в фотореакторе создавался лампой видимого света ДРЛ 250. Температура рабочей суспензии при экспозиции на свету контролировалась, поддерживаясь на уровне 24 ± 1 °C.
Через каждый час из раствора отбирали пробы объемом 5 мл, центрифугировали их и определяли остаточное содержание красителя в растворе.
Химический и фазовый состав всех образцов исследовали с помощью сканирующего электронного микроскопа ASPEX EXplorer, оснащенного встроенным энергодисперсионным анализом, а также рентгеновского дифрактометра Thermo Scientific ARL X’TRA.
Удельная площадь поверхности образцов синтезированных материалов определялась методом БЭТ с использованием автоматического проточного хемосорбционного анализатора Quantachrome Instruments ChemBET Pulsar TPR/TPD с использованием метода низкотемпературной адсорбции азота.
Результаты исследования и их обсуждение
Согласно результатам рентгеновского фазового анализа полититанат калия как до, так и после модификации переходными металлами имеет аморфную структуру [11]; присутствие небольших примесей SiO2 и Al2O3 имеет технологический характер. Однако при обработке ПТК в водных растворах солей переходных металлов параллельно идут процессы ионного обмена (К+ ↔ Н+ и nК+ ↔ Men+) и формирования Me(OH)n, в результате чего химический состав образцов существенно изменяется (табл. 1).
Таблица 1
Удельная площадь поверхности и химический состав модифицированных полититанатов калия (в пересчете на оксид)
|
Образец |
Удельная поверхность, м2/г |
Содержание оксида в продукте, масс. % |
||||
|
K2O |
TiO2 |
RxOy |
SiO2 |
Al2O3 |
||
|
ПТК ПТК-Fe ПТК-Ni ПТК-Mn ПТК-Zn |
34,6 38,3 69,1 41,5 47,1 |
18,5 4,0 5,6 6,8 4,5 |
80,1 85,6 85,3 75,4 74,4 |
– 9,2 7,8 14,8 19,1 |
0,9 1,0 1,2 0,4 1,2 |
0,5 0,2 0,1 1,4 0,8 |
При модификации базового полититаната калия в растворах солей переходных металлов его удельная поверхность несколько увеличивается (табл. 1). Это связано с частичным протонированием (количество калия в модифицированных образцах в пересчете на оксид снижается в 3–5 раз) с последующим увеличением межслойного пространства, а также декорированием поверхности ПТК наночастицами Me(OH)n, имеющими меньший размер по сравнению с размером частиц исходного ПТК.
Измерения величины рН точки нулевого заряда показали, что у порошков базового полититаната калия она соответствует значению рН = 6,2. Таким образом, при меньших значениях рН поверхность базового ПТК заряжена положительно, а в нейтральной и щелочной среде она имеет отрицательный заряд.
В процессе модифицирования порошков полититаната калия образуются двухфазные гетероструктурные наноматериалы, состоящие из слоев ПТК, декорированных соединениями переходных металлов. Образующиеся на поверхности ПТК соединения переходных металлов представлены в виде оксидно-гидроксидных комплексов, которые в, той или иной степени обладают амфотерными свойствами. Присутствие разнородных поверхностей в полученных гетероструктурных соединениях неизбежно вызывает изменение экспериментально измеряемых значений точки нулевого заряда (табл. 2). Так, после модифицирования полититаната калия в растворе сульфата марганца (II) величина рН изоэлектрической точки смещается в сторону меньших значений (5,5), а после обработки в растворе сульфата цинка – в сторону больших значений (7,8). Данный эффект, по всей вероятности, связан с влиянием образующихся на поверхности ПТК оксидно-гидроксидных комплексов соответствующих металлов.
Литературные данные значений рН точки нулевого заряда для гидроксидов металлов, полученные разными авторами, значительно различаются (табл. 2). Так, например, значения рН изоэлектрической точки для Fe2O3 согласно различным источникам колеблются от 6,4 до 9,3 в зависимости от природы происхождения образца [8–9]. Вероятно, это связано с различием исходных образцов, удельной площади поверхности, а также метода определения.
Хорошо известно, что растворимость гидроксидов металлов зависит от величины рН. При рН ниже 4 и выше 10 растворимость амфотерных гидроксидов становится значимой, поэтому влияние рН на поверхностный заряд часто изучается в рамках этих значений водородного показателя. Следует отметить, что для таких сложных систем, как модифицированные полититанаты калия, результаты измерений точки нулевого заряда – менее точны и воспроизводимы, чем в случае титрования дисперсий исходного ПТК. При добавлении кислоты или основания одновременно с процессом нейтрализации поверхностного заряда могут протекать химические реакции растворения гидроксосоединений переходных металлов, которые не могут быть разделены экспериментально и проанализированы.
Таблица 2
Значения точки нулевого заряда (рН0) для оксидов металлов (литературные данные согласно [9–10]) и для синтезированных порошков
|
Тип соединения |
рН0 |
|
ПТК |
6,2 ± 0,1 |
|
α-Fe2O3 |
8,0 |
|
Маггемит Fe2O3 |
6,7–7,3 |
|
Магнетит Fe3O4 |
6,4–6,8 |
|
Гематит Fe2O3 |
7,4–9,3 |
|
Лепидокросит FeOOH |
7,1 |
|
ПТК-Fe |
6,4 ± 0,4 |
|
MnООН |
2,7 |
|
MnO2 |
4,6–5,3 |
|
ПТК-Mn |
5,5 ± 0,4 |
|
NiО |
7,5–10,5 |
|
Ni(ОН)2 |
10,7–11,2 |
|
ПТК-Ni |
6,3 ± 0,5 |
Анализ сорбционной способности и фотокаталитической активности исследуемых гетероструктурных порошков показывает отсутствие однозначной зависимости между этими параметрами для исследованной группы фотокатализаторов. Отмечено, что сорбционная способность ПТК-Fe и ПТК-Mn выше, а у ПТК-Ni ниже, чем у чистого ПТК, что, с одной стороны, может быть связано с несколько более высокой удельной поверхностью (табл. 1), а с другой стороны, – сложной природой поверхности этих порошков. При этом, максимальная сорбция красителя на всех модифицированных образцах наблюдается при рН = 8. Очевидно, что адсорбционные центры поверхности наночастиц оксидно-гидроксидных комплексов переходных металлов отличаются по характеру кислотно-основных свойств. Кроме того, нельзя не учесть, что в структуре синтезированных нанокомпозитов присутствуют множественные гетеропереходы, изменяющие характер распределения электронной плотности на поверхности контактирующих полупроводниковых частиц. Явление это имеет достаточно сложный характер и зависит от множества факторов, на что указывает индивидуальный характер влияния величины рН раствора на сорбционную активность исследованных порошков.
Фотокаталитическая активность в условиях насыщения поверхности красителем (равновесные условия) у гетероструктурных порошков превосходит ее величину для чистого ПТК (за исключением ПТК-Mn), что указывает на благоприятное для фотоокисления изменение механизма процесса формирования и переноса заряда у модифицированных порошков по сравнению с исходным ПТК.
В щелочной среде (рН = 9) все гетероструктурные порошки имеют несколько более слабую или сопоставимую фотокаталитическую активность по сравнению с исходным ПТК, что указывает на идентичность механизма фотоокисления в условиях высоких значений [OH–], несмотря на некоторые отличия в адсорбционной способности различных модификаций ПТК по отношению к МС.
При рассмотрении влияния величины рН раствора на фотоактивность конкретных видов ПТК, модифицированных при обработке в растворах солей переходных металлов можно выделить следующие особенности. Система ПТК-Fe (рисунок, б) в целом характеризуется наилучшей эффективностью удаления красителя (исходная концентрация красителя в 2 раза выше, чем при исследовании других образцов). При этом следует отметить, что при увеличении рН повышается сорбционная способность, но снижается фотокаталитическая активность рассматриваемого образца. При увеличении рН до 9 оба параметра незначительно снижаются.
Для системы ПТК-Mn (рисунок, в) характерна высокая сорбционная способность. Фотокаталитическая активность данной системы снижается при изменении рН раствора от 6 до 8 и несколько повышается при рН = 9.
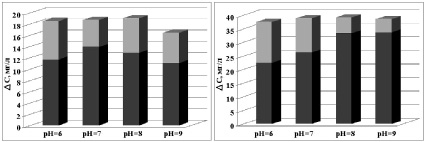
а б
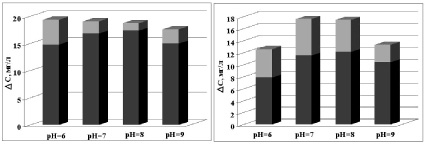
в г
Зависимость сорбционной способности (темно-серый) и фотокаталитической активности (светло-серый) фотокатализатора от рН раствора красителя (а) ПТК, (б) ПТК-Fe, (в) ПТК-Mn, (г) ПТК-Ni
Система ПТК-Ni (рисунок, г) проявляет значительно более высокую фотокаталитическую активность в нейтральных средах по сравнению с исходным ПТК, что указывает на благоприятный характер механизма процессов переноса заряда в этих гетероструктурных системах. При этом увеличение значения рН раствора в силу амфотерных свойств оксидов (гидроксидов) металлов, по-видимому, способствует частичному растворению наночастиц этих соединений, декорирующих частицы ПТК. В результате снижается величина удельной поверхности гетероструктурного порошка модифицированного ПТК, его адсорбционная и фотокаталитическая активность. Причем данный эффект наблюдается для всех модификаций ПТК.
Таким образом, можно констатировать, что для большинства видов модифицированных полититанатов калия, так же, как и в случае использования различных типов порошков TiO2 [2], наблюдается увеличение фотоактивности при росте величины рН очищаемого водного раствора. Однако эффект этот наблюдается только в ограниченной области значений рН (нейтральные водные растворы), в отличие от различных модификаций нанопорошков TiO2. Переход в область рН, типичную для щелочных растворов, приводит к снижению как сорбционной, так и фотокаталитической активности. Причиной этого может являться амфотерный характер оксидно-гидроксидных наночастиц, формирующихся на поверхности ПТК. Растворение этих частиц в щелочных растворах или их отделение от нанолистов полититаната калия снижает число гетеропереходов ПТК-MeOx и нивелирует эффект разделения фотоиндуцированных зарядов в полупроводниковом фотокатализаторе. Следует также иметь в виду и химически неоднородный характер поверхности исследуемых материалов. Образующиеся соединения представлены в виде оксидно-гидроксидных комплексов переходных металлов на поверхности ПТК, обладающих собственными кислотно-основными свойствами, существенно влияющими как на сорбционные, так и на фотокаталитические свойства гетероструктурных порошков.
Выводы
В работе, на примере метиленового синего, исследовано влияние водородного показателя водных растворов на сорбционные и фотокаталитические свойства полититанатов калия, модифицированных в растворах солей переходных металлов. Отмечено, что оптимальными фотокаталитическими свойствами обладают гетероструктурные порошки, полученные при использовании для модифицирования солей Fe, Mn и Ni. При этом усиление фотокаталитических свойств после модифицирования наиболее ярко проявляется для нейтральных водных растворов. Наблюдаемые эффекты связываются с допированием слоистых частиц ПТК ионами переходных металлов, а также формированием множественных гетеропереходов типа ПТК-МеОх, обеспечивающих разделение фотоиндуцируемых пар электрон-дырка, и расширением спектра энергетических характеристик адсорбционных центров на поверхности синтезируемых гетероструктурных фотокатализаторов. Следует отметить, что полученные результаты имеют предварительный характер, поскольку изменение рН раствора приводит к формированию различных объектов.
Работа выполнена в рамках и при финансовой поддержке ФЦП «Исследования и разработки по приоритетным направлениям развития научно-технологического комплекса России на 2014–2020 годы» (Соглашение № 14.574.21.0005) и ФЦП «Развитие электронной компонентной базы и радиоэлектроники» на 2008–2015 годы» (Госконтракт № 14.430.12.0002).
Рецензенты:Доронин С.Ю., д.х.н., профессор кафедры «Аналитическая химия и химическая экология», ФГБОУ ВПО НИУ «СГУ им. Н.Г. Чернышевского», г. Саратов;
Устинова Т.П., д.т.н., профессор, заведующая кафедрой «Химическая технология», Энгельсский технологический институт (филиал) ФГБОУ ВПО «СГТУ им. Гагарина Ю.А.», г. Энгельс.
Работа поступила в редакцию 06.03.2015.



