Наличие сопутствующих тревожно-депрессивных расстройств (ТДР) у больных острым инфарктом миокарда с подъемом сегмента ST (ОИМпST) оказывает негативное влияние на его течение и прогноз [2]. В основе патогенеза ОИМпST лежат нарушения в системе гемостаза. Ранее нами было показано более выраженное нарушение в системе гемостаза у больных ОИМпST в сочетании с ТДР в сравнении с больными с ОИМпST без ТДР [3, 5]. Тромбоцитам в системе гемостаза отводится ключевая роль. В то же время, функциональная активность тромбоцитов во многом определяется состоянием их метаболической системы. Пластические звенья метаболизма определяют синтез поверхностных рецепторов и гуморальных факторов гемостаза, энергетический обмен поставляет энергию для данных процессов. В связи с этим интенсивность различных метаболических процессов тромбоцитов характеризует их функциональные свойства и во многом определяет активность системы гемостаза. Таким образом, для характеристики механизмов реакций гемостаза в патогенезе ОИМпST в зависимости от наличия ТДР необходимо исследовать уровни активности ферментов тромбоцитов.
Цель исследования. Для характеристики механизмов реакций гемостаза в патогенезе ОИМпST в зависимости от наличия ТДР мы исследовали уровни активности ферментов тромбоцитов.
Материалы и методы исследования
Все исследования выполнены с информированного согласия испытуемых и в соответствии с Хельсинкской декларацией Всемирной ассоциации «Этические принципы проведения научных медицинских исследований с участием человека» с поправками 2000 г. и «Правилами клинической практики в Российской Федерации», утвержденными Приказом Минздрава РФ от 19.06.2003 г. № 266. Проведенное нами исследование было одобрено локальным этическим комитетом ГБОУ ВПО «КрасГМУ им. проф. В.Ф. Войно-Ясенецкого» (протокол № 12 от 20.12.2012 г.).
Обследовано 90 пациентов в первые 24 часа после развития ОИМпST (медиана возраста 60 [52–66] лет, 60 мужчин и 30 женщин). Критериями включения в исследование являлись: ОИМпST у пациентов обоего пола в возрасте от 35 до 75 лет в первые 24 часа поступления в стационар от начала заболевания, не принимавших до госпитализации антиагреганты и антикоагулянты. Диагноз ОИМпST устанавливался согласно рекомендациям ВНОК [9]. Критерии исключения: сопутствующий сахарный диабет, возраст пациентов младше 35 лет и старше 75 лет, беременность, тяжелая сопутствующая патология (почечная недостаточность, последствия инсульта), сердечная недостаточность III стадии, кардиогенный шок при поступлении в стационар, отсутствие информированного согласия. Группу контроля составили 54 относительно здоровых добровольцев (средний возраст 59,6 ± 1,4 лет, 28 мужчин и 26 женщин).
В первые 72 часа после перевода из реанимационной палаты пациенты были протестированы с помощью теста Спилбергера ‒ Ханина, госпитальной шкалы тревоги и депрессии и опросника Бека [11, 15]. У 32 (54,2 %) пациентов расстройств аффективного спектра не обнаружено. Были сформированы две группы: первая – больные ОИМпST с ТДР и вторая – больные ОИМпST без ТДР. В табл. 1 и 2 представлены клинико-анамнестические характеристики обследованных пациентов. Данные об амбулаторной и стационарной медикаментозной терапии в сравниваемых группах приведены в табл. 3. По основным показателям между группами не обнаружено значимых различий.
Таблица 1
Факторы риска пациентов с ОИМпST
|
Показатели |
Больные ОИМпST |
р |
|
|
Без ТДР, n = 36 |
С ТДР, n = 54 |
||
|
Возраст (число больных, %) |
|||
|
Мужчины ≥ 55 лет |
7 (19,4) |
11 (20,4) |
0,907 |
|
Женщины ≥ 65 лет |
5 (13,9) |
8 (14,8) |
0,905 |
|
Курение (число больных, %) |
32 (50,0) |
43 (48,9) |
0,923 |
|
Уровень липидов крови, Ме [С25‒С75] |
|||
|
Общий холестерин |
4,86 [3,77–5,24] |
4,17 [3,45–5,49] |
1,0 |
|
Холестерин липопротеидов высокой плотности |
0,98 [0,79–1,23] |
0,96 [0,84–1,13] |
1,0 |
|
Холестерин липопротеидов низкой плотности |
3,37 [2,9–3,92] |
3 [2,14–3,8] |
1,0 |
|
Триглицериды |
1,95 [1,54–2,62] |
2,15 [1,71–2,87] |
1,0 |
|
Семейный анамнез ранних ССЗ (число больных, %) |
|||
|
Мужчины < 55 лет |
10 (27,8) |
18 (33,3) |
0,582 |
|
Женщины < 65 лет |
4 (11,1) |
10 (18,5) |
0,345 |
|
Абдоминальное ожирение: окружность талии > 102 см для мужчин и > 88 см для женщин (число больных, %) |
3 (8,3) |
11 (20,4) |
0,124 |
|
Сопутствующие заболевания |
|||
|
Гипертоническая болезнь (число больных, %) |
33 (91,6) |
45 (83,3) |
0,260 |
|
Инфаркт миокарда в анамнезе (число больных, %) |
21 (58,3) |
28 (51,8) |
0,546 |
|
Инсульт в анамнезе (число больных, %) |
2 (5,6) |
2 (3,7) |
0,670 |
|
Ангиопластика и стентирование коронарных артерий в анамнезе (число больных, %) |
2 (5,6) |
6 (11,1) |
0,372 |
|
Аортокоронарное шунтирование в анамнезе (число больных, %) |
2 (5,6) |
2 (3,7) |
0,670 |
Примечание. p – значимость различий между показателями больных с ТДР и без ТДР.
Таблица 2
Характер инфаркта миокарда
|
Показатели |
Больные ОИМ |
р |
|
|
Без ТДР, n = 36 |
С ТДР, n = 54 |
||
|
Локализация (число больных, %) |
|||
|
Передний |
7 (19,4) |
15 (27,8) |
0,366 |
|
Задний (нижний) |
9 (25,0) |
10 (18,5) |
0,461 |
|
Циркулярный |
0 |
4 (7,4) |
0,099 |
|
Боковой |
2 (5,6) |
2 (3,7) |
0,670 |
|
Не определена |
18 (50,0) |
24 (44,4) |
0,603 |
|
ТропонинI, нг/мл, Ме [С25–С75] |
0,1 [0,0–1,9] |
0,1 [0,0–2,2] |
0,904 |
|
СРБ, мг/л, Ме [С25–С75] |
8,95 [2,35–25,85] |
12,9 [1,8–35,0] |
0,537 |
|
Риск по шкале GRAСE в баллах, Ме [С25–С75] |
120,6 [109,4–139,3] |
125,3 [108,9–144,6] |
0,367 |
Примечание. p – значимость различий между показателями больных с ТДР и без ТДР.
Таблица 3
Медикаментозная терапия пациентов с ОИМпST (число больных, %)
|
Показатели |
Больные ОИМпST, n = 90 |
р |
|
|
Без ТДР, n = 36 |
С ТДР, n = 54 |
||
|
Амбулаторная |
|||
|
Диуретики |
2 (5,6) |
5 (9,2) |
0,438 |
|
β-адреноблокаторы |
12 (33,4) |
11 (20,4) |
0,328 |
|
Ингибиторы ангиотензин-превращающего фермента |
18 (50,0) |
17 (31,5) |
0,139 |
|
Антагонисты кальциевых каналов |
3 (8,3) |
2 (3,7) |
0,261 |
|
Блокаторы рецепторов к ангиотензину |
5 (13,9) |
2 (3,7) |
0,096 |
|
Статины |
4 (11,1) |
5 (9,2) |
0,123 |
|
Нитраты |
12 (33,4) |
15 (27,8) |
0,768 |
|
Варфарин |
1 (2,8) |
0 |
1,0 |
|
Стационарная |
|||
|
Диуретики |
21 (58,3) |
31 (57,4) |
1,0 |
|
β-адреноблокаторы |
36 (100) |
51 (94,4) |
1,0 |
|
Ингибиторы ангиотензин-превращающего фермента |
33 (91,7) |
50 (92,5) |
1,0 |
|
Антагонисты кальциевых каналов |
10 (27,8) |
10 (18,5) |
0,099 |
|
Блокаторы рецепторов к ангиотензину |
2 (5,6) |
0 |
0,402 |
|
Статины |
25 (69,4) |
43 (79,6) |
0,092 |
|
Нитраты |
30 (83,3) |
46 (85,1) |
1,0 |
|
Гепарин |
6 (16,7) |
9 (16,7) |
1,0 |
|
Эноксапарин |
23 (63,9) |
41 (75,8) |
0,097 |
|
Фондапаринукс |
3 (8,3) |
10 (18,5) |
0,101 |
|
Аспирин |
32 (89,0) |
48 (88,8) |
1,0 |
|
Клопидогрель |
20 (55,6) |
32 (59,2) |
1,0 |
Примечание. p – значимость различий между показателями больных с ТДР и без ТДР.
Уровни активности НАД(Ф)-зависимых дегидрогеназ в тромбоцитах крови больных ОИМпST определяли с помощью биолюминесцентного метода. Биолюминесцентный анализ проводили с использованием биферментного препарата, выделенного из Photobacterium leognathi (получен в Институте биофизики СО РАН, Красноярск) и биохемилюминесцентного анализатора БХЛ-3606М (СКТБ «Наука», Красноярск). Данным методом определялась активность следующих ферментов: глюкозо-6-фосфатдегидрогеназы (Г6ФДГ), глицерол-3-фосфатдегидрогеназы (Г3ФДГ), НАДФ-зависимой малатдегидрогеназы (НАДФ-МДГ), НАД- и НАДН-зависимой лактатдегидрогеназы (ЛДГ и НАДН-ЛДГ), НАД- и НАДН-зависимой малатдегидрогеназы (МДГ и НАДН-МДГ), НАДФ- и НАДФН-зависимой глутаматдегидрогеназы (НАДФГДГ и НАДФН-ГДГ), НАД- и НАДН-зависимой глутаматдегидрогеназы (НАДГДГ и НАДН-ГДГ), НАД- и НАДФ-зависимых изоцитратдегидрогеназ (НАДИЦДГ и НАДФИЦДГ) и глутатионредуктазы (ГР).
Исследование активности ферментов тромбоцитов проводилось в обеих группах больных в первые 24 часа после госпитализации пациентов в палату интенсивной терапии и в динамике на 10-е сутки перед выпиской из стационара.
В группе контроля проведено тестирование для выявления тревожно-депрессивных расстройств и однократное исследование активности ферментов тромбоцитов.
Описание выборки производили с помощью подсчета медианы (Ме) и интерквартильного размаха в виде 25 и 75 процентилей (С25 и С75). Достоверность различий между показателями независимых выборок (сравнение с показателями контрольной группы) оценивали по непараметрическому U-критерию Манна – Уитни. Достоверность различий между показателями зависимых выборок (сравнение в каждой группе больных между 1-ми и 10-ми сутками обследования) оценивали по непараметрическому T-критерию Вилкоксона. Статистический анализ осуществляли в пакете программ Statistica 7.0 (StatSoftInc. 2004).
Результаты исследования и их обсуждение
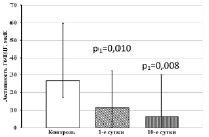
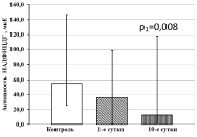
При исследовании уровней активности НАДФ-зависимых дегидрогеназ в тромбоцитах обнаружено, что у больных ОИМпST без ТДР в 1-е сутки обследования в 2,4 раза снижается относительно контрольных значений активность Г6ФДГ (рис. 1, а). На 10-е сутки лечения снижение активности фермента относительно контрольных показателей усиливается. Активность НАДФИЦДГ у больных ОИМпST без ТДР в 1-е сутки обследования соответствует контрольному уровню, однако на 10-е сутки лечения значительно снижается (рис. 1, б). Активность НАДФН-ГДГ в тромбоцитах у больных ОИМпST без ТДР снижена относительно контрольных значений уже в 1-е сутки обследования и остается на пониженном уровне на 10-е сутки лечения (рис. 1, в).
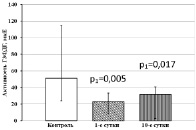
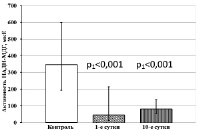
Значительные изменения установлены и в уровнях активности НАД-зависимых дегидрогеназ тромбоцитов у больных ОИМпST без ТДР. Так, в 1-е сутки обследования и на 10-е сутки лечения в тромбоцитах пациентов снижены уровни активности Г3ФДГ и НАДН-МДГ относительно контрольных значений (рис. 2, а, б). Активность МДГ в тромбоцитах больных данной группы в 1-е сутки обследования соответствует контрольным значениям, однако на 10-е сутки лечения значительно снижается относительно контрольного уровня (рис. 2, в). В то же время активность НАДН-ЛДГ в 1-е сутки обследования при ОИМ также соответствует контрольному уровню, но на 10-е сутки лечения снижается относительно исходных значений (рис. 2, г).
а б
в
Рис. 1. Активность НАДФ-зависимых дегидрогеназ тромбоцитов у больных ОИМпST без ТДР. Примечание. р1 – статистически значимые различия с показателями контрольной группы
а б
в г
Рис. 2. Активность НАД-зависимых дегидрогеназ тромбоцитов у больных ОИМпST без ТДР. Примечания: р1 – статистически значимые различия с показателями контрольной группы; р2 – статистически значимые различия с показателями больных ОИМ на 1-е сутки обследования
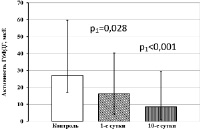
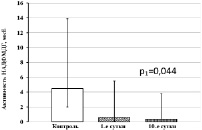
а б
в
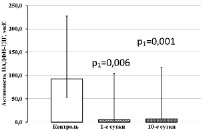
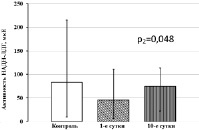
Рис. 3. Активность НАДФ-зависимых дегидрогеназ тромбоцитов у больных ОИМ с ТДР. Примечания: р1 – статистически значимые различия с показателями контрольной группы; р2 – статистически значимые различия с показателями больных ОИМ на 1-е сутки обследования
В тромбоцитах больных ОИМпST с ТДР в 1-е сутки обследования в 13,9 раза снижается активность НАДФН-ГДГ (рис. 3, а). На 10-е сутки лечения активность данного фермента повышается в 8,9 раза относительно исходных значений, но остается пониженной относительно контрольного диапазона. У больных ОИМпST с ТДР так же, как и при отсутствии ТДР, в тромбоцитах в 1-е сутки обследования относительно контрольного уровня понижена активность Г6ФДГ, на 10-е сутки лечения снижение активности фермента относительно контрольных значений усиливается (рис. 3, б). Активность НАДФМДГ в тромбоцитах при ОИМпST с ТДР на 1-е сутки обследования соответствует контрольным значениям, однако на 10-е сутки лечения снижается относительно контрольного уровня (рис. 3, в).
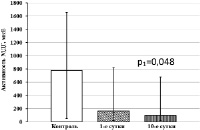
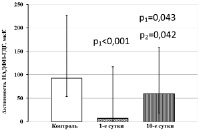
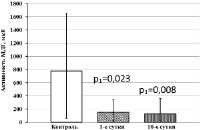
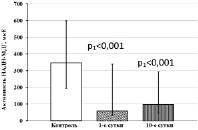
При исследовании уровней активности НАД-зависимых дегидрогеназ в тромбоцитах крови обнаружено, что активность ЛДГ у больных ОИМпST с ТДР снижена в 5,4 раза относительно контрольных значений, на 10-е сутки лечения активность фермента понижена уже в 40,3 раза относительно контрольного диапазона (рис. 4, а). Уровни активности Г3ФДГ, МДГ и НАДН-МДГ в тромбоцитах у пациентов данной группы понижены относительно контрольных значений как на 1-е сутки лечения, так и на 10-е сутки лечения (рис. 4, б–в).
При сравнительном исследовании уровней активности НАД- и НАДФ-зависимых дегидрогеназ в тромбоцитах у больных ОИМпST в зависимости от наличия ТДР обнаружено, что у больных с ТДР на 10-е сутки лечения по сравнению с показателями больных без ТДР повышена активность НАДФН-ГДГ (р = 0,042).
Исследуемые оксидоредуктазы занимают ключевые позиции основных метаболических путей. Следовательно, их анализ позволяет не только оценить уровни активности отдельных ферментов, но и определить интенсивность метаболических путей или циклов, а также реактивность метаболических процессов в целом. Так, Г6ФДГ является ключевым и инициализирующим ферментом пентозофосфатного цикла, от активности которого зависит ряд пластических процессов [4, 7]. При этом Г6ФДГ является основным конкурентом гликолиза за субстрат. Активность фермента снижается у больных ОИМпST независимо от наличия ТДР уже с 1-х суток обследования и на пониженном уровне сохраняется весь период обследования. Следовательно, в тромбоцитах больных ОИМпST снижается интенсивность пентозофосфатного цикла, но при этом осуществляется снижение оттока субстратов на внутриклеточные пластические процессы.
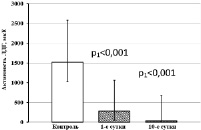
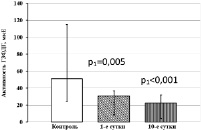
а б
в г
Рис. 4. Активность НАД-зависимых дегидрогеназ тромбоцитов у больных ОИМ с ТДР. Примечание. р1 – статистически значимые различия с показателями контрольной группы
Вторым исследуемым ферментом, влияющим на интенсивность субстратного потока по гликолизу, является Г3ФДГ. Данный фермент осуществляет перенос продуктов липидного катаболизма на окислительно-восстановительные реакции гликолиза [1, 8]. Так же, как и активность Г6ФДГу больных ОИМпST, активность Г3ФДГ в тромбоцитах снижается уже в 1-е сутки обследования и остается пониженной к 10-м суткам лечения и не зависит от наличия ТДР.
Снижение оттока субстратов (за счет низкой активности Г6ФДГ) с гликолиза и понижение притока продуктов липидного катаболизма (низкая активность Г3ФДГ) на гликолиз позволяет предположить отсутствие изменений интенсивности субстратного потока на уровне анаэробного гликолиза. Действительно, обнаружено, что активность анаэробной реакции ЛДГ (НАДН-ЛДГ), характеризующей состояние терминальных реакций анаэробного гликолиза [12], в тромбоцитах больных ОИМпST изменяется незначительно. Только у пациентов при отсутствии ТДР в тромбоцитах на 10-е сутки лечения повышается активность данного фермента относительно исходного уровня. Однако активность НАДН-зависимой реакции МДГ (НАДН-МДГ) в тромбоцитах больных ОИМпST снижается независимо от наличия ТДР. Данная ферментативная реакция является ключевой в системе малат-аспартатного шунта митохондрий и осуществляется за счет НАДН, нарабатываемого в цитоплазматическом компартменте клеток преимущественно в реакциях анаэробного гликолиза [1, 13]. В связи с этим можно заключить, что в тромбоцитах больных ОИМпST независимо от наличия/отсутствия ТДР снижается интенсивность пластических процессов при ингибировании реакций липидного катаболизма и анаэробного гликолиза.
Особенностью метаболизма тромбоцитов у больных ОИМпST без ТДР являются изменения в активности ферментов митохондриального компартмента в процессе лечения. Необходимо отметить, что тромбоциты являются клетками, в которых сохранились и функционируют митохондрии [10]. В связи с этим биоэнергетика данного типа клеток определяется не только анаэробным окислением глюкозы, но и аэробными процессами. Только у больных ОИМпST без ТДР обнаружено снижение на 10-й день лечения уровней активности НАДФИЦДГ и МДГ. НАДФИЦДГ и МДГ являются ферментами цикла трикарбоновых кислот, от активности которого во многом зависит интенсивность аэробного дыхания [1, 4, 6]. НАДФИЦДГ (так же как, и НАДФГДГ) являются вспомогательными дегидрогеназными реакциями митохондриального компартмента, метаболическая значимость которых возрастает в случае ингибирования НАД-зависимых дегидрогеназных реакций (например, при повышении содержания НАДН в митохондриях) [1, 2]. Следовательно, у больных ОИМпST без ТДР в тромбоцитах на 10-й день лечения особенности метаболизма митохондрий определяют ингибирование реакций, обеспечивающих аэробную энергетику. Необходимо подчеркнуть, что данное состояние метаболизма митохондриального компартмента реализуется на фоне сниженной активности НАДФН-ГДГ (весь наблюдаемый период), которая переносит на энергетические реакции продукты аминокислотного обмена [1, 14].
Особенности метаболизма тромбоцитов у больных ОИМпST с ТДР выявляются как со стороны цитоплазматического компартмента, так и митохондриального. Во-первых, у больных данной группы в течение всего наблюдаемого периода в тромбоцитах снижена активность аэробной реакции ЛДГ. Аэробная реакция ЛДГ осуществляет дополнительное субстратное стимулирование митохондриальных процессов за счет окисления лактата. Во-вторых, только у больных ОИМпST с ТДР на 10-й день лечения в тромбоцитах снижается активность НАДФМДГ. Данный фермент осуществляет шунтирование медленных реакций лимонного цикла и входит в систему катаболизма ксенобиотиков [1, 4]. Соответственно, ингибирование активности НАДФМДГ характеризует снижение интенсивности компенсаторных процессов в системе внутриклеточного метаболизма, направленных на стимуляцию аэробных энергетических процессов и подавление активности реакций катаболизма ксенобиотиков, что реализуется на фоне лекарственной терапии. Причем, подобные метаболические изменения реализуются на фоне снижения субстратного потока по циклу Кребса (весь наблюдаемый период) и низкой активности НАДФН-ГДГ, которая осуществляет субстратное стимулирование энергетических процессов продуктами аминокислотного стимулирования. Необходимо отметить, что только у больных ОИМпST с ТДР на 10-й день лечения в тромбоцитах повышается активность НАДФН-ГДГ. Подобные изменения активности ферментов митохондриального компартмента в тромбоцитах пациентов данной группы позволяют отметить, что даже на фоне субстратного стимулирования лимонного цикла наблюдается недостаточность субстратного потока по нем, характеризующая ингибирование аэробного дыхания.
Заключение
Таким образом, у больных ОИМпST независимо от наличия/отсутствия ТДР в течение всего периода наблюдения в тромбоцитах крови снижена интенсивность пластических процессов, реакций липидного катаболизма и ключевой реакции малат-аспартатного шунта митохондрий. Подобное состояние внутриклеточного метаболизма характеризует нарушения в системах энергетического обмена и макромолекулярного синтеза, что, безусловно, повлияет на функциональную активность тромбоцитов. Особенностью состояния обменных процессов в тромбоцитах больных ОИМпST без ТДР является снижение уровня активности аэробного дыхания на фоне нарушения взаимосвязи цикла Кребса с реакциями аминокислотного обмена, но при сохранении нормального уровня интенсивности анаэробного дыхания. У больных ОИМпST с ТДР на всех этапах обследования снижена активность анаэробного и аэробного дыхания на фоне сниженного переноса продуктов аминокислотного обмена на реакции цикла Кребса. Такое, более выраженное снижение активности ферментов метаболизма тромбоцитов больных ОИМпST с ТДР может являться одним из патофизиологических механизмов, объясняющих более тяжелое течение и прогноз инфаркта миокарда у пациентов в сочетании с расстройствами аффективного спектра.
Рецензенты:Гарганеева Н.П., д.м.н., профессор кафедры поликлинической терапии, ГБОУ ВПО «Сибирский государственный медицинский университет» Минздрава России, г. Томск;
Ильичева О.Е., д.м.н., доцент, заведующая кафедрой безопасности жизнедеятельности, медицины катастроф, скорой и неотложной медицинской помощи, ГБОУ ВПО ЮУГМУ Минздрава России, г. Челябинск.
Работа поступила в редакцию 06.03.2015.



