Основным белком, участвующим в метаболизме липидов и обеспечивающим обратный транспорт ХС, является белок ‒ переносчик ЭХ – СЕТР. Функциональная активность CETP заключается в переносе ЭХ от ХС ЛВП к атерогенным ЛП (ХС ЛПП, ХС ЛОНП, ХС ЛНП), что ведет к снижению уровня ХС ЛВП [9]. В то же время происходит обратный перенос ТГ в направлении от ХС ЛНП, ХС ЛОНП к ХС ЛВП [2].
CETP как участник липидного обмена, обладает двойственной функцией и может проявлять как анти-, так и проатерогенные свойства [11]. Во-первых, проатерогенные свойства CETP выражаются в снижении переноса ЭХ от ХС ЛВП к печеночному рецептору B1 (SR-B1) по прямому пути обратного транспорта холестерина и в увеличении тока ЭХ через атерогенные ХС ЛОНП, ХС ЛПП и ХС ЛНП. Таким образом, эти частицы переносят большее количество ЭХ, что потенциально приводит к увеличению содержания ХС в периферических тканях и артериальной стенке. Во-вторых, при постпрандиальной гипертриглицеридемии активируется перенос ТГ от ХС ЛОНП к ХС ЛВП, что ведет к образованию обогащенных ТГ ХС ЛВП с последующей редукцией их размера и интенсивной экскрецией почками [5]. Тем не менее CETP может проявлять антиатерогенные свойства, т.к. содействует передаче ЭХ к печени через непрямой путь RST, осуществляемый преимущественно через активацию печеночного ХС ЛНП-рецептора. Направленность и степень влияния СЕТР на ЛО зависят не только от корригируемых факторов, таких как, например, концентрация свободных жирных кислот, образованных в результате гидролиза пищевых ТГ, но и генетически детерминированных. Ген, кодирующий белок-переносчик ЭХ (CETP), клонированный Drayna D. и Lawn R.M. (1987), локализуется на 16 хромосоме (16q21), включает 16 экзонов и 15 интронов [11]. Крупномасштабные геномные исследования обнаружили более значимую корреляцию между полиморфизмами гена CETP и концентрацией ХС ЛВП, чем среди других локусов [10]. Одним из частых аллельных вариантов гена СЕТР является замена гуанина (G) на аденин (А) в положении 279 интрона 1 – TaqIB (rs708272) полиморфизм [8]. Часто встречающийся аллель G (наличие сайта рестрикции – «В1») связан с более высокой активностью CETP в сравнении с редким А аллелем (отсутствие сайта рестрикции – «В2»). Носительство редкого мутантного А аллеля ведет к снижению активности CETP, что проявляется в повышении уровня ХС ЛВП и потенциально рассматривается как антиатерогенное влияние [5]. Несмотря на ряд положительных результатов, в исследованиях с использованием в качестве конечных точек оценки не только динамики показателей липидного обмена, но и диаметр просвета коронарных артерий [8], влияние генотипа TaqIB на эффективность терапии статинами остается спорным [9].
Цель исследования – изучение влияния полиморфизма гена белка-переносчика ЭХ на эффективность гиполипидемической терапии розувастатином у пациентов с атерогенными ГЛП, страдающих ИБС.
Материалы и методы исследования
Под наблюдением находились 62 мужчины с ГЛП, а также ИБС, относящихся к группе очень высокого риска развития сердечно-сосудистых осложнений по шкале SCORE [1]. Выбор мужчин обусловлен большей заболеваемостью ИБС. Исследование проведено рандомизированным, простым, проспективным методом. Группы пациентов формировались по следующим стратификационным критериям: возраст от 40 до 61 года, I или II функциональный класс стабильной стенокардии, наличие изолированной (IIA) или сочетанной (IIB) гиперлипидемии. Пациенты имели индекс массы тела 26,8 (25,6–27,8). Фармакологическая коррекция проводилась розувастатином в дозе 10 мг/сутки в течение года с контролем параметров липидного обмена (ЛО) в момент включения, через 4, 8, 24 и 48 недель (0, 1, 2, 3, 4 точки исследования соответственно). В качестве критерия эффективности гиполипидемической терапии принималось условие достижения целевых значений ХС ЛНП [3].
Кровь для исследования брали из локтевой вены утром натощак, не ранее чем через 12–14 часов после приема пищи. Содержание ОХС, ТГ в сыворотке крови определяли энзиматическим калориметрическим методом с использованием диагностических наборов фирмы «Олвекс-диагностикум» (Россия, г. Санкт-Петербург), биохимическим анализатором ROKI («Олвекс-диагностикум», Россия, г. Санкт-Петербург). Уровень холестерина липопротеидов высокой плотности (ХС ЛВП) оценивали тем же методом после предварительного осаждения хиломикронов, ХС ЛОНП и ХС ЛНП при добавлении к образцу фосфорновольфрамовой кислоты и Mg. Содержание ХС ЛНП определяли расчетным путем по формулам Фридвальда, уровень ХС, не связанного с ХС ЛВП, и атерогенный индекс (АИ) вычисляли по общепринятым стандартным формулам [3]. Выделение геномной ДНК осуществлялось из венозной крови стандартным двухэтапным методом фенольно-хлороформной экстракции. Генотипирование полиморфизмов CETPTaq1B (+ 279G > A) (rs708272) проведено ПЦР в режиме реального времени с использованием TaqMan зондов для дискриминации аллелей на амплификаторе CFX96 Bio-Rad Laboratories (США) с использованием коммерческих наборов реактивов TaqMan SNP Genotyping Assays фирмы Applied Biosystems (США).
Проверка вида распределения осуществлялась с помощью критерия Колмогорова ‒ Смирнова. Сравнение групп проводилось с использованием методов непараметрической статистики с поправкой Бонферрони на множественные сравнения. Динамика изменений уровня липидов и липопротеидов в ходе фармакологической коррекции оценивалась ранговым дисперсионным анализом по Фридмену. Для сравнения показателей ЛО в ходе лечения с базальным уровнем использовался критерий Вилкоксона. Процент снижения уровня параметров ЛО в каждой точке рассчитывался:
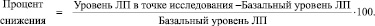
Влияние генотипов на уровень липидов в каждой точке исследования оценивалось критерием Манна – Уитни. При оценке влияния полиморфизма на показатели ЛО тестировались три генетические модели: аддитивная, доминантная, рецессивная. Критический уровень значимости для исследования принимался равным 0,05. Статистическая обработка полученных данных проведена с использованием Statistica v.10 (StatSoft Inc., США).
Результаты исследования и их обсуждение
В таблице представлены данные по базальному уровню и динамике изменений показателей липидного обмена (ЛО) у пациентов с ИБС в ходе гиполипидемической монотерапии розувастатином. Учитывая ненормальность распределений изучаемых показателей, оцененную критерием Колмогорова ‒ Смирнова (P < 0,05), значение каждого из параметров ЛО было выражено в виде медианы и интерквартильного размаха (25–75 квартили). Как видно из таблицы, к 24 неделе терапии у всех пациентов наблюдалось статистически значимое снижение уровня ОХС, ХС ЛНП, ТГ, ХС не ЛВП, АИ на фоне повышения уровня ХС ЛВП, тем самым свидетельствуя об эффективности используемого статинового препарата в лечении атерогенных гиперлипидемий у пациентов.
Затем нами проведена оценка влияния частого полиморфизма гена белка-переносчика ЭХ (CETP) – одного из ключевых ферментов в регуляции метаболизма липидов и липопротеидов, на эффективность лечения больных розувастатином. В таблице представлены данные по оценке связи генотипов CETP с эффективностью гиполипидемической терапии розувастатином у больных ИБС с атерогенными ГЛП. Среди протестированных генетических моделей фенотипических эффектов CETPTaq1B полиморфизма на уровень показателей ЛО рецессивная модель показала наиболее значимые гено-фенотипические взаимосвязи, представленные в таблице.
Связь генотипов CETP с эффективностью гиполипидемической терапии розувастатином у больных ишемической болезнью сердца
|
Генотипы CETP |
N |
Показатели липидного обмена, медиана (интерквартильный размах), ммоль/л |
||||
|
0 неделя |
4 неделя |
8 неделя |
24 неделя |
48 неделя |
||
|
Общий холестерин (рb < 0,001; рc = 0,012) |
||||||
|
+279GG/ GA |
57 |
6,1 (5,9–6,4) |
5,1 (4,5–5,6) |
4,0 (3,8–4,0) |
3,8 (3,6–3,9) |
3,7 (3,5–3,8) |
|
+279AA |
5 |
6,0 (5,9–6,6) |
5,2 (5,0–5,4) |
4,0 (4,0–4,1) |
3,8 (3,3–4,0) |
3,7 (3,3–4,0) |
|
ра |
0,706 |
0,912 |
0,841 |
1,000 |
0,960 |
|
|
Холестерин липопротеидов низкой плотности (рb < 0,001; рc = 0,003) |
||||||
|
+279GG/ GA |
57 |
4,2 (3,9–4,6) |
3,1 (2,5–3,5) |
1,8 (1,8–1,9) |
1,7 (1,6–1,8) |
1,7 (1,5–1,8) |
|
+279AA |
5 |
4,1 (2,8–,5,1) |
2,4 (2,3–3,3) |
1,5 (0,9–1,9) |
1,2 (1,2–1,4) |
1,2 (1,2–1,3) |
|
ра |
0,763 |
0,152 |
0,185 |
0,802 |
0,658 |
|
|
Триглицериды (рb < 0,001; рc = 0,013) |
||||||
|
+279GG/ GA |
57 |
1,7 (1,6–1,8) |
1,6 (1,6–1,8) |
1,6 (1,5–1,7) |
1,6 (1,4–1,7) |
1,6 (1,4–1,7) |
|
+279AA |
5 |
1,6 (1,6–1,7) |
1,6 (1,6–1,7) |
1,6 (1,4–1,6) |
1,6 (1,3–1,6) |
1,5 (1,3–1,6) |
|
ра |
0,688 |
0,404 |
0,513 |
0,598 |
0,363 |
|
|
Холестерин липопротеидов высокой плотности (рb < 0,001; рc = 0,004) |
||||||
|
+279GG/ GA |
57 |
1,0 (0,9–1,1) |
1,0 (1,0–1,2) |
1,1 (1,1–1,2) |
1,2 (1,1–1,4) |
1,2 (1,1–1,3) |
|
+279AA |
5 |
1,1 (1,0–2,1) |
1,2 (1,3–2,1) |
1,2 (1,3–2,1) |
1,3 (1,4–2,1) |
1,3 (1,4–2,0) |
|
ра |
0,130 |
0,027* |
0,014* |
0,022* |
0,018* |
|
|
Холестерин, не связанный с липопротеидами высокой плотности (рb < 0,001; рc = 0,002) |
||||||
|
+279GG/ GA |
57 |
5,1 (4,8–5,4) |
3,9 (3,2–4,3) |
2,7 (2,6–2,9) |
2,5 (2,4–2,6) |
2,4 (2,1–2,5) |
|
+279AA |
5 |
4,9 (3,6–5,7) |
3,2 (2,8–4,1) |
2,1 (1,7–2,6) |
1,9 (1,8–2,0) |
1,9 (1,9–2,0) |
|
ра |
0,563 |
0,137 |
0,051* |
0,482 |
0,594 |
|
|
Атерогенный индекс (рb < 0,001; рc = 0,002) |
||||||
|
+279GG/ GA |
57 |
5,1 (4,3–5,7) |
3,4 (2,7–4,0) |
2,2 (2,0–2,6) |
2,0 (1,8–2,3) |
1,9 (1,6–2,1) |
|
+279AA |
5 |
4,8 (3,6–5,1) |
2,3 (1,4–3,2) |
1,6 (0,8–1,9) |
1,2 (0,9–1,4) |
1,3 (1,0–1,4) |
|
ра |
0,362 |
0,065 |
0,013* |
0,658 |
0,970 |
|
Примечания: а – P-уровень критерия Манна – Уитни при сравнении показателей липидного обмена между генотипами CETP на каждом этапе лечения; b – P-уровень критерия Фридмана для оценки значимости изменений показателей липидного обмена в ходе гиполипидемической терапии для генотипов +279GG/ GA; рc – то же для генотипа +279AA; * – статистически значимые различия в показателях липидного обмена между генотипами CETP на каждом этапе лечения.
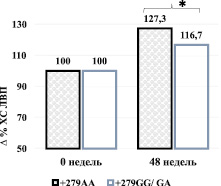
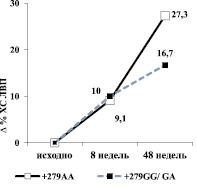
Влияние CETP генотипов на процент снижения показателя ХС ЛВП по сравнению с исходным значением к 48 неделе лечения розувастатином в дозе 10 мг в сутки. * – Р < 0,05 для критерия Манна – Уитни
Как можно увидеть из таблицы, гомозиготы +279AA имели изначально менее выраженные нарушения показателей липидного обмена, а именно общего ОХС, ХС ЛНП, ХС, не связанного с ЛВП и АИ, а также больший базальный уровень ХС ЛВП, участвующего в обратном транспорте ХС, и обладающего атеропротективными свойствами.
Динамика изменений показателя ХС ЛВП терапии розувастатином также отличалась у пациентов с генотипом +279AA в сравнении с другими генотипами CETP. Так, на фоне гиполипидемической терапии розувастатином у гомозигот +279AA преобладание уровня ХС ЛНП обнаружено уже на 8 неделе и сохранилось (рисунок) в течение всего периода исследования (+27,3 %, рc = 0,004), сравнительно с носителями других генотипов (+16,7 %, рb < 0,001 к 48 неделе).
Розувастатин показал значительный гиполипидемический эффект в отношении всех исследованных показателей липидного обмена уже на 24 неделе лечения. Динамика изменений показателей липидного обмена на фоне лечения отличалась у пациентов с генотипом +279AA в сравнении с другими генотипами CETP. В сравнении с генотипами +279GG и GA носители генотипа +279AA имели более выраженное увеличение уровня ХС ЛВП (p < 0,01) на фоне фармакологической коррекции розувастатином. С одной стороны, нами установлено влияние функционально значимого полиморфизма гена белка-переносчика ЭХ на изменение показателей липидного обмена, что может косвенно указывать на вовлеченность данного гена в патогенез гиперлипидемий у обследованных нами больных ИБС.
Рецензенты:Медведев И.И., д.м.н., д.б.н., профессор, заведующий кафедрой адаптивной физической культуры и медико-биологических наук, Российский институт социального образования (филиал) ГБОУ ВПО РГСУ, г. Курск;
Яцун С.М., д.м.н., профессор, зав. кафедрой медико-биологических дисциплин, ФГБОУ ВПО «Курский государственный университет» Минобрнауки РФ, г. Курск.
Работа поступила в редакцию 06.03.2015.



