Целью ставилось изучение состояния регенерационного процесса лейкопоэза по картине периферической крови в условиях анемизирующего влияния на организм антиокислителя ионола (2,6-ди-треть-бутил-п-крезол, бутилированный окситолуол, алкофен-БП, бубинол) в относительно небольшой концентрации – 150 мг/кг. Широко применяемый в практике антиокислитель ионол считается малотоксичным ингибитором окислительных процессов, в промышленности применяется в качестве консерванта. В предыдущих наших работах было установлено, что ионол в концентрации, равной 30 мг/кг, оказывал корригирующее действие при постгеморрагической анемии, а в дозировке 60, 100 мг/кг у контрольных животных не вызывал достоверных изменений гематологических показателей. При введении ионола 150 мг/кг возникал анемический синдром со стресс–реакцией в виде лейкемоидной реакции [1, 2, 6].
Материал и методы исследования
Материалом служили взрослые кролики породы шиншилла. Животные получали раствор ионола внутримышечно в течение 10 суток ежедневно в концентрации 150 мг/кг. Количественные параметры форменных элементов были определены с помощью гематологического анализатора. Статистическая обработка цифровых данных проводилась по программе статистика М.О. Exсel (определение достоверности различий по t-критерию Стьюдента).
Результаты исследования и их обсуждение
Дозы ионола, соответствующие 60, 100 мг/кг, достоверных сдвигов в показателях периферической крови не вызывали [1, 2, 6]. При введении ионола в концентрации 150 мг/кг были отмечены заметные изменения со стороны форменных элементов циркулирующей крови (эритроцитопения, ретикулоцитоз, пойкилоцитоз, микроцитоз, анизоцитоз, снижение содержания гемоглобина в крови) (табл. 1).
Таблица 1
Сводные показатели красной крови кроликов при введении ионола 150 мг/кг (М ± m; n = 10; * – Р < 0,05 в сравнении с исходным уровнем)
|
Показатели крови |
Исходный уровень |
Через |
|||||
|
1 сут |
3 сут |
5 сут |
7 сут |
9 сут |
10 сут |
||
|
Эритроциты (∙1012 /л) |
4,7 ± 0,08 |
4,4 ± 0,07* |
4,2 ± 0,06* |
4,1 ± 0,06* |
3,9 ± 0,05* |
3,7 ± 0,07* |
3,7 ± 0,6* |
|
Гемоглобин (г %) |
10,8 ± 0,21 |
10,1 ± 0,22 |
9,6 ± 0,19* |
9,7 ± 0,18* |
8,9 ± 0,22* |
8,7 ± 0,19* |
8,8 ± 0,18* |
|
Ретикулоциты (%) |
30,5 ± 0,61 |
28,4 ± 0,57* |
29,5 ± 0,58 |
33,8 ± 0,63* |
35,1 ± 0,65* |
36,2 ± 0,62* |
36,3 ± 0,66* |
|
Гематокрит (усл.ед.) |
29,1 ± 0,58 |
28,2 ± 0,55 |
27,8 ± 0,59* |
26,1 ± 0,54* |
25,9 ± 0,55* |
25,7 ± 0,58* |
25,4 ± 0,53* |
|
Ср. диам. эритр. (мкм) |
6,6 ± 0,12 |
6,2 ± 0,13* |
7,1 ± 0,15* |
6,5 ± ,11 |
6,2 ± 0,13* |
6,1 ± 0,14* |
6,1 ± 0,11* |
|
Нормоциты (%) |
69,2 ± 1,2 |
66,3 ± 1,1* |
58,6 ± 0,9* |
62,4 ± 1,3* |
55,4 ± 1,1* |
47,3 ± 1,3* |
46,1 ± 0,8* |
|
Макроциты (%) |
13,3 ± 0,26 |
18,0 ± 0,29* |
23,3 ± 0,31* |
19,0 ± 0,28* |
19,5 ± 0,27* |
28,0 ± 0,29* |
24,3 ± 0,32* |
|
Микроциты (%) |
17,5 ± 0,35 |
15,2 ± 0,31* |
18,1 ± 0,37 |
17,7 ± 0,34* |
25,1 ± 0,29* |
26,3 ± 0,32* |
29,6 ± 0,39* |
Таблица 2
Сводная лейкоцитограмма при действии ионола 150 мг/кг (М ± m; n = 10; * – Р < 0,05 в сравнении с исходным уровнем)
|
Показатели лейкоцитов |
Исходный уровень |
Через |
||
|
3 сут |
7 сут |
10 сут |
||
|
Общее количество лейкоцитов (∙109/л) |
6,4 ± 0,11 |
7,1 ± 0,15* |
7,9 ± 0,14* |
8,8 ± 0,16 |
|
Базофилы (%) |
2,5 ± 0,048 |
2,2 ± 0,042* |
2,1 ± 0,041* |
1,1 ± 0,038* |
|
Эозинофилы (%) |
0,4 ± 0,007 |
0,2 ± 0,005* |
0,2 ± 0,004* |
0,5 ± 0,008* |
|
Псевдоэозинофилы юные (%) |
– |
– |
0.2 ± 0,003 |
0,7 ± 0,009 |
|
Псевд. палочкоядерные (%) |
0,9 ± 0,018 |
2,3 ± 0,032* |
2,3 ± 0,036* |
2,8 ± 0,039* |
|
Псевд. сегментоядерные (%) |
31,2 ± 0,63 |
31,9 ± 0,67 |
31,3 ± 0,61 |
30,8 ± 0,59 |
|
Лимфобласты (%) |
0,3 ± 0,006 |
0,7 ± 0,014* |
1,3 ± 0,028* |
1,6 ± 0,031* |
|
Пролимфоциты (%) |
9,1 ± 0,17 |
9,7 ± 0,19* |
10,1 ± 0,21* |
11,9 ± 0,25* |
|
Лимфоциты (%) |
49,7 ± 0,91 |
46,2 ± 0,98* |
43,8 ± 0,83* |
42,3 ± 0,87* |
|
Моноциты (%) |
5,1 ± 0,11 |
5,1 ± 0,12 |
6, ± ,14* |
7,2 ± 0,16* |
|
Деструкт.лейкоциты (%) |
0,8 ± 0,016 |
1,6 ± 0,021* |
1,8 ± 0,029* |
2,2 ± 0,031* |
|
СГК гликогена (пседоэозинофилы), усл. ед. |
2,29 ± 0,04 |
2,15 ± 0,02* |
2,14 ± 0,03* |
1,93 ± 0,03* |
|
СГК миелопероксидазы (псевдоэозиноф.), усл. ед. |
2,9 ± 0,06 |
3,1 ± 0,07* |
3,2 ± 0,07* |
3,3 ± 0,07* |
Параллельное изучение лейкоцитов крови кроликов при введении ионола 150 мг/кг показало определенные изменения как количественного, так и качественного характера. Они носили обратно пропорциональный характер количественным изменениям красной крови (табл. 1). В лейкоцитограмме наблюдалось увеличение относительного числа псевдоэозинофилов, моноцитов при соответствующем понижении содержания лимфоцитов. Одновременно происходил сдвиг «влево» в нейтрофилограмме и лимфоцитограмме (табл. 2).
Следовательно, ионол при концентрации в организме равной и выше 150 мг/кг, вероятно, не проявлял антиоксидантное свойство, не ингибировал свободнорадикальное окисление, а затормаживал биологическое окисление, подавляя синтез АТФ в дыхательной цепи в митохондриях.
В лейкоцитограмме также изучались деструктивные формы, которые отличались необычной структурой. В наших исследованиях, как в норме, так и при воздействии ионолом (150 мг/кг), были отмечены различные проявления альтерации лейкоцитов (рис. 1–5).
Cреди нетипичных гранулоцитов были выявлены псевдоэозинофилы с «токсикогенной зернистостью». Токсикогенная зернистость наблюдалась в цитоплазме юных, палочкоядерных и чаще сегментоядерных псевдоэозинофилов. Эти гранулы грубо пикнотичны, с резкими контурами, неодинаковой величины и, как правило, имеют темный оттенок. Форма гранул неправильная или в виде коротких толстых палочек. Цитоплазма между ними отличалась некоторым просветлением. Ядро псевдоэозинофилов с «токсигенной зернистостью» характеризовалось в одних случаях плотной структурой хроматина, а в других – некоторыми признаками «распластывания», т.е. постепенной гомогенизацией его содержимого. В таких клетках «токсигенная зернистость» была видна и на поверхности ядер (рис. 1).
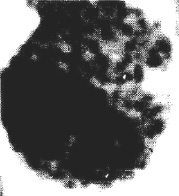
Рис. 1. Псевдоэозинофил с «токсигенной зернистостью»
В противоположность псевдоэозинофилам с «токсигенной зернистостью» в периферической крови кроликов встречались и гранулоциты со скудной или вовсе без специфической зернистости. Ядро таких клеток сохраняло свое типичное строение или подвергалось фрагментации (рис. 2). Размеры псевдоэозинофилов при этом также изменялись. Одни клетки увеличивались, как бы набухали, другие, наоборот, уменьшались, сморщивались. В такой клетке иногда оставался лишь один сегмент ядра с эксцентричным расположением. Цитоплазма приобретала комковатый характер и окрашивалась оксифильно. Параллельно в мазках крови встречались псевдоэозинофилы, ядро которых распадалось одновременно на множество мелких частиц. Специфическая зернистость цитоплазмы сохраняла прежний вид, но иногда между ними появлялись вакуоли.
Процесс отмирания псевдоэозинофилов совершался и другим путем, когда преобладал кариолизис и цитолизис. В этом случае клетка увеличивалась в размерах. В ядре и цитоплазме наблюдались крупные просветления – вакуоли, а содержимое ядра клетки «растекалось» по всей цитоплазме. Хроматин терял обычную плотность. Структура его становилась нежно гомогенной с отдельными пикнотическими островками. Клетка выпускала множество цитоплазменных выростов, оболочка ее контурировалась очень плохо. Так образовались «тельца Боткина – Гумпрехта» гранулоцитарного происхождения (рис. 3). В некоторых случаях наблюдалась фрагментация псевдоэозинофила на несколько частей в виде разбитого стекла с сохранением структуры ядра и цитоплазмы.
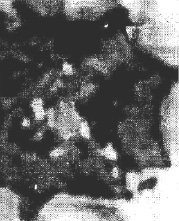
Рис. 2. Псевдоэозинофил с деструкцией ядра
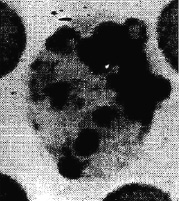
Рис. 3. Тельце Боткина – Гумпрехта (форма растворения псевдоэозинофила)

Рис. 4. Тельце Боткина – Гумпрехта (форма растворения лимфоцита)
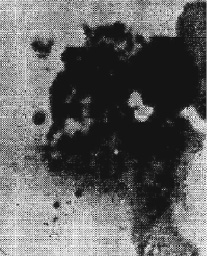
Рис. 5. Распад тельца Боткина – Гумпрехта
Из числа нетипичных лимфоцитов были отмечены такие клетки, которые испытывали разделение ядра на 2 или 3 части. Хроматин ядра при этом имел плотную структуру. Цитоплазма характеризовалась резкой базофилией, или наличием сероватого оттенка, или резко оксифильной розовой окраской. Иногда в ней содержалась мелкая азурофильная зернистость. Наряду с отмирающими лимфоцитами путем распада (циторексис) встречались и «формы растворения» с образованием также «телец Боткина – Гумпрехта» (рис. 4). Моноциты отмирали также путем цитолизиса. В таких случаях «тельца Боткина – Гумпрехта» имели довольно большие размеры (до 30 мк). Описываемые форменные элементы крови возникали в процессе постепенного «распластывания», «расползания» содержимого ядра по всей цитоплазме клетки. При этом ядро набухало, растекалось, изменяя свою обычную форму. Контуры его сглаживались в виде наплывающего тумана, хроматин ядра терял свое характерное строение, «таял», испытывая явление нежной гомогенизации. Вначале этот однородный вид нарушался наличием грубых глыбок хроматина в виде островков и участков просветления, вакуолей. Цитоплазма подвергалась равномерному просветлению. Иногда появлялись вакуоли. Позже происходило полное перемешивание содержимых ядра и цитоплазмы. Одновременно всю клетку как бы обволакивал густой туман и имеющиеся плотные островки хроматина теряли контуры и напоминали далекие темные облака неправильной округлой, перистой или продолговатой формы. В целом клетка заметно увеличивалась в размерах (до 20–27 мк), принимала вид неправильного эллипса со множеством цитоплазматических выростов и имела хорошо выраженные контуры. Кроме того, местами по периферии клетки, примыкая к ее оболочке, появлялись контрастные ножки шириной примерно в 0,5–1,0 мк. В дальнейшем клетка начинала «растекаться», занимая свободное пространство между эритроцитами, и приобретала самые разнообразные формы. Иногда такая клетка напоминала растекающуюся каплю краски в мазке крови. Однако в отличие от азура-11 и эозина она имела красновато-фиолетовый тон. На последнем этапе «тельца Боткина – Гумпрехта» полностью покрывались мелкими просветлениями и начинали крошиться на мелкие фрагменты, образуя детрит (рис. 5).
Выводы
1. Концентрации ионола 60, 100 мг/кг достоверных изменений в составе форменных элементов крови не вызывал. Однако концентрация, превышающая или равная 150 мг/кг. оказывала анемизирующее влияние на систему крови.
2. Повышение относительного содержания ретикулоцитов в периферической крови при эритроцитопении, вероятно, было связано с экспрессией на красного костного мозга в условиях негативного влияния ионола в дозе 150 мг/кг.
3. Лейкемоидная реакция при введении ионола в концентрации 150 мг/кг, очевидно, отражала стресс-реакцию организма в ответ на гипоксемию.
4. Повышение относительного содержания деструктивных лейкоцитов в крови указывало на усиление катаболической фазы в пролиферативном процессе лейкопоэза в условиях действия на организм ионола при дозировке 150 мг/кг.
Рецензенты:Миннебаев М.М., д.м.н., профессор кафедры патофизиологии, ГБОУ ВПО «Казанский государственный медицинский университет», г. Казань;
Овсянников В.Г., д.м.н., профессор, зав. кафедрой патофизиологии, ГБОУ ВПО «Ростовский государственный медицинский университет», г. Ростов-на-Дону.
Работа поступила в редакцию 18.03.2015.



