С улучшением выживания онкологических больных после проведенного лучевого лечения проблема долгосрочных рисков от лучевой терапии, в том числе риск развития второй опухоли, становится все более важной [1, 4, 7, 8]. Известно, что заболеваемость индуцированным лечением раком на 14 % выше в сравнении с населением в целом [5]. Исследования сообщили, что у пациентов, подвергнутых лучевой терапии, есть небольшая (RR 1·1-1·4) повышенная опасность второго рака по сравнению с теми, кто не подвергался лучевой терапии [3, 6].
В настоящее время в рандомизированных клинических испытаниях (Фаза III) наиболее объективно определяется и проверяется только такой показатель, как общая выживаемость. Вместе с тем появление новых видов лечения и многообразие обработки полученных в ходе исследований данных привели к использованию таких показателей, как выживаемость без прогрессирования и время оценки неэффективности лечения [2]. Однако, хотя эти показатели в последнее время часто используются, они еще плохо определены и определения различаются в разных испытаниях, что ограничивает их использование в качестве первичных показателей. Более того, эта изменчивость определений влияет на оценку эффективности лечения.
В 2013 году был опубликован Протокол проекта DATECAN [2]. Проект DATECAN должен привести к разработке рекомендаций, которые могут быть использованы в качестве руководящих принципов в исследованиях, что должно привести к стандартизации определений времени до наступления события в рандомизированных клинических испытаниях, позволяя выполнить соответствующие сравнения результатов будущих исследований [2].
Цель исследования: определить выживаемость больных первично-множественным метахронным раком после лучевой терапии первой опухоли с учетом вида (бета-терапия, гамма-терапия, фотонная – глубокая рентгеновская, фотонная-рентгеновская) и способа (близкофокусная, аппликационная, внешнее дистанционное облучение, внутриполостная, дистанционная и внутриполостная, дистанционная и внутритканевая, открытыми полями) лучевой терапии и риск возникновения неблагоприятного исхода в период лечения.
Материал и методы исследования
Материалом исследования являлись архивные данные по лечению больных в Челябинском окружном онкологическом диспансере (ГБУЗ ЧОКОД). Мы выделили группу из 232 больных, у которых впоследствии после лучевой терапии первой опухоли возникли первично-множественные метахронные опухоли. Для статистической обработки результатов исследования мы использовали программы IBM SPSS Statistics Version 22.0.0.0; Statistica Version 10.0.0.0.
Результаты исследования и их обсуждение
Средний возраст больных на момент установления диагноза первичной опухоли составил 60,23 лет (от 18 до 85 лет). Интервал времени от появления первой опухоли до появления второй опухоли составил в среднем 91,81 месяц, интервал времени от начала лучевой терапии первой опухоли до появления второй опухоли составил в среднем 87,90 месяцев. В группах живых (134 человека) и умерших (98 человек) больных интервал времени от начала лучевой терапии первой опухоли до появления второй опухоли составил в среднем соответственно 97,05 и 75,42 месяцев. При анализе сроков возникновения второй опухоли по критерию однородности дисперсий (статистика Ливиня) для сроков возникновения второй опухоли от начала лучевой терапии достоверные различия вышеуказанного показателя в группах живых и умерших получены не были (показатели значимости = 0,156). В результате проведенного однофакторного дисперсионного анализа определено, что дисперсия между средними значениями срока развития второй опухоли от начала лучевого лечения всего в 3,5 раза выше, чем внутригрупповая дисперсия (F = 3,545; значимость = 0,061).
В среднем в группе пациентов, получивших лучевую терапию первой опухоли, пациенты прожили 129,41 месяцев от момента установки диагноза первой опухоли, 127,03 месяца от начала лучевого лечения первой опухоли и 37,64 месяца от момента появления второй опухоли.
На следующем этапе исследований мы определили выживаемость больных в зависимости от вида лучевой терапии (бета-терапия, гамма-терапия, фотонная – глубокая рентгеновская, фотонная-рентгеновская) (рис. 1).
Среднее время выживания после бета-терапии и гамма-терапии было одинаковым и составило 204,00 месяца, после фотонной глубокой рентгентерапии – 60,00 месяцев, после фотонной рентгеновской – 125,88 месяцев (рис. 1).
На следующем этапе наших исследований мы определили выживаемость больных в зависимости от способа лучевой терапии (близкофокусная, аппликационная, внешнее дистанционное облучение, внутриполостная, дистанционная и внутриполостная, дистанционная и внутритканевая, открытыми полями) (рис. 2).
По данным рис. 2, среднее время выживания после применения близкофокусной терапии составило 83,25 месяца, после внешнего аппликационного облучения – 54,00 месяца, после внешнего дистанционного облучения, внутриполостной терапии и сочетанной терапии (дистанционное и внутриполостное облучение) время выживания было одинаковым и составило 204,00 месяца, после сочетания дистанционной и внутриполостной терапии – 123,00 месяца и после облучения открытыми полями – 60,00 месяцев (рис. 2).
На следующем этапе наших исследований мы определили риск возникновения неблагоприятного исхода в период лечения больных в зависимости от вида и способа лучевой терапии (рис. 3, 4).
По данным рис. 3, риск возникновения неблагоприятного исхода в период лечения при бета-терапии несколько повышался в интервалах 48 и 108 месяцев, при гамма-терапии риск возникновения неблагоприятного исхода в период лечения повышался в интервалах 12, 36, 48 и 96 месяцев, при фотонной рентгеновской терапии риск возникновения неблагоприятного исхода в период лечения повышался в интервалах 36, 72 и 120 месяцев (рис. 3).
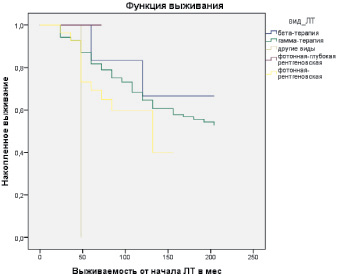
Рис. 1. Выживаемость больных в зависимости от вида лучевой терапии
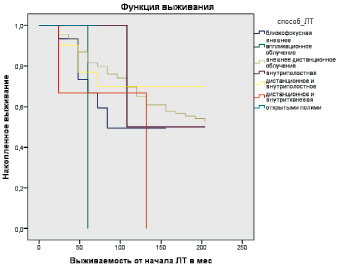
Рис. 2. Выживаемость больных в зависимости от способа лучевой терапии
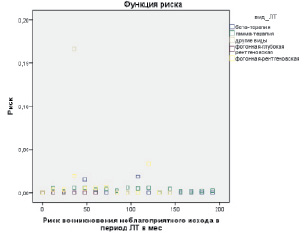
Рис. 3. Риск возникновения неблагоприятного исхода в период лечения в зависимости от вида лучевой терапии
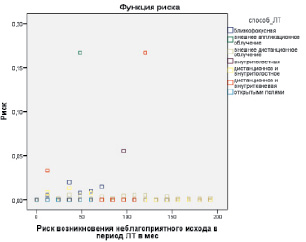
Рис. 4. Риск возникновения неблагоприятного исхода в период лечения в зависимости от способа лучевой терапии
По данным рис. 4, риск возникновения неблагоприятного исхода в период лечения при близкофокусной лучевой терапии несколько повышался в интервалах 36 и 72 месяцев, при внешнем аппликационном облучении риск возникновения неблагоприятного исхода в период лечения повышался в интервале 48 месяцев, при внешнем дистанционном облучении риск возникновения неблагоприятного исхода в период лечения повышался в интервале 204 месяца, при внутриполостной терапии – в интервале 96 месяцев, при сочетании внутриполостной терапии и дистанционного облучения – в интервале 36 месяцев, при сочетании дистанционной и внутритканевой терапии риск возникновения неблагоприятного исхода в период лечения повышался в интервалах 12 и 120 месяцев (рис. 4).
Заключение
Таким образом, наше исследование показало, что наибольшая выживаемость больных с первично-множественными метахронными опухолями отмечается в группах больных с бета- и гамма-терапией с внешним дистанционным облучением первой опухоли, а наименьшая – в группе больных с глубокой фотонной рентгентерапией и близкофокусной терапией первой опухоли. При этом риск возникновения неблагоприятного исхода в период лечения повышался по интервалам неодинаково для различных видов и способов лучевой терапии.
Рецензенты:Яйцев С.В., д.м.н., профессор, заведующий кафедрой онкологии, ГБОУ ВПО ЮУГМУ, г. Челябинск;
Жаров А.В., д.м.н., профессор кафедры онкологии, лучевой диагностики и лучевой терапии, ГБОУ ВПО ЮУГМУ, г. Челябинск.
Работа поступила в редакцию 24.02.2015.



