Во всем мире увеличение числа случаев первично-множественных злокачественных опухолей (ПМЗО) среди пациентов после химиотерапии (ХТ) и лучевой терапии первой опухоли является серьезной проблемой современности [10, 13]. В 2011 г. в России было выявлено 522 410 новых случаев злокачественных новообразований, из них впервые выявлено 24 774 первично-множественных опухолей (17,3 на 100 000 населения), что составляет 4,7 % всех впервые выявленных злокачественных новообразований (в хорошо сбалансированных отчетах наблюдается колебание удельного веса данного показателя от 5 до 10 %). Контингент больных с первично-множественными опухолями на конец 2011 г. составил 105 157 больных, что соответствует 3,6 % от общего числа больных, состоящих на учете [1].
При изучении частоты ПМЗО, индуцированных лечением, некоторые авторы указывают на увеличение частоты ПМЗО среди наблюдаемых пациентов по сравнению с ожидаемыми, в том числе лейкемии, связанной, по мнению авторов, в числе прочих факторов, и с предшествующей химиотерапией первой опухоли [12]. В некоторых опубликованных популяционных исследованиях также указывалось на более частое развитие лейкоза у больных после химиотерапии, с различной частотой в зависимости от применяемого цитотоксического препарата [5, 6, 7, 8].
В связи с наблюдаемым в последние десятилетия прогрессом в медицине, приведшим к улучшению диагностики и лечения рака и, как следствие, повышению выживаемости пролеченных онкобольных, проблема первично-множественных злокачественных опухолей (ПМЗО) стала особенно важной для выживших пациентов [11]. Так, в США общая 5-летняя выживаемость среди онкологических больных составляет около 65 % [9], в Корее общая 5-летняя выживаемость увеличилась с 41,2 % в 1993–1995 годах до 57,1 % в 2003–2007 гг. [2, 4]. По данным исследователей, в США примерно у 8 % оставшихся в живых после лечения рака пациентов диагностируют вторую опухоль, в целом 10 % всех новых случаев рака диагностируется у оставшихся в живых после лечения первой опухоли [9, 14, 15]. В Корее уровень заболеваемости раком увеличивался на 2,6 % ежегодно с 1999 по 2005 гг. и около 2 % всех новых случаев рака были диагностированы у оставшихся в живых после лечения первой опухоли. По данным литературы, число ПМЗО увеличивается в связи с увеличением числа выживших онкобольных после лечения, т.е. с улучшением выживаемости [2, 4].
Цель исследования: определить выживаемость больных первично-множественным метахронным раком после химиотерапии первой опухоли с учетом вида химиотерапии (адъювантная, неоадъювантная/адъювантная, неоадъювантная, самостоятельная) и риск возникновения неблагоприятного исхода в период лечения.
Материал и методы исследования
Материалом исследования являлись архивные данные по лечению больных в Челябинском окружном онкологическом диспансере (ГБУЗ ЧОКОД). Мы выделили группу из 124 больных, у которых впоследствии после химиотерапии первой опухоли возникли первично-множественные метахронные опухоли. Для статистической обработки результатов исследования мы использовали программы IBM SPSS Statistics Version 22.0.0.0; Statistica Version 10.0.0.0.
Результаты исследования и их обсуждение
Средний возраст больных на момент установления диагноза первичной опухоли составил 55,79 лет (от 30 до 80 лет). Средний возраст в группах живых (101 больной) и умерших (23 больных) пациентов составляет соответственно 56,33 лет (от 30 до 80 лет) и 53,43 лет (от 32 до 74 лет). В результате проведенного однофакторного дисперсионного анализа определено, что дисперсия между средними значениями возраста в 1,49 раза выше, чем внутригрупповая дисперсия (F = 1,491; значимость = 0,224). При определении робастных критериев равенства средних Статистика Уэлча и Брауна ‒ Форсайта (= 1,398; значимость = 0,246) асимптотически стремятся к F-распределению. Количество курсов химиотерапии и длительность химиотерапии так же достоверно не различались в группах живых и умерших пациентов. В среднем пациенты получили 2,43 курса ХТ и длительность ХТ составила 3,3 месяца. В группах живых и умерших пациентов эти показатели составляют соответственно 2,36 курса и 3,31 месяца и 2,76 курса и 3,27 месяца. В результате проведенного однофакторного дисперсионного анализа определено, что дисперсия между средними значениями количества курсов и длительности ХТ всего в 0,745 и 0,004 раза выше, чем внутригрупповая дисперсия (F = 0,745; значимость = 0,390 и F = 0,004; значимость = 0,948 соответственно). При определении робастных критериев равенства средних Статистика Уэлча и Брауна ‒ Форсайта для показателя количества курсов ХТ (= 0,660; значимость = 0,424) и показателя длительность ХТ (= 0,005; значимость = 0,942) асимптотически стремятся к F-распределению.
В среднем в группе пациентов, получивших химиотерапию первой опухоли, пациенты прожили 67,76 месяца от начала лечения первой опухоли и 31,02 месяца от момента появления второй опухоли. Интервал времени между первой и второй опухолями составил в среднем 45,2 месяца, интервал времени от начала ХТ первой опухоли до появления второй опухоли составил 36,17 месяцев. Для всех вышеуказанных показателей корреляция Пирсона была значима на уровне 0,01 (двусторонняя значимость = 0,000).
На следующем этапе исследований мы определили выживаемость больных в зависимости от вида химиотерапии (адъювантная, неоадъювантная/адъювантная, неоадъювантная, самостоятельная) (рис. 1).
Среднее время выживания после адъювантной химиотерапии составило 192,00 месяца, после неоадъювантной/адъювантной химиотерапии – 112,16 месяца, после неоадъювантной – 72,00 месяца и после самостоятельной химиотерапии – 204,00 месяца (рис. 1).
На следующем этапе наших исследований мы определили риск возникновения неблагоприятного исхода в период лечения больных в зависимости от вида химиотерапии (адъювантная, неоадъювантная/адъювантная, неоадъювантная, самостоятельная) (рис. 2).
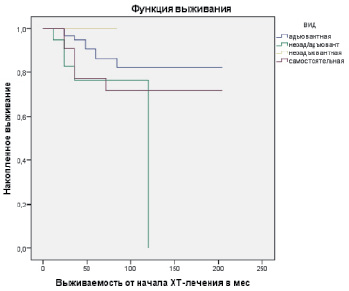
Рис. 1. Выживаемость больных в зависимости от вида химиотерапии
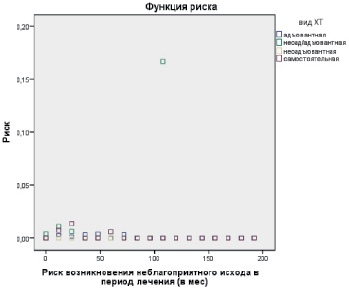
Рис. 2. Риск возникновения неблагоприятного исхода в период лечения
По данным рис. 2 риск возникновения неблагоприятного исхода в период лечения был практически одинаков для всех видов химиотерапии. При этом необходимо отметить, что число терминальных случаев в группе с адъювантной химиотерапией было несколько выше для интервалов 12, 36 и 48 месяцев от начала химиотерапии, в группе с неоадъювантной/адъювантной – для интервалов 12 и 108 месяцев, в группе с самостоятельной химиотерапией – для интервалов 12 и 24 месяцев, а в группе с неоадъювантной химиотерапией – для всех интервалов число терминальных случаев было равно нулю (рис. 2).
В настоящее время в рандомизированных клинических испытаниях (Фаза III) наиболее объективно определяется и проверяется только такой показатель, как общая выживаемость. Вместе с тем появление новых видов лечения и многообразие обработки полученных в ходе исследований данных привели к использованию таких показателей, как выживаемость без прогрессирования и время оценки неэффективности лечения [3]. Однако, хотя эти показатели в последнее время часто используются, они еще плохо определены и определения различаются в разных испытаниях, что ограничивает их использование в качестве первичных показателей. Более того, эта изменчивость определений влияет на оценку эффективности лечения.
В 2013 году был опубликован Протокол проекта DATECAN [3]. Проект DATECAN должен привести к разработке рекомендаций, которые могут быть использованы в качестве руководящих принципов исследователями, участвующими в клинических испытаниях рака, что в свою очередь должно привести к стандартизации определений времени до наступления события в рандомизированных клинических испытаниях, позволяя выполнить соответствующие сравнения результатов будущих исследований [3].
Заключение
Таким образом, наше исследование показало, что наибольшая выживаемость больных с первично-множественными метахронными опухолями отмечается в группах больных с самостоятельной и адъювантной химиотерапией первой опухоли, а наименьшая – в группе больных с неоадъювантной химиотерапией первой опухоли. При этом риск возникновения неблагоприятного исхода в период лечения был практически одинаков для всех видов химиотерапии.
Рецензенты:Яйцев С.В., д.м.н., профессор, заведующий кафедрой онкологии, ГБОУ ВПО ЮУГМУ, г. Челябинск;
Жаров А.В., д.м.н., профессор кафедры онкологии, лучевой диагностики и лучевой терапии ГБОУ ВПО ЮУГМУ, г. Челябинск.
Работа поступила в редакцию 02.03.2015.



