Заболеваемость и смертность раком органов полости рта (РОПР) в последние годы имеет тенденцию к росту во всем мире и в структуре онкопатологии, составляя 2,3 %. Ежегодно у 90 тысяч человек в мире впервые диагностируются опухоли данной локализации [9].
Стандартизированный показатель заболеваемости в Европе равен 1,6 на 100 тысяч населения, а в мире этот показатель составляет 1,15 [7, 9].
В России в структуре онкологической заболеваемости населения в 2013 году рак слизистой оболочки полости рта составляет около 5,5 % [4]. Среди опухолей головы и шеи данная патология занимает второе место, после рака гортани [6].
Рост данной патологии связывается с курением, употреблением крепких алкогольных напитков, плохой гигиеной полости рта, неполноценным питанием, неудовлетворительными результатами лечения предраковых заболеваний [5].
Рак орофарингеальной зоны среди причин летальности стоит на 4-м месте, после рака легкого, желудка и колоректальной зоны [6].
Несмотря на появление различных современных методик лечения, смертность от рака органов полости рта в Российской Федерации у мужчин занимает 7 место, у женщин – 16-е и в 2007 году составила 8,1 и 1,1 на 100 тысяч населения [6], эти данные указывают на необходимость продолжения изучения онкогенеза с других сторон.
В последние годы появилось много исследований, посвященных связи онкопатологии и вирусных инфекций, изучающих так называемый вирус-ассоциированный онкогенез. Было доказано, что более чем в 15 % этиологическими агентами новообразований являются вирусы [10].
Из всех вирусов наибольший интерес исследователей вызывают вирус Эпштейна ‒ Барр (ВЭБ) и вирус папилломы человека (ВПЧ), им посвящено большое количество научных работ [3].
По данным зарубежных авторов, доказательствами связи вируса Эпштейна ‒ Барр и развития новообразований являются: моноклональность ДНК ВЭБ в опухолевых клетках, высокий уровень свободной вирусной ДНК в плазме крови пациентов, наличие корреляции между титром антивирусных антител, уровнем свободной вирусной ДНК в плазме пациента и тяжестью заболевания, также повышенный титр антивирусных антител часто предшествует появлению новообразования и остается высоким на момент постановки диагноза [8].
Перерождение же папилломы в злокачественное новообразование прямо пропорционально связи между онкогенным белком и опухолевым супрессорным белком, например Е6 связывается с р53, Е7 с Rb. Папилломавирусы – единственная группа вирусов, для которых доказано, что они индуцируют образование опухолей у человека в естественных условиях. Онкопротеин Е6 экспрессирует телемеразу, ответственную за активацию пролиферации клеток. Онкобелок Е7 в сочетании с метаболизированием эстрадиола и как следствие образования 16а-гидроксистерона (16а-ОНЕ1), активирующего экспрессию гена Е7, является патогенетической основой вирус-индуцированного онкогенеза. Все это обеспечивает пролиферацию опухолевых клеток и подавляет иммунный ответ [2]. Наличие Е7 (Е6) в цервикальных пробах свидетельствует о процессе малигнизации эпителиальных клеток. Так, для выявления онкопротеина Е7 были созданы тест-системы, для ИФА [2].
Оценка локального уровня некоторых цитокинов при данных процессах представляет отдельный интерес, поскольку воспалительный процесс вызывает их гиперпродукцию иммунокомпетентными клетками, и некоторые из них могут быть факторами роста и распространения опухоли [1].
Исследование микрососудистой инвазии опухолевых клеток в эндотелиальный слой сосудов вызывает интерес как предиктор высокой стадии, степени и распространённости опухоли и, как следствие, возможность ее использования с прогностической целью для оценки течения и прогноза заболевания.
Таким образом, с учетом мониторинга совокупности факторов, ассоциированных с онкогенезом, представляется целесообразным уточнение их прогностической значимости для оценки прогрессирования процесса при раке органов полости рта.
Цель исследования – оценить роль вирусов Эпштейна – Барр и папилломы человека, микрососудистой инвазии и локального уровня цитокинов (ИЛ-2, ИЛ-8, ИЛ-6, ИЛ-10, ИЛ-1β, ИЛ1RА, ИНФ-α, ИНФ-γ, ФНО-α) на течение РОПР.
Материалы и методы исследования
Объектом исследования были 72 больных РОПР, которые были разделены на 3 группы по 24 человека, первая группа с наличием регионарных метастазов, вторая – без метастазов, третья – с рецидивами, проходивших лечение в отделении опухолей головы и шеи ФГБУ «РНИОИ» МЗ РФ в 2004–2012 гг.
Мужчин было 56, женщин – 16. Возраст больных составлял 34–73 года. По распространенности процесса: со II стадией (T2N0M0) было 13 человек, III – 30 (T2N1M0 – 4, T3N0M0 – 18, T3N1M0 – 8), IV – 29 (T3N2M0 – 4, T4N0M0 – 15, T4N1M0 – 10).
У 59 (81,9 %) больных опухолевым процессом был поражен язык, у 13 (18,1 %) – слизистая дна полости рта. На языке опухоль располагалась чаще на боковой поверхности (52,8 %).
У всех больных был плоскоклеточный рак. Высокая степень дифференцировки (G1) имела место у 22 больных, средняя степень (G2) – 35 и низкая степень (G3) – 15.
Материалом для исследования служили фиксированные в формалине и парафине (FFPE ткани) интраоперационно взятые образцы ткани опухоли и перитуморальной зоны.
Из FFPE ткани экстракцию вирусной ДНК проводили в ручном режиме методом сорбции на колонках с использованием набора реагентов «QIAamp DNA FFPE Tissue Kit» (QIAGEN, Германия).
Из гомогената ткани опухоли, взятой интраоперационно, ДНК вируса выделяли методом сорбции на магнитных частицах в автоматическом режиме на приборе MagNa Pure Compact с использованием набора реагентов MagNa Pure Compact Nucleic Acid Isolation Kit I-Large Volume на приборе MagNa Pure Compact (Roche, Швейцария). Амплификацию с последующей детекцией ДНК осуществляли методом полимеразной цепной реакции (ПЦР) с гибридизационно-флуоресцентной детекцией в режиме реального времени на термоциклере RotorGene 6000 (QIAGEN, Германия).
Выявление ДНК вируса ВЭБ, цитомегаловируса (ЦМВ), вируса герпеса человека 6 типа (ВГЧ) и вируса папилломы человека (ВПЧ) проводили методом мультиплексной ПЦР с гибридизационно-флуоресцентной детекцией продуктов амплификации в режиме «реального времени» на термоциклере Rotor Gene 6000 (QIAGEN, Германия).
Для определения ДНК, генотипа (ВПЧ) и концентрации вируса в образцах использовали наборы реагентов производства ФБУН «ЦНИИ эпидемиологии» Роспотребнадзора.
Методом ELISA определяли локальные уровни интерлейкинов (ИЛ-2, ИЛ-8, ИЛ-6, ИЛ-10, ИЛ-1β, ИЛ1RА, ИНФ-α, ИНФ-γ, ФНО-α) в гомогенатах фрагментов ткани опухоли и пограничной с опухолью макроскопически неизмененной ткани, взятые интраоперационно. Рассчитывали удельное содержание цитокинов (пг/мл на 1 г белка).
Иммуногистохимическое исследование проводили на срезах с парафиновых блоков, предназначенных для стандартного морфологического исследования. Парафиновые срезы депарафинировали и регидратировали по стандартной методике. «Демаскировку» антигенов проводили в PT-Link Thermo. Протокол включал в себя предварительный нагрев до 65 °С, восстановление антигена в течение 20 минут при температуре 97 °С и дальнейшее охлаждение до 65 °С. Затем стекла промывались в течение 1–3 минут TBS-буфером (Dako) и помещались в автостейнер Thermo Scientific для окрашивания в автоматическом режиме. Для визуализации иммуногистохимической реакции использовали систему детекции Reveal Polyvalent HRP-DAB Detection System. Срезы докрашивали гематоксилином Майера, для заключения использовали бальзам Bio-Mount. Оценку экспрессии маркеров изучали как минимум на 10 случайно выбранных полях с применением светового микроскопа «Leica» (Германия) под увеличением х10, х20, х40.
Для оценки ангиогенеза в опухолях применяли окрашивание микрососудов антителом CD34. Количество сосудов определяли в каждом поле зрения препарата при использовании объектива х40.
Для оценки пролиферативной активности опухоли подсчитывали количество ki-67-положительных опухолевых клеток, приходящихся на 200–300 опухолевых клеток, использовали антиген ki-67. Также определяли нормальный и мутантный тип p53.
Статистическая обработка осуществлялась программой Statistica 6,0.
Результаты исследования и их обсуждение
Данные молекулярно-биологических исследований показали, что уровень инфицирования ткани опухоли вирусами папилломы человека составил 20,8 %, в том числе низкого онкогенного риска 5,4 %, высокого 15,3 % Чаще других были выявлены 16 тип (11,1 %) и 11 тип ВПЧ (4,2 %). Частота инфицирования пациентов в зависимости от группы представлена на рис. 1.
Установлена зависимость частоты метастазирования и рецидивирования опухоли от группы вируса. ВПЧ низкого и высокого онкогенного риска чаще были обнаружены в образцах без метастазов.
Частота инфицирования ткани опухоли вирусами группы герпеса составила 68,1 %, в т.ч. вируса простого герпеса 1 типа (ВПГ 1 типа) 5,5 %, цитомегаловируса (ЦМВ) 11,1 %, вируса Эпштейна ‒ Барр (ВЭБ) 62,5 %, вируса герпеса человека 6 типа (ВГЧ 6 типа) 16,7 %. На рис. 2 представлено распределение инфицированности вирусами группы герпеса в зависимости от группы больных.
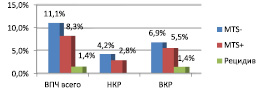
Рис. 1. Частота инфицирования FFPE ткани у пациентов с метастазами, без метастазов, с рецидивами
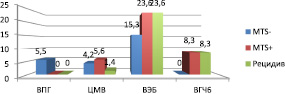
Рис. 2. Частота инфицирования ткани опухоли вирусами группы герпеса у пациентов с метастазами, без метастазов и с рецидивами
С увеличением распространенности опухолевого процесса было отмечено увеличение частоты инфицирования ткани опухоли вирусами группы герпеса. В большей степени это положение характерно для ВЭБ, ВГЧ 6 типа. Так, суммарная частота инфицирования всеми представителями этой группы для стадии Т2 составила 70,6 %, Т3 – 80 %, Т4 – 84 %. Для цитомегаловируса эти показатели составили 5,9; 12,5 и 16 %, для вируса Эпштейна – Барр – 64,7; 80 и 80 %, для вируса герпеса 6 типа 11,7; 16,7 и 20 % соответственно.
При анализе клинических данных в сопоставлении с полученными лабораторными было установлено, что у больных с регионарными метастазами ВЭБ встречался в 17 случаях (70,8 %) от общего числа больных данной группы), в то время как ВПЧ – в одном (25 %). У больных без метастазов ВЭБ был выявлен в 11 случаях (45,8 %), в то время как ВПЧ – у 8 (33,3 %). Для больных с рецидивами ВЭБ составил – 17 случаев (70,8 %), а ВПЧ – 1 (1,4 %). Таким образом, у больных с метастазами и рецидивами выявление ВЭБ-ассоциированного рака было выше (70,8 %), чем у больных без метастазов (45,8 %), в то время как ВПЧ-позитивные больные встречались чаще в группе без метастазов (33,3 %), в отличие от других групп (25 и 1,4 %).
При изучении локальных уровней цитокинов (ИЛ-2, ИЛ-8, ИЛ-6, ИЛ-10, ИЛ-1β, ИЛ1RА, ИНФ-α, ИНФ-γ, ФНО-α) отмечено статистически значимое (р < 0,05) более высокое содержание провоспалительных цитокинов ИЛ-1ß, ИЛ-6, ИЛ-8 в группе больных без регионарных метастазов; у больных с регионарными метастазами наблюдались сходные различия, статистически значимые по ИЛ-1ß и ИЛ-8. При рецидивах подобная разница отмечена только по уровню ИЛ-6. Следует отметить, что при рецидивах в тканевых образцах перифокальной зоны и опухоли утрачиваются различия по ИЛ-1ß и ИЛ-8, выраженные в двух других группах, что говорит о приближении иммунологических характеристик визуально не малигнизированной ткани к опухолевой и может косвенно свидетельствовать об утрате ею свойств, ограничивающих пролиферативный потенциал опухоли.
В ткани опухоли не найдено статистически достоверных различий цитокинового состава в зависимости от наличия рецидива или метастазов; в перифокальной, зоне обнаружено 2 различия: при рецидивах опухоли выше, чем при первичной оказались уровни ФНО-α и ИЛ-1ß. Однако, с учетом наличия во многих случаях воспаления, роль цитокинов представляется неспецифической для опухолевого процесса, и вклад найденных различий в развитие рецидивирования или метастазирования остается неясным.
При оценке внутриопухолевой микрососудистой плотности с использованием CD34 выявлено в каждой из исследуемых групп преобладание мелких тонкостенных сосудов. В группе с метастазами и рецидивами также отмечено наличие сосудов и более крупного диаметра с утолщенной стенкой.
Среднее количество сосудов в 1 поле зрения: в группе без метастазов составило 6,4 ± 0,7; в группе с метастазами 8,8 ± 0,9*; в группе с рецидивами 9,7 ± 0,8* (* – отличия показателей статистически достоверны по отношению к группе без метастазов (Р ≤ 0,05)).
Проведение иммуногистохимического исследования выявило наличие достоверных различий экспрессии опухолевыми клетками Ki-67 и P53
|
Группа без метастазов |
Группа с метастазами |
Группа с рецидивами |
|
|
Ki-67 |
24,3 ± 2,6 |
46,7 ± 4,1* |
27,5 ± 2,9 º |
|
P53 |
21,2 ± 3,9 |
60,1 ± 3,7* |
33,5 ± 3,6* º |
Примечания:
* – отличия показателей статистически достоверны по отношению к группе без метастазов (Р ≤ 0,05);
º – отличия показателей статистически достоверны по отношению к группе с метастазами (Р ≤ 0,05).
Нами также отмечено снижение частоты встречаемости положительных случаев по р53 в группе рецидивов, что может свидетельствовать не только о присутствии в клетках функционального («дикого типа») р53, но и о наличии мутантного р53 с «нулевым» фенотипом (отсутствием транскрипции белка) – так называемые ложно-отрицательные случаи.
Заключение
1. Инфицированность вирусами папилломы человека ткани опухоли можно рассматривать как благоприятный прогностический признак в отношении развития метастазов у больных с раком органов полости рта (в группе без метастазов (33,3 %), в отличие от других групп (25 и 1,4 %)). Инфицирование вирусами группы герпеса ткани опухоли можно рассматривать как неблагоприятный прогностический признак (выявление ВЭБ-ассоциированного рака – 70,8 % у больных с метастазами и рецидивами, у больных без метастазов 45,8 %).
2. Различия тканевого цитокинового состава между больными раком языка и полости рта без регионарных метастазов, с регионарными метастазами и при рецидивах статистически не значимы. При этом показаны различия их уровня между тканью опухоли и перитуморальной области с преобладанием содержания провоспалительных цитокинов ИЛ-1ß, ИЛ-6, ИЛ-8 в опухолевой ткани. Вероятно, избыток провоспалительных цитокинов, у которых описаны ростостимулирующие свойства, наблюдается за счет их продукции опухолевыми клетками, а также присутствующими в очаге активированными макрофагами, что способствует росту и распространению опухоли.
3. Преобладание сосудов крупного диаметра с утолщенной стенкой может коррелировать с наличием или возможным развитием метастазов и рецидивов, таким образом, иметь неблагоприятный прогностический характер.
Перечень сокращений:
ВГЧ – вирус герпеса человека,
ВПГ 1 типа – вирус простого герпеса 1 типа,
ВГЧ 6 типа – вирус герпеса человека 6 типа,
ВПЧ – вирус папилломы человека,
ВПЧ 16 типа – вирус папилломы человека 16 типа,
ВПЧ ВКР – вирус папилломы человека высокого канцерогенного риска,
ВПЧ НКР – вирусы папиллом человека низкого канцерогенного риска,
ВЭБ – вирус Эпштейна ‒ Барр,
ДНК – дезоксирибонуклеиновая кислота,
ИЛ-2 – Интерлейкин-2,
ИЛ-6 – Интерлейкин-6,
ИЛ-8 – Интерлейкин-8,
ИЛ-10 – Интерлейкин-10,
ИЛ-1β – Интерлейкин – 1β,
ИЛ1RА – Интерлейкин 1RА,
ИНФ-α – Интерферон-α,
ИНФ-γ – Интерферон-γ,
ИФА – Иммуноферментный анализ,
ПЦР – полимеразная цепная реакция,
РОПР – рак органов полости рта,
ЦМВ – цитомегаловирус,
ФНО-α – Фактор некроза опухоли – α.
Рецензенты:Каймакчи О.Ю., д.м.н., ассистент кафедры онкологии, Ростовский государственный медицинский университет, г. Ростов-на-Дону;
Шихлярова А.И., д.б.н., профессор, руководитель лаборатории изыскания новых противоопухолевых средств и изучение механизма их действия, ФГБУ РНИОИ МЗ РФ, г. Ростов-на-Дону.
Работа поступила в редакцию 02.03.2015.



