При замещении дефектов апоневроза брюшной стенки широко используются сетчатые протезы из различных синтетических полимерных материалов. Применение имплантатов привело к возникновению новой клинической проблемы – увеличению количества случаев инфекционных осложнений [7, 10]. При использовании протеза количество осложнений со стороны раны, таких как нагноение, серома, гематома, отторжение протеза, может достигать 18,6–67 % [3, 4, 5, 8]. Послеоперационные осложнения являются основной причиной продолжительного течения послеоперационного периода и значительного увеличения материальных затрат на лечение [2, 9]. Одним из решений данной проблемы является придание сетчатому протезу антимикробных свойств путем иммобилизации антимикробных средств на поверхности или введения их в структуру медицинского изделия. В литературе приведены данные об использовании антибиотиков и антисептиков в составе эндопротезов [6, 10].
Масштабное и неконтролируемое применение антибиотиков привело к антибиотикорезистентности. Накопление фактических данных о неуклонно возрастающей антибиотикорезистентности микроорганизмов и ее роли в развитии и исходах инфекционного процесса послужило мощным стимулом для разработки новых бактерицидных средств [1, 11]. Одним из перспективных направлений в решении данной проблемы является применение нанобиотехнологий, направленных на совершенствование специфических свойств наночастиц металлов, определяемых их структурной модификацией, что позволяет достигать различных биологических эффектов, в том числе и антибактериальных [6].
Материалы и методы исследования
Материалами для данного исследования послужили 5 сетчатых эндопротезов для герниопластики: Унифлекс (фирма «Линтекс»), Эсфил (фирма «Линтекс»), Унифлекс Ag (фирма «Линтекс»), Эсфил Ag (фирма «Линтекс») и один сетчатый эндопротез для пластики брюшной стенки фирмы «Плазмофильтр». В ходе исследования была изучена чувствительность 6 музейных тест-штаммов следующих микроорганизмов: S. aureus 25923 АТСС, E. соli 25922 АТСС, Р. vulgaris 4636 АТСС, P. aeruginosa 27853 АТСС, C. аlbicans 2625 NCTC, B. subtilis 6633 ATCC. Музейные штаммы, используемые в работе, получены из коллекции музея живых культур ФГУН ГИСК им. Л.А. Тарасевича. Определение биоцидной активности исследуемых эндопротезов производили методом диффузии в агар на плотной питательной среде с последующим измерением зоны угнетения роста тест-культур, используемых для определения антимикробного действия сетчатых эндопротезов.
Для определения микробной обсемененности после выведения животных из эксперимента на разные сроки изымали участок брюшной стенки вместе с имплантируемым эндопротезом весом 1 гр. Затем биоптат суспензировали в изотоническом растворе натрия хлорида. После десятикратного разведения суспензии до 10 из каждого разведения производили посев 0,1 мл на поверхность плотной питательной среды, разлитой в чашки Петри. После суточной инкубации в термостате производили подсчет выросших колоний.
Результаты исследования и их обсуждение
Получены следующие данные:
1. Биоцидная активность эндопротезов в отношении Е. соli выше при использовании эндопротеза «Плазмофильтр» (20,4 ± 0,48 мм), чем у Унифлекс Ag (10,7 ± 1,34 мм) и Эсфил Ag (14,5 ± 0,67 мм), в 1,9 и 1,4 раза соответственно.
2. Антимикробные свойства в отношении S. aureus также выше при использовании эндопротеза фирмы «Плазмофильтр» (24,3 ± 1,00 мм) в 4 раза по сравнению с другими сетчатыми эндопротезами, имеющими антимикробное покрытие из серебра.
3. Биоцидная активность в отношении Р. aeruginosa в большей степени выражена при использовании эндопротеза «Плазмофильтр», которая составила 21,9 ± 0,53 мм. При использовании эндопротеза Унифлекс Ag и Эсфил Ag 8,2 ± 0,78 и 10,3 ± 0,90 мм соответственно.
4. Биоцидная активность в отношении Р. vulgaris ниже при использовании эндопротеза Унифлекс Ag (6,3 ± 0,64 мм) в 2,6 раз по сравнению с эндопротезом «Плазмофильтр» (16,9 ± 0,3 мм), при использовании эндопротеза Эсфил Ag (9,4 ± 0,66 мм) ниже в 1,7 раз по сравнению с тем же эндопротезом.
5. Высокие антимикробные свойства в отношении C. albicans наблюдались при изучении всех эндопротезов. При использовании эндопротеза Унифлекс Ag – 24,6 ± 1,27 мм, Эсфил Ag – 31,4 ± 0,8 мм, «Плазмофильтр» – 50,5 ± 1,5 мм.
6. Антимикробной активностью по отношению к грамположительной спорообразующей тест-культуре – B. subtilis – обладает только эндопротез «Плазмофильтр». При изучении остальных образцов задержки роста не наблюдалось.
Для изучения антимикробных свойств эндопротезов нами была определена микробная обсемененность ран (рис. 1).
Однозначно видно, что микробная обсемененность по отношению к кишечной палочке снижается в каждой серии заражений.
Наибольшая микробная обсемененность наблюдалась у эндопротеза Унифлекс на 3 сутки и составила 333,5∙10–4 ± 1,43.
При сравнении данных, полученных на 3 сутки среди всех образцов, было выявлено, что наилучший результат показал «Плазмофильтр» (4,6∙10–4 ± 0,87).
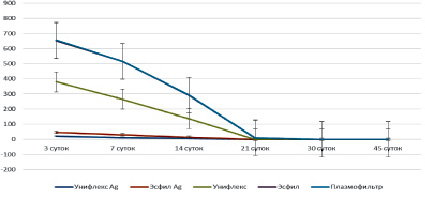
Рис. 1. Результат определения микробной обсемененности ран в отношении E. сoli (M ± m)
На 7 сутки наименьшая микробная обсемененность наблюдалась у «Плазмофильтр» (1,2∙10–4 ± 0,4), а наибольшая ‒ у эндопротеза Эсфил (248,9∙10–4 ± 2,46).
При сравнении данных, полученных на 14 сутки, микробная обсемененность полностью отсутствовала у «Плазмофильтра», а наибольшая была у эндопротеза Эсфил (154,7∙10–4 ± 1,1).
На 21 сутки наблюдали следующие результаты: микробная обсемененность полностью отсутствовала у серебросодержащих эндопротезов, а наибольшая микробная обсемененность продолжала наблюдаться у эндопротеза Эсфил (8,7∙10–4 ± 1,04).
В позднем послеоперационном периоде (30 и 45 сутки эксперимента) микробная обсемененность полностью отсутствовала при использовании всех эндопротезов.
Если сравнивать обсеменённость культурой S. аureus, то она значительно меньше на всех сроках эксперимента, по сравнению с колониями E. сoli (рис. 2).

Рис. 2. Результат определения микробной обсемененности ран в отношении S. aureus (M ± m)
Наибольшая микробная обсемененность S. aureus наблюдалась на 3 сутки, но теперь у эндопротеза Эсфил (70,9∙10–4 ± 2,15).
При сравнении данных, полученных на 7 сутки, микробная обсемененность (при использовании всех образцов) наименьшая наблюдалась у «Плазмофильтр» (1,2∙10–4 ± 0,4), а наибольшая ‒ у эндопротеза Эсфил (52,3∙10–4 ± 2,46).
При сравнении данных, полученных на 14 сутки, микробная обсемененность полностью отсутствовала у «Плазмофильтр», а наибольшая была у Эсфила (47,9∙10–4 ± 2,3).
К 21 суткам микробная обсемененность полностью отсутствовала у эндопротезов Унифлекс Ag и фирмы «Плазмофильтр», а наибольшая микробная обсемененность продолжала наблюдаться у эндопротеза Эсфил (8,7∙10–4 ± 1,04).
В позднем послеоперационном периоде (30 и 45 сутки эксперимента) микробная обсеменённость культурой S. аureus также полностью отсутствовала при использовании всех эндопротезов.
Выводы
Результаты шести параллельных опытов свидетельствуют о том, что только эндопротезы Унифлекс Ag, Эсфил Ag и «Плазмофильтр» обладают антимикробным действием в отношении следующих тест-штаммов микроорганизмов: S. aureus 25923 АТСС, E. соli 25922 АТСС, Р. vulgaris 4636 АТСС, P. aeruginosa 27853 АТСС, C. аlbicans 2625 NCTC. По отношению к B. subtilis 6633 ATCC биоцидной активностью обладает только эндопротез «Плазмофильтр». При определении микробной обсеменённости наблюдается снижение количества колоний прямо пропорционально срокам эксперимента.
Рецензенты:Иванов А.В., д.м.н., профессор, заведующий кафедрой гистологии, цитологии, эмбриологии, ГБОУ ВПО КГМУ Минздрава России, г. Курск;
Медведева О.А., д.м.н., профессор кафедры микробиологии, вирусологии, иммунологии, ГБОУ ВПО КГМУ Минздрава России, г. Курск.
Работа поступила в редакцию 02.03.2015.



