Впервые термин «нанотехнология» применил Норио Танигучи, инженер из Токийского университета, в 1974 г. в статье, которая посвящалась обработке материалов. Сегодня нанотехнологии являются одной из наиболее интенсивно развивающихся областей науки в самых разных отраслях, в т.ч. в медицине и фармации [2].
Перспективным направлением является модификация нативных ферментов, конструирование и изучение на их основе наноструктур, которые могут быть использованы в различных фармацевтических композициях.
Работы последних лет Н.В. Глазовой, В.Н. Иванова, В.Л. Багировой, М.Д. Дулькис позволили запатентовать фармацевтические композиции на основе наноструктур, включающих ферменты из животного сырья: ДНК-азу и гиалуронидазу [3, 4]. В последние годы широкое применение в системной энзимотерапии находят также ферменты растительного происхождения, промышленное производство которых в нашей стране отсутствует, что диктует необходимость использования дорогостоящей продукции. В данной работе использовали пероксидазу, выделенную из корнеплодов редьки черной (Raphanus sativus).
Целью работы было изучение модификации структуры пероксидазы антибиотиками аминогликозидной природы, с последующим включением полученных комплексов в наноструктуры для использования их в различных фармацевтических композициях.
Материалы и методы исследования
Объектом исследования являлась пероксидаза экстракта редьки черной [5]. Пероксидаза представляет собой гликопротеин, содержащий протогем в качестве простетической группы, а также два иона кальция в структуре. Линейный размер белковой глобулы в растворе составляет 4 нм. Уникальные свойства этого фермента – хорошая растворимость в воде, высокая специфичность по окислителю, устойчивость при хранении, широкий спектр биологической активности, обусловливают ее применение в медицине, науке и технике [1]. Пероксидаза обладает антибактериальными, антиоксидантными и иммуномодулирующими свойствами, которые могут быть расширены (усилены) в комплексе с антибиотиками широкого спектра действия.
В качестве носителей для иммобилизации использовали циклодекстрины производства Xian Hong Chang Parmaceuticals Co., Ltd. Циклодекстрины – цилиндрические молекулы наподобие цилиндра, состоящие из нескольких остатков глюкозы. Их номенклатура отталкивается от количества глюкозидных остатков в цикле, из которых состоит циклодекстрин. Так, α-циклодекстрин состоит из 6 молекул глюкозы, β-циклодекстрин – из семи, а γ-циклодекстрин из восьми. Благодаря своим свойствам циклодекстрины широко применяются в пищевых технологиях, фармацевтике, косметике, биотехнологии, аналитической химии. β-циклодекстрин зарегистрирован в качестве пищевой добавки E459 [6].
В работе использовали гентамицин 80 мг 2 мл N10 ампулы, раствор для внутривенного и внутримышечного введения, производитель Хемофарм.
В работе использовали 10 % инъекционный водный раствор канамицина сульфата, 40 флаконов по 10 мл, производитель ЗАО «МОСАГРОГЕН», Россия.
В работе использовали хлоргексидина биглюконат раствор 0,05 % 100 мл, производитель ООО «Росбио», Россия.
Метод определения ферментативной активности пероксидазы по пирогаллолу основан на измерении количества окисленного в присутствии пероксидазы пирогаллола в пурпурогаллин [7].
Метод количественного определения концентрации гентамицина и канамицина (нингидриновый метод): растворяли около 10 мг ЛС в 1 мл воды; добавляли 1 мл раствора нингидрина (1 г нингидрина в 500 мл н-бутанола с добавлением 0,5 мл пиридина); нагревали на кипящей водяной бане в течение 5 мин.; добавляли 10 мл воды (глубокое пурпурное окрашивание).
Исследование кинетики диффузии через пористые мембраны проводили в двухкамерных ячейках. Камеры разделяли пористой мембраной «Millipore», которую закрепляли между двумя половинами ячейки (диаметр пор мембраны подбирали таким образом, чтобы проходил чистый антибиотик, чистый фермент, но при этом происходило удерживание комплекса и наноструктуры; подобранный диаметр составил 0,22 мкм или 220 нм). Для перемешивания растворов ячейки ставили на шутель. Камеру № 1 заполняли буферным раствором, а камеру № 2 анализируемым раствором. В ходе эксперимента в определённые промежутки времени отбирали пробы из камеры № 1 и определяли концентрацию антибиотика, перешедшего через пористую мембрану за время t (Сt).
Результаты исследований и их обсуждение
Для модификации ферментов и дальнейшего введения их в фармацевтические композиции необходимо подобрать оптимальные соотношения фермент: компонент, так как известно, что ферменты являются лабильными веществами и могут терять активность, как при создании фармацевтических композиций, так и при их хранении. Ввиду того, что в состав большинства фармацевтических композиций вводят антисептические вещества, в данной работе использовали в качестве антисептика хлоргексидина биглюконат. В качестве наноносителя в опытах использовали пероксидазу экстракта редьки черной, к которой присоединяли антибиотики канамицин и гентамицин. По экспериментальным данным строили кривые зависимости А/Аисх = f (антисептик (антибиотик)/фермент, мг/мг), представленные на рис. 1,
где А – активность пероксидазы в пробе, ЕД/мг;
Аисх – активность пероксидазы в исходном растворе, ЕД/мг.
Как видно из данных, представленных на рис. 1, при добавлении антисептика активность пероксидазы увеличивается в 4,4 раза по сравнению с исходной. При добавлении канамицина и гентамицина ее активность увеличивается в 1,3 раза. Растворы фермента с антисептиком и антибиотиками выдерживали в течение 24 часов при температуре 22°C и проверяли активность пероксидазы. Как видно из данных, представленных на рис. 2, уже в первый час эксперимента наблюдали потерю активности пероксидазы в комплексе с антисептиком, что свидетельствовало о нецелесообразности его дальнейшего использования. В комплексе с канамицином активность пероксидазы сохранялась в 1,3 раза выше по сравнению с исходной, в комплексе с гентамицином за 24 часа незначительно снизилась.
Сравнивая полученные данные с изменением активности пероксидазы в течение времени в исходном экстракте редьки черной можно сказать, что при добавлении антибиотиков активность пероксидазы сохраняется на исходном уровне, а без добавления антибиотиков сохраняется лишь 20 % от исходной активности пероксидазы.
Образование комплекса между пероксидазой и аминогликозидными антибиотиками канамицином и гентамицином происходит с большей вероятностью за счёт образования водородных связей между карбонильными группами аминокислот, входящих в активный центр пероксидазы (гистидин, аргинин и фенилаланин), и аминогруппами антибиотиков. Это влечет к изменениям в пространственной структуре пероксидазы и увеличению доступности активного центра для субстратов (перекиси водорода и пирогаллола). Что подтверждается не только сохранением активности пероксидазы на постоянном уровне в присутствии антибиотиков, но и увеличением активности фермента в комплексе с канамицином.
Ввиду уникальных свойств гентамицина: отсутствие выработки резистентности, термостабильность при высоких температурах и широкий спектр действия, его использовали в дальнейшей работе для создания комплекса с пероксидазой.
Для создания фармацевтических композиций на основе комплекса пероксидаза/гентамицин необходимо было провести исследования по влиянию наноносителей на стабильность комплекса. В качестве наноносителей были выбраны циклодекстрины. Растворы комплекса пероксидаза/гентамицин с добавлением циклодекстринов выдерживали в течение трех суток (время, в течение которого устанавливается равновесие в системе циклодекстрин/комплекс). Результаты экспериментальных данных представлены на рис. 3.
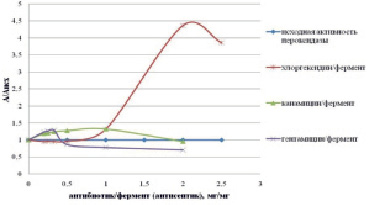
Рис. 1. Влияние антибиотиков гентамицина, канамицина и антисептика хлоргексидина биглюконата на активность пероксидазы в комплексе
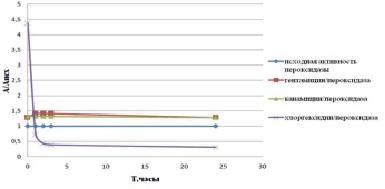
Рис. 2. Изменение активности пероксидазы в комплексе антибиотик (антисептик)/фермент во времени
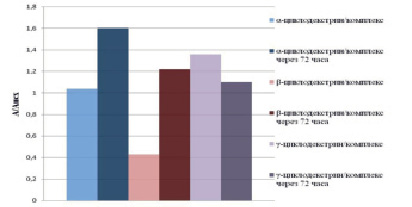
Рис. 3. Влияние циклодекстринов на активность пероксидазы в комплексе с гентамицином при достижении равновесия через 72 часа
Как видно из данных, представленных на рис. 3, через 72 часа активность иммобилизованной пероксидазы устанавливается выше исходной на 10–60 % для всех трех типов циклодекстринов в зависимости от соотношения комплекс: циклодекстрин.
Структуры, состоящие из частиц, размеры которых хотя бы в одном направлении не превышают 100 нм, называют наноструктурами. Ввиду того, что размер пероксидазы составляет 4 нм, размер гентамицина, а размер циклодекстринов не превышает 2 нм, то для обозначения полученного тройного комплекса применим термин наноструктура. Срок наблюдения за стабильностью полученных наноструктур составлял 6 месяцев, в течение которых не отмечалась потеря активности. Это подтверждало целесообразность использования исследуемого нанообъекта в составе различных фармацевтических композиций с последующей перспективой внедрения в промышленное производство.
Показано влияние гентамицина и циклодекстринов на активность пероксидазы. Можно предположить, что это происходит вследствие связывания антибиотика с ферментом и комплекса гентамицин/фермент с циклодекстрином. Чтобы подтвердить это, исследовали кинетику прохождения гентамицина через пористую мембрану в присутствии пероксидазы и циклодекстрина. Используемая в работе методика позволила нам рассчитать по полученным экспериментальным данным количество свободного и связанного гентамицина в наноструктуре по уравнениям:
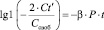 ,
,
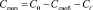 ,
,
где Сt’ – концентрация гентамицина, перешедшего через пористую мембрану за время t = 5 минут, мг/мл; Сt’ = 0,95 (гентамицин + пероксидаза), Сt’ = 0,5 (гентамицин + пероксидаза + циклодекстрин);
С0 – начальная концентрация гентамицина в ячейке в момент времени t, 8 мг/мл;
Ссвоб. – концентрация свободного гентамицина (не связанного в комплекс с пероксидазой), мг/мл;
Ссвяз – концентрация гентамицина, связанного в комплекс с пероксидазой, мг/мл;
β – постоянная ячейки, β = 1;
Р – проницаемость мембраны, Р = 0,015.
Подставляя значения всех переменных, получаем, что Ссвоб = 3,36 мг/мл – концентрация свободного гентамицина, не связанного с пероксидазой и циклодекстрином; Ссвяз = 4,14 мг/мл – концентрация гентамицина, связанного с пероксидазой и циклодекстрином.
Зная общее содержание белка в экстракте (7 мг/мл) и активность пероксидазы в экстракте (1,12 ЕД/мл), можно раcсчитать, сколько миллиграмм антибиотика связывает миллиграмм белка и сколько ЕД пероксидазы связывает миллиграмм антибиотика. Таким образом, эти показатели составляют 0,59 мг антибиотика/мг белка и 0,27 ЕД пероксидазы/мг антибиотика.
Заключение
Развитие фармацевтической и косметической отраслей промышленности требует разработки и внедрения новых эффективных фармацевтических композиций, обладающих высокой конкурентоспособностью на рынке. Так как нативные ферменты быстро теряют свою активность в водных растворах, то их нужно использовать непосредственно после разведения и не оставлять на хранение. Это является большой проблемой при создании новых фармацевтических композиций. Одним из путей решения данной проблемы является создание иммобилизованных форм ферментов. В настоящее время перспективным направлением в медицине и космецевтике является использование иммобилизованных ферментов в составе фармацевтических композиций для терапии различных заболеваний. В данной работе рассмотрены возможные носители для иммобилизации пероксидазы, изучено влияние антисептика хлоргексидина биглюконата, антибиотиков канамицина и гентамицина, и циклодекстринов на активность пероксидазы редьки черной. Показана возможность использования метода кинетики диффузии через пористые мембраны для количественного расчета компонентов наноструктуры. Полученные экспериментальные данные говорят о возможности создания различных фармацевтичеких композиций, содержащих пероксидазу.
Научно-исследовательская работа выполнена при поддержке программы «У.М.Н.И.К.» Фонда содействия развитию малых форм предприятий в научно-технической сфере (Фонд Содействия). Номер Госконтракта: № 10483р/16906 от 08.06.2012. Номер проекта 16936.
Рецензенты:Ураков А.Л., д.м.н., профессор, заведующий кафедрой общей и клинической фармакологии, ГБОУ ВПО «Ижевская государственная медицинская академия», г. Ижевск;
Романов Б.К., д.м.н., профессор, директор Центра экспертизы безопасности лекарственных средств, ФГБУ «НЦЭСМП» Минздрава России, г. Москва.
Работа поступила в редакцию 12.02.2015.



