Поддержание функциональной активности организма на клеточном уровне регулируется сигнальными молекулами, в том числе пептидами, которые позволяют поддерживать равновесие между тремя основными физиологическими процессами – пролиферацией, дифференцировкой и апоптозом клеток. В Санкт-Петербургском институте биорегуляции и геронтологии был синтезирован ряд ди-, три- и тетрапептидов для поддержания функций тканей различного генеза [2, 5]. Эти пептиды способны проникать в ядро и ядрышко клеток [5] и, связываясь с ДНК и гистоновыми белками, регулировать экспрессию генов [3, 6]. Тетрапептид панкраген регулирует пролиферацию, дифференцировку и апоптоз клеток поджелудочной железы, тетрапептид эпиталон – секрецию мелатонина в пинеалоцитах, трипептид Т-36 – дифференцировку Т-лимфоцитов [7]. Кроме того, аминокислоты, входящие в состав пептидов, также обладают регуляторными свойствами в отношении пролиферации и апоптоза клеток [2]. Одной из общебиологических закономерностей эволюции живой материи является то, что по мере усложнения структуры субстрата увеличивается специфичность его действия. В качестве наиболее общего проявления направленности макроэволюции рассматривается повышение уровня организации живых систем, ведущее к интенсификации их функций. Целью настоящей работы явилось скрининговое исследование сравнительного действия ди-, три- и тетрапептидов и аминокислот, входящих в их состав, на развитие органотипических культур тканей животных.
Материалы и методы исследования
Органотипическое культивирование тканей проводили по описанной ранее методике [2]. В экспериментах использовали по 200 эксплантатов каждой из тканей половозрелых самцов крыс линии Вистар: коры и подкорковых структур головного мозга (ткани эктодермального генеза), верхушки сердца, предстательной железы (ткани мезодермального генеза), печени и поджелудочной железы (ткани энтодермального генеза). Препарированные в стерильных условиях фрагменты тканей крыс разделяли на более мелкие части величиной около 1 мм3, которые помещали в чашки Петри с коллагеновым покрытием дна. Питательная среда состояла из 35 % среды Игла, 35 % раствора Хенкса, 25 % фетальной телячьей сыворотки. В среду добавляли глюкозу (0,6 %), инсулин (0,5 ед/мл), гентамицин (100 ед/мл).
В работе использовали пептиды, синтезированные в Санкт-Петербургском институте биорегуляции и геронтологии: кортаген (Ala-Glu-Asp-Pro), эпиталон (Ala-Glu-Asp-Gly), кардиоген (Ala-Glu-Asp-Arg), простамакс (Lys-Glu-Asp-Pro), ливаген (Lys-Glu-Asp-Ala), панкраген (Lys-Glu-Asp-Trp), Т-31 (Ala-Glu-Asp), Т-33 (Glu-Asp-Arg), Т-34 (Glu-Asp-Gly), Т-35 (Glu-Asp-Leu), Т-36 (Glu-Asp-Pro), Т-38 (Lys-Glu-Asp), D1 (Asp-Pro), D2 (Asp-Trp), D3 (Asp-Ala), D4 (Asp-Gly), D5 (Asp-Leu), D6 (Asp-Arg), D8 (Asp-Glu). Кроме того использовали L-аминокислоты, входящие в состав данных пептидов: глицин (Gly), аланин (Ala), лизин (Lys), аргинин (Arg), пролин (Pro), глутаминовую кислоту (Glu), аспарагиновую кислоту (Asp), лейцин (Leu), триптофан (Trp) (фирма «Sigma» США). Культуры каждой ткани разделяли на 2 части – контрольную и экспериментальную – с добавлением одного из исследуемых пептидов либо аминокислот.
Для выявления эффективных концентраций исследуемые препараты вводили в культуральную среду в различных концентрациях – от 10-9 до 10-14 М. Эффективной для всех исследованных аминокислот и пептидов была концентрация 10-12 М. В чашки Петри с экспериментальными эксплантатами добавляли 3 мл питательной среды с исследуемой концентрацией препаратов, в чашки Петри с контрольными эксплантатами – 3 мл питательной среды. Таким образом, эксплантаты экспериментальной и контрольной групп развивались в одинаковых объемах питательной среды. Чашки Петри помещали в термостат при температуре 37 °С в условиях постоянного поступления 5 % СО2 и через 3 сут анализировали под фазово-контрастным микроскопом. Индекс площади (ИП) рассчитывали как отношение площади всего эксплантата (вместе с зоной выселяющихся клеток) к площади центральной зоны эксплантата. Для расчета ИП эксплантатов использовали программу «PhotoM 1.2». Значения ИП выражали в процентах. Величину ИП в контрольных культурах (без добавления исследуемых пептидов и аминокислот) принимали за 100 %. Для прижизненной микроскопии эксплантатов применяли микротеленасадку для микроскопа (серия 10, МТН-13 «Альфа-Телеком», Россия). Гистологическое окрашивание культур тканей гемотоксилин-эозином проводили для визуализаци морфологии клеток.
В специальном эксперименте по изучению специфичности влияния пептидов на процессы клеточного обновления и дифференцировку методом иммуноцитохимии оценивали экспрессию маркерных белков в органотипических культурах тканей поджелудочной железы крыс и во всех исследуемых тканях оценивали уровень апоптоза по экспрессии белка р53. Для пермеабилизации использовали 0,5 % Тритон Х100. P53 – проапоптотический протеин, при активации которого запускается процесс клеточной гибели или происходит временная остановка клеточного цикла. Пролиферативный протеин Ki67 экпрессируется во время всех фаз клеточного цикла, но отсутствует в покоящихся (G0) клетках [8]. FOXA2 является маркером начального этапа дифференцировки клеток поджелудочной железы, а Pax6 – терминальный фактор дифференцировки α-клеток [4]. Иммуноцитохимическое выявление экспрессии этих молекул проводили с использованием первичных моноклональных антител к р53 (1:75, Novocastra), Ki67 (1:60, Novocastra), Pax6 (1:50, Dako), FOXA2 (1:100, Dako). В качестве вторичных антител использовали универсальный набор, содержащий биотинилированные антимышиные и антикроличьи иммуноглобулины. Визуализацию окрасок проводили с применением комплекса авидина с биотинилированной пероксидазой (АВС-kit), с последующим проявлением пероксидазы хрена диаминобензидином (все реагенты от Novocastra). Использовали одноэтапный протокол с демаскировкой антигена (высокотемпературной обработкой ткани) в 0,01 М цитратном буфере рН 7,6. Морфометрическое исследование осуществляли с использованием системы компьютерного анализа микроскопических изображений, состоящей из микроскопа Nikon Eclipse E400, цифровой камеры Nikon DXM1200, персонального компьютера на базе Intel Pentium 4 и программного обеспечения «Videotest-Morphology 5.2». В каждом случае анализировали 10 полей зрения при увеличении х400. Площадь экспрессии маркеров рассчитывали как отношение площади, занимаемой иммунопозитивными клетками, к общей пощади клеток в поле зрения и выражали в процентах. Этот параметр отражает интенсивность синтеза или накопления исследуемой сигнальной молекулы в клетках.
Статистическую обработку данных проводили в программе «Statistica 7.0». Для анализа вида распределения и проверки нулевой гипотезы использовали критерий Шапиро-Уилка. Для оценки однородности выборок были использованы непараметрические процедуры однофакторного дисперсионного анализа (критерий Краскела-Уоллиса). Различия между группами считали статистически значимыми при p < 0,05.
Результаты исследования и их обсуждение
На первые сутки культивирования происходило распластывание эксплантатов на коллагеновой подложке, выселение пролиферирующих и мигрирующих клеток, составляющих зону роста от края эксплантата. При культивировании фрагментов тканей крыс зона роста состояла из мигрирующих специализированных клеток, а также из фибробластоподобных элементов. За счет этих клеток и формировалась периферическая зона роста эксплантатов, при измерении которой определяли ИП. Через 3 сут, если в эксперименте имела место стимуляция развития зоны роста, ИП экспериментальных эксплантатов увеличивался по сравнению с ИП контрольных эксплантатов. В случаях угнетения развития зоны роста ИП эксплантатов понижался по сравнению с контрольными значениями.
В табл. 1 показаны результаты действия 6 тетрапептидов, 6 трипептидов, 7 дипептидов и 9 аминокислот на эксплантаты 6 различных тканей. Из них тетрапептиды проявляли достоверную стимулирующую или угнетающую пролиферацию активность в 8 случаях, трипептиды проявляли активность в 13 случаях, дипептиды в 18, а аминокислоты в 27 случаях. По данным иммуноцитохимического исследования, во всех случаях стимуляция пролиферации сопровождалась уменьшением экспрессии проапоптотического протеина р53, повышением экспрессии пролиферотропного маркера Ki67 и увеличением экспрессии специфических маркеров дифференцировки тканей. При этом снижение апоптоза клеток в органотипических культурах различных тканей под действием коротких пептидов и аминокислот в целом подчинялось закономерностям, характерным для увеличения ИП. Так, все тетрапептиды специфично снижали уровень экспрессии р53 в одной ткани (табл. 2).
Три- и дипептиды изменяли уровень апоптоза уже в 1–3 тканях, а амонокислоты – в 4 тканях (табл. 2). Вероятно, прослеживая эту тенденцию для большего числа иммуноцитохимических маркеров, различных для разных тканей, мы наблюдали бы такую же тенденцию. Приведем пример более детального иммуноцитохимического исследования культуры ткани поджелудочной железы при действии коротких пептидов.Так, в культурах клеток поджелудочной железы при введении в среду панкрагена увеличение ИП коррелировало со снижением экспрессии p53, увеличением ИП и повышением экспрессии сигнальных молекул Ki67, FOXA2 и Pax6 (рисунок).
При анализе частоты влияния пептидов и аминокислот в тканях различного генеза выявлено строго специфичное действие тетрапептидов только на ткани соответствующих им органов. Результаты проведенного исследования свидетельствуют о том, что тетрапептиды, синтезированные из наиболее часто встречающихся в данной ткани аминокислот, обладают выраженной специфичностью в отношении соответствующих тканей крыс. В эксплантатах каждого типа ткани наблюдался эффект воздействия соответствующего этой ткани тетрапептида. Так, при добавлении кардиогена в культуральную среду только ИП эксплантатов миокарда крыс увеличивался на 37 ± 5 % (n = 23, р < 0,05), по сравнению с контрольными эксплантатами (n = 22). Тетрапептид кортаген увеличивал ИП только эксплантатов коры головного мозга на 22 ± 4 % (n = 20, р < 0,05), по сравнению с контрольными эксплантатами (n = 21). Тетрапептид эпиталон увеличивал значения ИП эксплантатов подкорковых структур головного мозга на 24 ± 3 % (n = 20, р < 0,05) по сравнению с контрольными эксплантатами (n = 22).
Воздействие тетрапептида простамакса выражалось в увеличении ИП эксплантатов предстательной железы на 25 ± 4 % и в уменьшении ИП эксплантатов подкорковых структур головного мозга на 28 ± 3 % (n = 23, р < 0,05). Стимуляция зоны роста эксплантатов печени на 19 ± 3 % наблюдалась только при действии ливагена, а увеличение ИП эксплантатов поджелудочной железы на 18 ± 3 % – только при введении панкрагена. Меньшей специфичностью действия обладали трипептиды. Лишь один из них, Т-35, был активен в отношении только одной ткани печени, когда ИП эксплантатов увеличивался на 21 ± 3 % (n = 22, р < 0,05), по сравнению с контрольными эксплантатами (n = 23). Остальные трипептиды вызывали изменение клеточной пролиферации в двух типах тканей и более. Так, каждый из трипептидов Т-31, Т-33, Т-34 и Т-36 вызывал изменение пролиферации клеток в эксплантатах двух различных тканей.
Трипептид Т-38 был активен в отношении 4 из 6 исследованных тканей. В большинстве случаев трипептиды стимулировали клеточную пролиферацию, а угнетающее влияние отмечалось только в эксплантатах миокарда под влиянием двух трипептидов Т-33 и Т-38. Еще меньшей специфичностью действия обладали дипептиды. Только один из них, D6, увеличивал ИП эксплантатов предстательной железы. Пептиды D3 и D8 действовали каждый на 2 ткани. Дипептид D3 увеличивал ИП эксплантатов предстательной железы на каждый на 32 ± 5 % (n = 21, р < 0,05), по сравнению с контрольными эксплантатами (n = 23), и угнетал развитие эксплантатов миокарда на 27 ± 4 % (n = 24, р < 0,05), по сравнению с контрольными эксплантатами (n = 22). Дипептиды D2 и D5 стимулировали пролиферацию в 3 тканях, а дипептид D4 – в 4 тканях. Совершенно другие явления обнаруживались при изучении влияния на тканевые эксплантаты тех аминокислот, которые входили в состав исследованных коротких пептидов. Ни одна из аминокислот не обладала стимулирующей или ингибирующей пролиферацию активностью только в отношении одной ткани, как это наблюдалось при действии тетрапептидов. Аминокислоты триптофан и лейцин были активны каждая в эксплантатах из 2 тканей. Так, лейцин статистически достоверно стимулировал зону роста эксплантатов коры головного мозга 22 ± 4 % (n = 22, р < 0,05), по сравнению с контрольными эксплантатами (n = 20), и стимулировал развитие эксплантатов поджелудочной железы на 33 ± 6 % (n = 21, р < 0,05), по сравнению с контрольными эксплантатами (n = 22).
Таблица 1
Влияние коротких пептидов и аминокислот на индекс площади эксплантатов тканей различного генеза
|
Исследуемое вещество |
Изменение индекса площади, % |
|||||
|
Эктодермальные ткани |
Мезодермальные ткани |
Энтодермальные ткани |
||||
|
Кора головного мозга |
Подкорковые структуры головного мозга |
Миокард |
Предстательная железа |
Печень |
Поджелудочная железа |
|
|
Тетрапептиды |
||||||
|
Кортаген |
+ 22 ± 4 * |
– |
– |
– |
– |
– |
|
Эпиталон |
– |
+ 24 ± 3* |
– |
– |
– |
– |
|
Кардиоген |
– |
– |
+ 37 ± 5* |
– |
– |
– 32 ± 5* |
|
Простамакс |
– |
– 28±5 * |
– |
+ 25 ± 4* |
– |
– |
|
Ливаген |
– |
– |
– |
– |
+ 19 ± 3* |
– |
|
Панкраген |
– |
– |
– |
– |
– |
+ 18 ± 3* |
|
Трипептиды |
||||||
|
Пептид Т-31 |
– |
+ 20 ± 2* |
+ 17 ± 2 |
– |
– |
– |
|
Пептид Т-33 |
+ 18 ± 3* |
– |
– 15 ± 2* |
– |
– |
– |
|
Пептид Т-34 |
– |
+ 21 ± 2* |
– |
– |
– |
+ 20 ± 3* |
|
Пептид Т-35 |
– |
– |
– |
– |
+ 21 ± 3* |
– |
|
Пептид Т-36 |
+ 21 ± 4* |
– |
– |
+ 24 ± 3* |
– |
– |
|
Пептид Т-38 |
– |
+ 16 ± 2 |
– 24 ± 3* |
+ 27 ± 4* |
+ 20 ± 3* |
– |
|
Дипептиды |
||||||
|
Пептид D1 |
– |
– |
– |
+34 ± 4* |
– |
– 17 ± 2* |
|
Пептид D2 |
– 17 ± 2* |
– |
– 20 ± 3* |
+45 ± 5* |
– |
– |
|
Пептид D3 |
– |
– |
– 27 ± 4* |
+32 ± 5* |
– |
– |
|
Пептид D4 |
– |
+37 ± 4* |
– 27 ± 3* |
+32 ± 7* |
– 17 ± 3* |
– |
|
Пептид D5 |
– |
– |
– 60 ± 8* |
+27 ± 5* |
+28 ± 4* |
– |
|
Пептид D6 |
– |
– |
– |
+78 ± 9* |
– |
– |
|
Пептид D8 |
– |
– |
– 31 ± 3* |
+35 ± 4* |
– |
– |
|
Аминокислоты |
||||||
|
Glu |
– |
+37 ± 6 * |
+39 ± 6 * |
+18 ± 2* |
+21 ± 3 * |
– |
|
Asp |
+28 ± 5 * |
+32 ± 5 * |
– |
– 25 ± 4 * |
+33 ± 5 * |
|
|
Lys |
– |
+18 ± 2* |
+46 ± 6* |
– |
+19 ± 2* |
– |
|
Arg |
– |
+24 ± 4 * |
+29 ± 5 * |
+26 ± 4 * |
+22 ± 3 * |
– |
|
Gly |
– 19 ± 3 * |
– |
– 21 ± 3 * |
– 17 ± 2 |
– |
|
|
Pro |
– 21 ± 3 * |
– 28 ± 4 * |
– |
+25 ± 4 * |
– 19 ± 3 * |
+19 ± 3 * |
|
Leu |
+22 ± 4 * |
– |
– |
– |
– |
+33 ± 6 * |
|
Trp |
– |
+35 ± 6 * |
– |
– |
– 31 ± 6 * |
– |
|
Ala |
– |
– |
– |
– |
– |
– |
Примечание. «–» – исследуемое вещество не оказывало достоверного влияния на индекс площади, *р < 0,05 по сравнению с индексом площади в контроле.
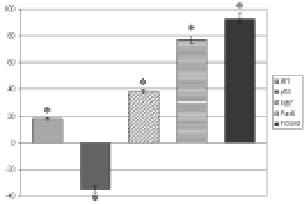
Изменение индекса площади и площади экспрессии сигнальных молекул в эксплантатах поджелудочной железы крыс под действием панкрагена по отношению к контролю. По оси ординат – изменение ИП и площади экспрессии молекул-маркеров в процентах по отношению к контролю (нулевая линия). Примечание.* – p < 0,05 по сравнению с соответствующим показателем в контроле
Таблица 2
Влияние коротких пептидов и аминокислот на площадь экспрессии проапоптотического белка р53 в эксплантатах тканей различного генеза
|
Исследуемое вещество |
Площадь экспрессии р53, % |
|||||
|
Эктодермальные ткани |
Мезодермальные ткани |
Энтодермальные ткани |
||||
|
Кора головного мозга |
Подкорковые структуры головного мозга |
Миокард |
Предстательная железа |
Печень |
Поджелудочная железа |
|
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
Тетрапептиды |
||||||
|
Контроль |
0,47 ± 0,05 |
0,63 ± 0,04 |
0,54 ± 0,04 |
0,73 ± 0,06 |
0,43 ± 0,04 |
0,56 ± 0,04 |
|
Кортаген |
0,18 ± 0,03* |
0,60 ± 0,05 |
0,51 ± 0,05 |
0,65 ± 0,05 |
0,39 ± 0,03 |
0,48 ± 0,04 |
|
Эпиталон |
0,45 ± 0,04 |
0,12 ± 0,02* |
0,48 ± 0,06 |
0,73 ± 0,06 |
0,41 ± 0,05 |
0,49 ± 0,05 |
|
Кардиоген |
0,48 ± 0,05 |
0,63 ± 0,05 |
0,10 ± 0,02* |
0,68 ± 0,05 |
0,44 ± 0,05 |
0,44 ± 0,05 |
|
Простамакс |
0,40 ± 0,03 |
0,66 ± 0,04 |
0,52 ± 0,06 |
0,19 ± 0,03* |
0,42 ± 0,02 |
0,47 ± 0,03 |
|
Ливаген |
0,51 ± 0,06 |
0,55 ± 0,05 |
0,50 ± 0,04 |
0,77 ± 0,06 |
0,15 ± 0,03* |
0,54 ± 0,05 |
|
Панкраген |
0,44 ± 0,04 |
0,61 ± 0,03 |
0,50 ± 0,05 |
0,71 ± 0,05 |
0,44 ± 0,05 |
0,12 ± 0,03* |
|
Трипептиды |
||||||
|
Контроль |
0,47 ± 0,05 |
0,63 ± 0,04 |
0,54 ± 0,04 |
0,73 ± 0,06 |
0,43 ± 0,04 |
0,56 ± 0,04 |
|
Пептид Т-31 |
0,45 ± 0,06 |
0,39 ± 0,04* |
0,63 ± 0,04* |
0,70 ± 0,04 |
0,40 ± 0,05 |
0,49 ± 0,06 |
|
Пептид Т-33 |
0,30 ± 0,05* |
0,60 ± 0,04 |
0,50 ± 0,04 |
0,72 ± 0,05 |
0,41 ± 0,04 |
0,53 ± 0,05 |
|
Пептид Т-34 |
0,46 ± 0,04 |
0,40 ± 0,03* |
0,49 ± 0,03 |
0,70 ± 0,06 |
0,38 ± 0,06 |
0,20 ± 0,03* |
|
Пептид Т-35 |
0,49 ± 0,05 |
0,59 ± 0,05 |
0,51 ± 0,04 |
0,69 ± 0,05 |
0,28 ± 0,0* |
0,51 ± 0,05 |
|
Пептид Т-36 |
0,40 ± 0,06 |
0,57 ± 0,04 |
0,52 ± 0,02 |
0,58 ± 0,04* |
0,44 ± 0,04 |
0,50 ± 0,04 |
|
Пептид Т-38 |
0,41 ± 0,04 |
0,37 ± 0,04* |
0,30 ± 0,03* |
0,60 ± 0,04* |
0,42 ± 0,04 |
0,49 ± 0,05 |
|
Дипептиды |
||||||
|
Контроль |
0,47 ± 0,05 |
0,63 ± 0,04 |
0,54 ± 0,04 |
0,73 ± 0,06 |
0,43 ± 0,04 |
0,56 ± 0,04 |
|
Пептид D1 |
0,49 ± 0,05 |
0,60 ± 0,05 |
0,53 ± 0,05 |
0,57 ± 0,03* |
0,45 ± 0,06 |
0,70 ± 0,04* |
|
Окончание табл. 2 |
||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
Пептид D2 |
0,40 ± 0,06 |
0,58 ± 0,06 |
0,67 ± 0,06* |
0,71 ± 0,05 |
0,40 ± 0,04 |
0,50 ± 0,05 |
|
Пептид D3 |
0,42 ± 0,05 |
0,56 ± 0,09 |
0,71 ± 0,04* |
0,51 ± 0,04* |
0,42 ± 0,05 |
0,51 ± 0,08 |
|
Пептид D4 |
0,44 ± 0,05 |
0,50 ± 0,03* |
0,50 ± 0,06 |
0,55 ± 0,06* |
0,66 ± 0,04* |
0,53 ± 0,06 |
|
Пептид D5 |
0,39 ± 0,06 |
0,60 ± 0,04 |
0,50 ± 0,06 |
0,70 ± 0,04 |
0,18 ± 0,03* |
0,55 ± 0,04 |
|
Пептид D6 |
0,46 ± 0,05 |
0,67 ± 0,06 |
0,50 ± 0,06 |
0,22 ± 0,02* |
0,41 ± 0,02 |
0,48 ± 0,07 |
|
Пептид D8 |
0,44 ± 0,05 |
0,61 ± 0,04 |
0,51 ± 0,05 |
0,43 ± 0,06* |
0,37 ± 0,05 |
0,51 ± 0,05 |
|
Аминокислоты |
||||||
|
Контроль |
0,47 ± 0,05 |
0,63 ± 0,04 |
0,54 ± 0,04 |
0,73 ± 0,06 |
0,43 ± 0,04 |
0,56 ± 0,04 |
|
Glu |
0,45 ± 0,05 |
0,43 ± 0,04* |
0,44 ± 0,11 |
0,37 ± 0,04* |
0,21 ± 0,03* |
0,51 ± 0,05 |
|
Asp |
0,23 ± 0,03* |
0,48 ± 0,02* |
0,50 ± 0,09 |
0,68 ± 0,07 |
0,79 ± 0,08* |
0,32 ± 0,04* |
|
Lys |
0,40 ± 0,04 |
0,44 ± 0,05* |
0,31 ± 0,04* |
0,69 ± 0,05 |
0,40 ± 0,05 |
0,54 ± 0,03 |
|
Arg |
0,41 ± 0,05 |
0,33 ± 0,04* |
0,27 ± 0,04* |
0,43 ± 0,05* |
0,17 ± 0,02* |
0,59 ± 0,06 |
|
Gly |
0,49 ± 0,05 |
0,59 ± 0,07 |
0,52 ± 0,08 |
0,68 ± 0,06 |
0,47 ± 0,10 |
0,56 ± 0,05 |
|
Pro |
0,52 ± 0,06 |
0,69 ± 0,04 |
0,54 ± 0,04 |
0,71 ± 0,04 |
0,45 ± 0,05 |
0,42 ± 0,02* |
|
Leu |
0,20 ± 0,03* |
0,65 ± 0,08 |
0,51 ± 0,05 |
0,66 ± 0,12 |
0,43 ± 0,05 |
0,29 ± 0,04* |
|
Trp |
0,42 ± 0,06 |
0,29 ± 0,03* |
0,49 ± 0,06 |
0,70 ± 0,04 |
0,71 ± 0,06* |
0,51 ± 0,05 |
|
Ala |
0,43 ± 0,05 |
0,60 ± 0,04 |
0,51 ± 0,05 |
0,72 ± 0,06 |
0,42 ± 0,04 |
0,52 ± 0,04 |
Примечание. *р < 0,05 по сравнению с соответствующим показателем в контроле.
Глицин и лизин были активны уже в отношении 3 тканей – глицин в отношении коры головного мозга, предстательной железы и печени, а лизин – подкорковых структур головного мозга, миокарда и печени. На изменения ИП в 4 тканях влияли глутаминовая, аспарагиновая кислоты аргинин. В наибольшем числе тканей – в 5 – был активен пролин. Только аланин не вызывал изменений клеточной активности ни в одной из тканей. Таким образом, имеющийся в организме пул свободных аминокислот может одновременно оказывать влияние на пролиферацию и апоптоз в самых различных тканях и органах. Аминокислоты с заряженным боковым радикалом (глутаминовая и аспарагиновая кислота с отрицательно заряженным, лизин и аргинин – с положительно заряженным) наиболее часто встречаются в составе пептидов и белков. Они же в изолированном виде стимулируют клеточные процессы в наибольшем количестве тканей. На основании полученных результатов можно заключить, что при исследовании активности коротких пептидов и составляющих их аминокислот, ни одно из веществ не демонстрировало ту специфичность, которой обладали в культуре ткани тетрапептиды. У ди- и трипептидов не наблюдалось какой-либо закономерности при воздействии на ткани различного генеза или отдельные ткани. И только тетрапептиды проявляли четкое тканеспецифическое влияние на пролиферативные процессы в соответствующих им тканях.
Ди- и трипептиды занимали промежуточное положение между аминокислотами и тетрапептидами в отношении активного воздействия на процессы клеточной пролиферации и апоптоза, причем у трипептидов наблюдалась более выраженная специфичность действия. Вероятно, специфичность действия этих биологически активных веществ на процессы клеточного обновления усиливается по мере усложнения их структуры, т.е. увеличения количества пептидных связей. Это положение совпадает с концепцией основного направления эволюционного развития, заключающегося в том, что при усложнении структуры происходит все более дифференцированное и специфическое развитие функций [10]. Например, основное направление эволюции находит отражение в таксономической структуре известковых губок. Усложнение строения губок заключается в превращении наиболее простого, асконоидного типа ирригационной системы в гетероцельный. Процесс прогрессивного эволюционного преобразования наблюдается во множестве видов живых организмов. Особенно четко это проявляется в филогенезе всех нервных систем, когда при развитии головного мозга, его различных отделов, включая кору головного мозга у высших животных, на фоне общего увеличения числа нейронов и их синаптических связей происходила четкая специализация функций коры и подкорковых структур головного мозга [9]. Аминокислотное регулирование, возможно, было характерно для начального периода развития простейших. Оно сохранилось в значительной степени у прокариот. Так, на различных видах бактерий показано регулирующее влияние различных аминокислот на их размножение [2]. Выявление высокой тканеспецифичности тетрапептидов, по сравнению с ди-, трипептидами и составляющими их аминокислотами, подтверждает представления о повышении уровня специализации функций по мере усложнения структурной организации живой материи.
Рецензенты:Медведев Д.С., д.м.н, доцент, заведующий кафедрой геронтологии и гериатрии ЧОУ ВПО «Санкт-Петербургский медико-социальный институт», г. Санкт-Петербург;
Вахитов Т.Я., д.б.н., начальник лаборатории прикладной микробиологии ФГУП «Государственный научно-исследовательский институт особо чистых препаратов» ФМБА России, г. Санкт-Петербург.
Работа поступила в редакцию 12.02.2015.



