Доброкачественная гиперплазия предстательной железы (ДГПЖ) является наиболее распространенным заболеванием у мужчин пожилого и старческого возраста [22]. С возрастом имеет место нарастание распространённости ДГПЖ, которая достигает 90 % у мужчин старше 80 лет [21].
До трети пациентов с ДГПЖ страдают декомпенсацией функции детрузора с развитием хронической задержки мочи, двустороннего уретерогидронефроза и хронической почечной недостаточности [7].
В патогенезе этих осложнений инфравезикальная обструкция играет лишь инициальную роль, приводя в конечном итоге к нарушению гемодинамики мочевого пузыря и почек и закономерно развивающейся вслед за ней тканевой гипоксии [9]. Гипоксия детрузора при ДГПЖ является не только следствием относительной недостаточности кровообращения в гипертрофированной стенке мочевого пузыря и сдавления аденоматозными узлами нижнепузырных артерий, но и следствием возрастного атеросклеротического поражения артерий («сенильный детрузор») [18]. ДГПЖ приводит к развитию инфравезикальной обструкции, что приводит к развитию повышенного детрузорного давления и снижению оттока мочи из почек и возникновению пузырно-мочеточниковых и почечных рефлюксов [26]. Эти явления запускают ишемические процессы в почечной ткани, которые являются важным патогенетическим звеном в развитии воспаления и ХПН [3].
Парадоксальная ишурия, дилатация верхних мочевых путей развитием хронической почечной недостаточности является одним из абсолютных показаний к оперативному лечению ДГПЖ [29]. Однако у данной категории пациентов в качестве первого этапа оперативного лечения выполняется цистостомия [2]. Подобная тактика позволяет восстановить уродинамику мочевых путей, приводя таким образом к стойкой нормализации органной гемодинамики, инициирует начало процесса инволюции ранее возникших структурных изменений ткани мочевого пузыря и почек, приводит к восстановлению сократительной способности мочевого пузыря и азотовыделительной функции почек [8]. Однако полноценность подобной «обратимости» определяется фактором времени и степенью «запущенности» склеротических изменений в данных органах [19].
Среди инфекционных осложнений ДГПЖ 3 стадии (классификация Guyon 1881) хронический простатит диагностируется в 37,5 % случаев, хронический пиелонефрит в стадии ремиссии с развитием почечной недостаточности – в 69 %, хронический цистит и уретрит – в 30,3 %, острый и хронический эпидидимит выявляется у 1,7 % больных [7]. В настоящее время, несмотря на важную роль инфекционного фактора, существенное значение в возникновении и развитии хронического воспалительного процесса в органах мочеполовой системы придается расстройствам кровообращения, возникающим на фоне длительно существующей инфравезикальной обструкции [13].
Инфекционно-воспалительные процессы, осложняющие течение ДГПЖ наряду с морфофункциональными изменениями мочевого пузыря и почек, возникающими на фоне их циркуляторной гипоксии, являются одной из причин неудовлетворительных результатов и осложнений радикального хирургического лечения ДГПЖ, выполненного у пациентов с эпицистостомой, наложенной по поводу хронической задержки мочи [6, 30]. Кроме того, бактериурия, имеющаяся у больных с цистостомическим дренажом, увеличивает риск послеоперационных осложнений в 2,5 раза [17].
Сегодня ТУРП – «золотой стандарт» хирургического лечения аденомы простаты при её объеме 30–80 см3 [29]. Однако сама по себе ТУР ДГПЖ является стрессовой ситуацией, вызывая значительные изменения микроциркуляции в почках и приводя к функциональному подавлению интенсивности перфузии. Данные нарушения сохраняются и на 8-е сутки после операции [14]. Это обстоятельство вносит дополнительный вклад в возникновение инфекционно-воспалительных осложнений и функциональных нарушений со стороны почек в послеоперационном периоде после ТУРП.
Острая и хроническая задержка мочи в послеоперационном периоде встречается у 3–9 % пациентов, перенесших ТУР ДГПЖ, при этом данные осложнения связаны не с неполноценностью резекции, а с дисфункцией детрузора, имевшейся до операции [25, 31]. Обострение хронического пиелонефрита отмечено у 7,2 % пациентов после аденомэктомии [4]. Азотемия наблюдается у 15–30 % больных, перенесших радикальное оперативное вмешательство по поводу ДГПЖ [16]. Кроме того, остаточная симптоматика после ТУР ДГПЖ наблюдается у 5–35 % пациентов [1, 18].
При гистологическом исследовании стенки мочевого пузыря на фоне ИВО, вызванной ДГПЖ, обнаруживаются изменения в виде нарушения кровообращения (выраженный склероз и гиалиноз артерий и артериол, гиперемия венозной сосудистой системы), атрофия, гипертонус миоцитов мышечной оболочки, склеротические изменения всех оболочек органа. Кроме того, морфологически выявляются признаки хронического воспаления в виде отека собственной пластинки и подслизистой основы и наличия в них диффузно-очаговой лимфо-гистоцитарной инфильтрации, а также выраженный отек и паретическое расширение сосудов с их полнокровием [10].
Ишемическая и инфекционная природа повреждений мочевого пузыря и почек и связанные с этим неудовлетворительные результаты радикального хирургического лечения ДГПЖ, осложненной хронической задержкой мочи, ХПН и азотемией, диктуют необходимость применения на этапах оперативного лечения ДГПЖ, наряду с эпицистостомией, средств, улучшающих органный кровоток и оксигенацию тканей, а также обладающих иммунной активностью. В этой связи патогенетически обоснованным может быть применение метода гипербарической оксигенации, заключающегося во вдыхании 100 % кислорода под давлением, превышающим 1 абсолютную атмосферу. Благодаря гипербаротерапии происходит повышение растворимости, а следовательно, и парциального давление кислорода в крови и периферических тканях. Растворенный в плазме кислород за счет диффузии из капиллярного русла попадает в межклеточную жидкость, а затем и в клетки, улучшая клеточную оксигенацию. Адекватная оксигенация обеспечивает получение митохондриями эффективной продукции аденозинтрифосфорной кислоты (АТФ), а также других компонентов, необходимых для клеточного функционирования [11, 24]. Кислород под повышенным давлением оказывает бактерицидное (в отношении анаэробов) и бактериостатическое (в отношении некоторых видов аэробных микроорганизмов) действие, а также стимулирует систему антиоксидантной защиты организма [9]. Кроме того, гипербарическая оксигенация (ГБО) обладает иммунокорригирующим эффектом, который выражается в нормализации показателей клеточного иммунитета, снижении уровня провоспалительных цитокинов, IgE, а также в увеличении концентрации сывороточного IgA [5].
Таким образом, можно предположить, что использование ГБО в комплексном лечении пациентов, которым выполнена цистостомия в качестве первого этапа оперативного лечения ДГПЖ, будет положительно влиять на гемодинамику детрузора и почек, улучшит результаты радикального хирургического лечения ДГПЖ и снизит вероятность инфекционно-воспалительных осложнений послеоперационного периода.
Материалы и методы исследования
В исследование вошли 69 пациентов в возрасте от 59 до 80 лет (средний возраст 69,86 ± 6,1 года) с установленным диагнозом ДГПЖ, осложненной хронической задержкой мочи и признаками хронической почечной недостаточности, находящиеся на лечении в 1-м урологическом отделении ГБКУЗ ЯО МСЧ ОАО «Автодизель» г. Ярославля в период с 2008 по 2013. Объем простаты варьировал от 38,8 до 76,4 см³ (в среднем 57 ± 5,7 см³). Объем остаточной мочи в среднем составил – 498,5 ± 97,4 см³. Уровень мочевины крови составлял в среднем 16,89 ± 3,07 ммоль/л, креатинина крови – 192,96 ± 36,03 мкмоль/л, СКФ составляла в среднем 35 ± 4,8 мл/мин.
В качестве первого этапа лечения ДГПЖ всем пациентам была выполнена эпицистостомия. В дальнейшем пациенты были разделены на две группы. Группу контроля (n = 36) составили пациенты, получавшие после цистостомии стандартную антибактериальную терапию, средства для коррекции метаболического ацидоза и альфа-адреноблокаторы (тамсулозин). В группу исследования (n = 33) вошли пациенты, получавшие с первых суток после наложения цистостомы помимо стандартной терапии 10 сеансов ГБО с экспозицией 45 мин, под давлением 1,5 АТА в камере БЛКС-301М. В дальнейшем пациентам обеих групп выполнена плановая ТУРП в сроки от 30 до 35 дней после наложения эпицистостомы. В послеоперационном периоде после ТУР ДГПЖ пациенты обеих групп получали стандартную терапию в виде альфа-адреноблокаторов (тамсулозин), гемостатической и антибактериальной терапии. Уретральный катетер удаляли на 3-и сутки после трансуретральной резекции простаты.
Объем остаточной мочи оценивался у всех пациентов до выполнения цистостомии, а также на 7-е и 15-е сутки после выполнения трансуретральной резекции простаты.
Уровень мочевины и скорость клубочковой фильтрации определялись до наложения цистостомического дренажа, а также на 3-и, 7-е, и 10-е сутки после цистостомии и на 1-е, 3-и и 7-е сутки после ТУР ДГПЖ.
У 20 больных исследуемой группы и 19 больных контрольной проводилась ультразвуковая допплерография сосудов стенки мочевого пузыря трансректальным датчиком и почек и использованием трансабдоминального датчика. Исследования производились на аппарате Toshiba Xario SSA-660A до наложения цистостомы, а также на 3-и и 10-е сутки после операции. При этом изучались такие показатели, как максимальная систолическая скорость кровотока Vmax, конечная диастолическая скорость кровотока Vmin, индекс резистентности RI и индекс васкуляризации VI. Так как в литературе отсутствуют данные о нормативных показателях кровотока в стенке мочевого пузыря и почках у данной группы пациентов, нами выполнено исследование аналогичных параметров в группе сравнения, состоящей из 10 человек в возрасте от 65 до 74 лет, у которых по данным обследования не было выявлено патологии мочеполовой системы.
С целью субъективной оценки симптоматики всеми пациентами в послеоперационном периоде после ТУРП заполнялся модифицированный опросник IPSS и QoL [15] на 7-е и 15-е сутки после ТУРП.
В обеих группах производилась сравнительная оценка ранних послеоперационных осложнений после выполнения трансуретральной резекции предстательной железы.
Всем пациентам выполнялась урофлоуметрия на 7-е и 15-е сутки после восстановления самостоятельного мочеиспускания, при этом оценивали максимальную объемную скорость потока мочи (Qmax).
С целью изучения иммунного ответа на предложенный способ лечения определяли уровни ФНО-α, IL-1β, IL-8 у 15 пациентов в каждой группе до дренирования мочевого пузыря, на 3-е и 10-е сутки после цистостомии.
У 20 пациентов во время выполнения цистостомии выполняли забор фрагментов стенки мочевого пузыря. В дальнейшем во время выполнения ТУР простаты осуществлялся повторный забор стенки мочевого пузыря путем электрорезекции. При этом 10 пациентов входили в исследуемую группу и 10 пациентов в контрольную. Полученный материал окрашивали гематоксилином и эозином, по Массону и по Харту и оценивали морфологические изменения в данных образцах.
Результаты исследования и их обсуждение
Сравнение результатов исследования, произведенных до наложения цистостомы не показало статистически значимых различий в обеих группах (p > 0,05).
При исследовании объема остаточной мочи (табл. 1) отмечено достоверное (p > 0,05) уменьшение количества остаточной мочи на 7-е сутки после ТУР ДГПЖ до 121,4 ± 36,2 мл и 88,2 ± 27,7 мл в контрольной и исследуемой группах соответственно. На 15-е сутки после ТУРП количество остаточной мочи равнялось 89,1 ± 24,4 мл в контрольной группе и 45,7 ± 12,2 мл в исследуемой группе. Таким образом, снижение количества остаточной мочи после выполнения ТУРП в исследуемой группе более выражено.
Таблица 1
Количество остаточной мочи в контрольной и исследуемой группах (мл)
|
Объем остаточной мочи, мл |
До выполнения цистостомии* |
На 7-е сутки после ТУРП** |
На 15-е сутки после ТУРП** |
|
Исследуемая группа |
502,2 ± 100,6 |
88,2 ± 27,7 |
45,7 ± 12,2 |
|
Контрольная группа |
493,7 ± 92,9 |
121,4 ± 36,2 |
89,1 ± 24,4 |
Примечания:
*до выполнения цистостомии исследуемая группа/контрольная группа р > 0,05;
** после ТУРП исследуемая группа/контрольная группа р < 0,05.
Уровень остаточного азота в крови достоверно (p > 0,05) снизился в обеих группах после выполнения цистостомии. Уровень мочевины крови в контрольной группе на 3-и сутки после цистостомии составлял 14,67 ± 4,02 ммоль/л, на 7-е – 13,8 ± 3,13 ммоль/л, на 10-е – 11,1 ± 2,24 ммоль/л. Этот же показатель в исследуемой группе составлял 13,6 ± 2,89л, 9,6 ± 2,89 и 7,2 ± 1,32 ммоль/л на 3-и, 7-е и 10-е сутки соответственно.
После ТУРП уровень мочевины крови в исследуемой группе составил 10,4 ± 1,47 ммоль/л на 1-е сутки, 8,6 ± 2,12 ммоль/л на 3-и сутки и 7,9 ± 1,56 ммоль/л на 7-е сутки после операции. В контрольной группе данный показатель после выполнения ТУР ДГПЖ составлял 11,2 ± 3,43, 10,0 ± 1,98 и 9,1 ± 2,07 ммоль/л на 1-е, 3-и и 7-е сутки соответственно. Данные об уровне остаточного азота крови в обеих группах представлены в табл. 2.
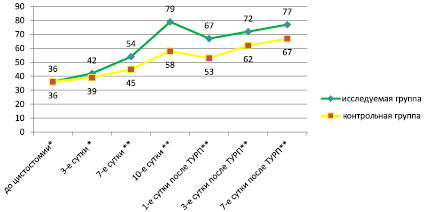
Скорость клубочковой фильтрации достоверно не различалась (p < 0,05) в обеих группах до операции. После наложения цистостомы СКФ в контрольной группе составила 39 ± 4,45 мл/с на 3-и сутки, 45 ± 6,89 мл/с на 7-е сутки и 58 ± 4,89 мл/с на 10-е сутки после цистостомии. В исследуемой группе скорость СКФ на 3-и, 7-е и 10-е сутки после цистостомии составила 42 ± 3,94, 54 ± 5,52 и 79 ± 4,32 мл/с соответственно. После выполнения ТУР ДГПЖ скорость клубочковой фильтрации в исследуемой группе составила 67 ± 5,22 мл/мин на 1-е сутки, 72 ± 4,45 мл/мин на 3-и сутки и 77 ± 6,02 мл/мин на 7-е сутки. В контрольной группе уровень СКФ составлял 53 ± 3,65 мл/мин на 1-е сутки, 62 ± 4,67 мл/мин на 3-и сутки и 67 ± 5,89 мл/мин на 7-е сутки после выполнения операции. Данные о скорости клубочковой фильтрации представлены в табл. 3.
Таким образом, после наложения цистостомы в группе пациентов, где применялось ГБО, снижение уровня остаточного азота происходило в более короткие сроки, а нормализация уровня мочевины и креатинина наблюдалась к 10-м суткам. Кроме того, в группе ГБО имел место более выраженный рост скорости клубочковой фильтрации. После выполнения ТУРП функция почек снижалась в обеих группах, но в исследуемой группе данные изменения были менее выражены, а нормализация показателей наблюдалась уже к 3-м суткам после операции.
Таблица 2
Динамика показателей остаточного азота после наложения цистостомы и после ТУРП в исследуемой и контрольной группах
|
Уровень мочевины крови |
Контрольная группа, ммоль/л |
Исследуемая группа, ммоль/л |
|
До цистостомии* |
16,89 ± 3,07 |
17,05 ± 3,16 |
|
На 3-е сутки после* цистостостомии |
14,67 ± 4,02 |
13,6 ± 2,89 |
|
На 7-е сутки после цистостомии** |
13,8 ± 3,13 |
9,6 ± 2,89 |
|
На 10-е сутки после цистостомии** |
11,1 ± 2,24 |
7,2 ± 1,32 |
|
1-е сутки после ТУРП* |
11,2 ± 3,43 |
10,4 ± 1,47 |
|
3-и сутки после ТУРП** |
10,0 ± 1,98 |
8,6 ± 2,12 |
|
7-е сутки после ТУРП** |
9,1 ± 2,07 |
7,9 ± 1,56 |
Примечания:
* исследуемая группа/контрольная группа, р > 0,05;
** исследуемая группа/контрольная группа, р < 0,05.
Таблица 3
Скорость клубочковой фильтрации в основной и контрольной группах
Примечания:
*исследуемая группа/контрольная группа р > 0,05;
** исследуемая группа/контрольная группа р < 0,05.
По данным допплерографии сосудов шейки мочевого пузыря до выполнения цистостомии Vmax в среднем у пациентов контрольной и исследуемой групп составляла 10,26 ± 2,12 см/с, Vmin – 1,85 ± 0,85 см/с, RI – 0,82 ± 0,02, VI – 9,09 ± 1,59. В группе сравнения, состоящей из здоровых добровольцев, имелись следующие показатели кровотока: Vmax – 6,98 ± 1,34, Vmin – 2,65 ± 1,32, RI – 0,69 ± 0,05, VI – 12,97 ± 1,18.
Таким образом, видно, что индекс резистентности значительно выше у пациентов с ДГПЖ 3 стадии, по сравнению со здоровыми мужчинами, а индекс васкуляризации, наоборот, выше у мужчин без урологической патологии. На 3-и сутки после цистостомии показатели кровотока составили в контрольной группе: – Vmax – 10,84 ± 1,17, Vmin – 1,88 ± 0,71, RI – 0,84 ± 0,02, VI – 0,84 ± 0,02; в исследуемой группе данные показатели имели следующие значения: Vmax – 9,65 ± 2,01, Vmin – 1,96 ± 0,68, RI – 0,74 ± 0,02, VI – 10,45 ± 1,34. На 10-е сутки после цистостомии: в контрольной группе – Vmax – 11,86 ± 2,13, Vmin – 1,90 ± 0,78, RI – 0,084 ± 0,02, VI – 10,69 ± 1,23; в исследуемой – Vmax – 8,12 ± 1,74, Vmin – 2,27 ± 0,93, RI – 0,72 ± 0,03, VI – 11,53 ± 1,67.
При анализе результатов допплерографии сосудов шейки мочевого пузыря после наложения цистостомы на 3-и и 10-е сутки отмечено достоверное снижение систолической скорости кровотока и снижение индекса резистентности в обеих группах, причем на фоне проводимой терапии в основной группе эти изменения более значимы, чем изменения аналогичных показателей в контрольной группе (табл. 4).
При сравнительном анализе показателей гемодинамики в почках до цистостомии (табл. 5) отмечено повышение индекса резистентности и снижение индекса васкуляризации в контрольной и исследуемой группах пациентов по сравнению с группой здоровых добровольцев. Это говорит о нарушении гемодинамики в почках на фоне ретенции верхних мочевых путей, вызванных ИВО.
Допплерографические показатели кровотока в артериях почек на 3-и и 10-е сутки после выполнения цистостомии показаны в табл. 6.
Из представленных данных можно сделать вывод о том, что после наложения цистостомического дренажа отмечается снижение показателя IR и увеличение показателя VI у пациентов обеих групп, что говорит об улучшении кровоснабжения органа. Однако в исследуемой группе изменения IR и PI носят более выраженный характер и достигают нормальных значений.
Таблица 4
Динамика показателей кровотока по данным допплерографии сосудов мочевого пузыря в исследуемой и контрольной группах
|
Показатель |
До цистостомии* |
3-и сутки после цистостомии** |
10-е сутки после цистостомии** |
Группа сравнения |
|||
|
Исследуемая группа |
Контрольная группа |
Исследуемая группа |
Контрольная группа |
Исследуемая группа |
Контрольная группа |
||
|
Систолическая скорость кровотока. см/с |
10,24 ± 2,17 |
10,21 ± 2,26 |
9,65 ± 2,01 |
10,84 ± 1,17 |
8,12 ± 1,74 |
11,86 ± 2,13 |
6,98 ± 1,34 |
|
Диастолическая скорость кровотока, см/с |
1,83 ± 0,87 |
1,86 ± 0,84 |
1,96 ± 0,68 |
1,88 ± 0,71 |
2,27 ± 0,93 |
1,90 ± 0,78 |
2,65 ± 1,32 |
|
Индекс резистентности |
0,80 ± 0,02 |
0,84 ± 0,03 |
0,74 ± 0,02 |
0,84 ± 0,02 |
0,72 ± 0,03 |
0,84 ± 0,02 |
0,69 ± 0,05 |
|
Индекс васкуляризации |
9,17 ± 1,52 |
9,06 ± 1,57 |
10,45 ± 1,34 |
9,66 ± 1,19 |
11,53 ± 1,67 |
10,69 ± 1,23 |
12,97 ± 1,18 |
Примечания:
* ‒ до цистостомии исследуемая группа/контрольная группа, р > 0,05;
** ‒ после цистостомии исследуемая группа/контрольная группа, р < 0,05
Таблица 5
Показатели кровотока по данным допплерографии сосудов почек в группе здоровых мужчин и исследуемой и контрольной группах до цистостомии
|
Уровень снятия спектра |
V max, мм/с |
V min, мм/с |
RI, мм/с |
VI, мм/с |
|
|
Почечные артерии |
Исследуемая группа |
61,4 ± 0,22 |
29,4 ± 0,86 |
0,72 ± 0,03 |
0,92 ± 0,03 |
|
Контрольная группа |
60,9 ± 0,23 |
29,3 ± 0,79 |
0,73 ± 0,03 |
0,93 ± 0,02 |
|
|
Группа сравнения |
55,7 ± 0,18 |
29,1 ± 0,77 |
0,58 ± 0,02* |
1,13 ± 0,04 |
|
|
Сегментарные артерии |
Исследуемая группа |
54,1 ± 1,01 |
26,7 ± 0,37 |
0,85 ± 0,01 |
1,01 ± 0,02 |
|
Контрольная группа |
53,9 ± 0,92 |
26,5 ± 0,32 |
0,86 ± 0,02 |
1,02 ± 0,03 |
|
|
Группа сравнения |
47,8 ± 0,88 |
23,9 ± 0,23 |
0,59 ± 0,02* |
1,32 ± 0,05* |
|
|
Артерии паренхимы |
Исследуемая группа |
33,1 ± 0,67 |
13,4 ± 0,36 |
0,91 ± 0,14 |
1,17 ± 0,03 |
|
Контрольная группа |
33,0 ± 0,59 |
13,2 ± 0,35 |
0,92 ± 0,12 |
1,16 ± 0,04 |
|
|
Группа сравнения |
31,7 ± 0,48 |
12,5 ± 0,26 |
0,55 ± 0,09* |
1,43 ± 0,06* |
|
Примечание. * ‒ различия достоверны по отношению к исследуемой и контрольной группам (р < 0,05).
Таблица 6
Динамика показателей кровотока по данным допплерографии сосудов почек в исследуемой и контрольной группах
|
Уровень снятия спектра |
V max, мм/с |
V min, мм/с |
RI, мм/с |
VI, мм/с |
|||||
|
3-и сутки |
10-е сутки |
3-и сутки |
10-е сутки |
3-и сутки |
10-е сутки |
3-и сутки |
10-е сутки |
||
|
Почечные артерии |
Исследуемая группа |
60,1 ± 0,18 |
58,7 ± 0,17 |
29,3 ± 0,85 |
29,1 ± 0,77 |
0,7 ± 0,03 |
0,62 ± 0,02 |
1,0 ± 0,04 |
1,1 ± 0,02 |
|
Контрольная группа |
60,0 ± 0,21 |
59,3 ± 0,19 |
29,2 ± 0,78 |
29,1 ± 0,78 |
0,71 ± 0,03 |
0,69 ± 0,04 |
0,96 ± 0,03 |
1,04 ± 0,02 |
|
|
Сегментарные артерии |
Исследуемая группа |
52,9 ± 0,97 |
49,1 ± 0,62 |
24,7 ± 0,36 |
24,5 ± 0,37 |
0,8 ± 0,01 |
0,64 ± 0,02 |
1,18 ± 0,03 |
1,3 ± 0,02 |
|
Контрольная группа |
51,8 ± 0,86 |
51,0 ± 0,75 |
25,2 ± 0,30 |
25,0 ± 0,27 |
0,82 ± 0,02 |
0,75 ± 0,03* |
1,13 ± 0,04 |
1,21 ± 0,05* |
|
|
Артерии паренхимы |
Исследуемая группа |
32,2 ± 0,61 |
32,1 ± 0,58 |
13,3 ± 0,34 |
13,2 ± 0,32 |
0,82 ± 0,11 |
0,60 ± 0,05 |
1,31 ± 0,05 |
1,42 ± 0,02 |
|
Контрольная группа |
32,7 ± 0,65 |
32,7 ± 0,59 |
13,0 ± 0,37 |
12,9 ± 0,41 |
0,87 ± 0,10 |
0,72 ± 0,08* |
1,22 ± 0,03 |
1,34 ± 0,02* |
|
Примечание. * – исследуемая группа/контрольная группа, р < 0,05.
При анкетировании по шкале IPSS/QoL после восстановления самостоятельного мочеиспускания отмечено достоверное снижение количества баллов по шкале IPSS в обеих группах. В исследуемой группе до выполнения цистостомии средний балл по шкале IPSS составлял 28 ± 2, на 7 сутки после ТУРП 19,30 ± 1,2, а на 15 сутки снизился до 12,6 ± 1,4. В контрольной группе показатели IPSS, полученные в аналогичные временные периоды, составили 27,4 ± 2,1, 21,30 ± 1,2, 15,8 ± 2,42 соответственно. Показатель QoL за аналогичный промежуток времени снизился в основной группе с 4,2 ± 0,71 до 2,25 ± 0,31 (P < 0,05), в контрольной – с 4,18 ± 0,35 до 3,2 ± 0,6 (P < 0,05). В обоих случаях различия показателей между группами на 14-е сутки были достоверными (P < 0,05).
Среди ранних послеоперационных осложнений после ТУРП в контрольной группе у 2 пациентов (6,9 %) отмечалось обострение хронического пиелонефрита, острый эпидидимоорхит имел место у 1 пациента (3,4 %). У 1 пациента сохранялся длительно не заживающий цистостомический свищ. В исследуемой группе не отмечено инфекционно-воспалительных осложнений в раннем послеоперационном периоде. Данные о структуре и количестве послеоперационных осложнениях инфекционно-воспалительного характера приведены ниже (табл. 7).
По данным урофлоуметрии максимальная объемная скорость мочеиспускания на 7-е сутки после ТУРП составляла 11,2 ± 2,56 мл/с в контрольной группе и 14,3 ± 2,12 мл/с в исследуемой группе. На 15-е сутки после ТУР ДГПЖ Q max равнялось 13,96 ± 2,25 и 17,51 ± 1,83 мл/с в контрольной и исследуемой группе соответственно.
При анализе уровня цитокинов отмечено, что у пациентов с ДГПЖ до цистостомии отмечается повышение уровня провоспалительных цитокинов, что обусловлено длительно текущим инфекционно-воспалительным процессом в органах мочеполовой системы. После цистостомии отмечается снижение уровня ФНО-α, IL-1β, IL-8, однако у пациентов, получающих ГБО данные изменения наступают быстрее. При этом уровень IL-8 достигает к 10-м суткам нормальных значений в исследуемой группе. Данные об уровнях цитокинов представлены в табл. 8.
При морфологическом исследовании в мочевом пузыре пациентов с ДГПЖ, осложненной хронической задержкой мочи, выявлялись признаки тяжелого хронического цистита в стадии обострения. Об этом свидетельствовало резкое набухание слизистой оболочки данного органа, дистрофия и десквамация ее эпителия с образованием различных по глубине и площади эрозивных дефектов (рис. 1).
Таблица 7
Структура послеоперационных осложнений после ТУРП
|
Контрольная группа |
Исследуемая группа |
|
|
Обострение хронического пиелонефрита |
2 (6,9 %) |
0 (0 %) |
|
Острый эпидидимоорхит |
1 (3,4 %) |
0 (0 %) |
|
Длительное незаживление цистостомического свища |
1 (3,4 %) |
0 (0 %) |
Таблица 8
Уровень цитокинов крови до цистостомии, на 3-е и 10-е сутки после ТУРП
|
ФНО-α (пг/мл) |
IL-8 (пг/мл) |
IL-1β (пг/мл) |
||||
|
Контрольная группа |
Исследуемая группа |
Контрольная группа |
Исследуемая группа |
Контрольная группа |
Исследуемая группа |
|
|
До цистостомии |
11,8 ± 4,9 |
11,9 ± 5,1 |
178,9 ± 36,9 |
181 ± 30,4 |
42,9 ± 7,8 |
43,2 ± 8,1 |
|
3-е сутки |
19,9 ± 3,3 |
11,4 ± 2,9 |
123,5 ± 27,2 |
92,6 ± 18,4* |
34,8 ± 6,6 |
20,6 ± 4,4 |
|
10-е сутки |
18,2 ± 3,6 |
10,7 ± 2,2* |
100,4 ± 22,6 |
62 ± 12,2* |
27,6 ± 5,7 |
7,8 ± 2,1* |
Примечание. * ‒ исследуемая группа/контрольная группа р < 0,05.


а б
Рис. 1. Состояние слизистой оболочки мочевого пузыря: а – отек слизистой с набуханием ее клеток и разрыхлением эпителиального слоя. Окраска гематоксилином и эозином. х200; б – десквамация эпителия поверхностных отделов слизистой. Окраска по Массону. х400
а б
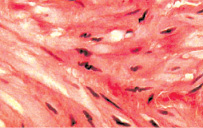
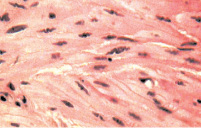
Рис. 2. Состояние мышечной оболочки мочевого пузыря: а – гипертрофия и повышение тонуса гладкомышечных клеток с изменением формы их ядер с вытянутой эллипсовидной на волнистую. Окраска гематоксилином и эозином. х400; б – грубый склероз мышечной оболочки. Окраска по Массону. х400
а б
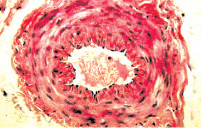
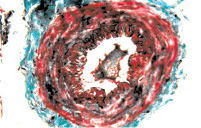
Рис. 3. Состояние артерий мышечной оболочки мочевого пузыря: а – гипертонус артерии среднего калибра. Окраска гематоксилином и эозином. х200; б – гипертонус и склероз стенки артерии среднего калибра. Окраска по Массону. х200
Стенка мочевого пузыря характеризовалась отеком и гиперемией сосудов микроциркуляции. Последнее сопровождалось геморрагиями и воспалительной инфильтрацией ткани, уровень которой был особенно интенсивным в собственном слое слизистой и подслизистой оболочке и менее выраженным в мышечном слое пузырной стенки. Гладкие миоциты мышечной оболочки мочевого пузыря представлялись гипертрофированными и находились в состоянии резко выраженного тонического сокращения (рис. 2). В артериях, питающих данный орган, также отмечались признаки гипертонуса с сужением просвета и избыточной складчатостью интимы. Кроме того, стенки этих сосудов были в той или иной мере склерозированы, а иногда подвержены фибриноидным изменениям (рис. 3). Важным признаком, характеризующим состояние стенки мочевого пузыря больных этой группы, был склероз, который распространялся на все оболочки органа.
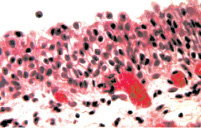
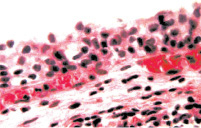
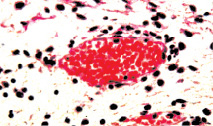
Результатом установки больным цистостомы и проведения курса антибиотикотерапии являлось снижение набухания слизистой их мочевого пузыря. Дистрофические изменения эпителиоцитов этой оболочки становились менее выраженными. Десквамация этих клеток носила поверхностный характер, а микроэрозии встречались редко. Падал и уровень отека собственного слоя слизистой и подслизистой оболочки мочевого пузыря (рис. 4). Сосуды микроциркуляторного русла этой области становились менее полнокровными. Снижалась их проницаемость и интенсивность лейкодиапедеза, что сопровождалось уменьшением проявлений клеточной инфильтрации подслизистой оболочки; в мышечном слое мочевого пузыря ее вообще не было (рис. 5). Отмеченное выше свидетельствует о подавлении антибиотиками остроты цистита и снижении морфологических проявлений хронизации воспалительного процесса. Лечение антибиотиками существенно не сказывалось на состоянии тонуса лейомиоцитов мышечной оболочки мочевого пузыря, а также тонуса артерий этого органа. Поэтому просвет данных сосудов оставался суженным, а их стенка представлялась утолщенной (рис. 6). В некоторых артериях обнаруживались тромбы в различной стадии организации. Значимого влияния лечение антибиотиками не оказывало и на уровень склероза стенки мочевого пузыря и стенок его сосудистых ветвей.
а б
Рис. 4. Состояние слизистой оболочки мочевого пузыря. Окраска гематоксилином и эозином: а – умеренно выраженные набухание слизистой и дистрофия ее клеток. х200; б – десквамация эпителиоцитов поверхностных отделов слизистой. х200
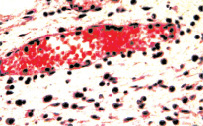
а б
Рис. 5. Состояние сосудистого русла собственного слоя слизистой и подслизистой оболочки мочевого пузыря. Окраска гематоксилином и эозином: а, б – умеренный отек и полнокровие собственного слоя слизистой и подслизистой оболочки. Отсутствие лейкостазов в сосудах микроциркуляции. Слабовыраженная воспалительная инфильтрация ткани с исчезновением нейтрофильных лейкоцитов из инфильтрата х400
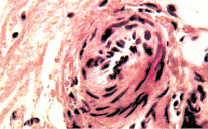
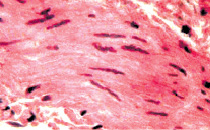
а б
Рис. 6. Состояние сосудов подслизистой оболочки и гладких миоцитов мочевого пузыря: а – гипертонус и умеренно выраженный склероз стенки артерии. Окраска гематоксилином и эозином. х400; б – гипертрофия миоцитов и повышенный тонус этих клеток с деформацией их ядер. х400
После проведения больным лечения антибиотиками с использованием гипербарической оксигенации слизистая оболочка их мочевого пузыря полностью регенерировала. Эпителиальная выстилка ее приобретала обычную толщину и по структурным особенностям не отличалась от таковой у здорового человека (рис. 7). Практически восстанавливался также собственный слой слизистой и подслизистая оболочка: кровенаполнение сосудов микроциркуляции этой зоны приближалось к норме, очаги незначительной инфильтрации мононуклеарами встречались редко, т.е. признаки хронического цистита под влиянием проводимой комбинированной терапии сходили на нет (рис. 8). Важным результатом подобного лечения было также и снижение тонуса гладких миоцитов мышечной оболочки мочевого пузыря и артерий этого органа. Просвет данных сосудов расширялся, что обеспечивало увеличение притока оксигенированной крови к различным структурам пузырной стенки (рис. 9). Возможно, с этим связано некоторое снижение уровня ее склеротических изменений.
У пациентов с ДГПЖ, сопровождающейся ретенцией верхних мочевых путей, отмечаются расстройства микроциркуляции органов мочевыделительной системы. Нарушение гемодинамики неизбежно приводит к гипоксии ткани шейки мочевого пузыря и почек, что подтверждается данными резкого снижения сатурации кислорода при ишемии ткани [12]. Данное состояние значительно ухудшают результаты оперативного лечения ДГПЖ у данных пациентов, так как приводит к серьезным морфологическим перестройкам в органах мочеполовой системы и является серьезным фактором, обуславливающим воспаление в органах мочеполовой системы.
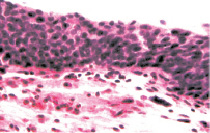
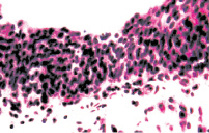
а б
Рис. 7. Состояние слизистой оболочки мочевого пузыря. Окраска гематоксилином и эозином: а, б – компактный эпителиальный пласт обычной толщины без признаков дистрофии и десквамации эпителиоцитов. х200
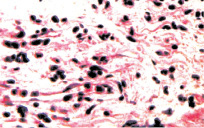
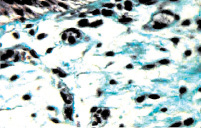
а б
Рис. 8. Состояние собственного слоя слизистой и подслизистой оболочки мочевого пузыря: а – некоторый отек и умеренно выраженная инфильтрация ткани мононуклеарными лейкоцитами. Окраска гематоксилином и эозином. х200; б – умеренно выраженные склеротические изменения. Окраска по Массону. х200
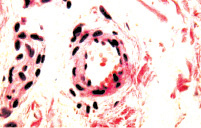
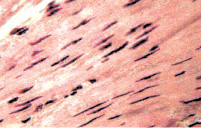
а б
Рис. 9. Состояние сосудов подслизистой оболочки мочевого пузыря и мышечной оболочки мочевого пузыря: а – широкий просвет, тонкая стенка артерий, уплощенные эндотелиоциты их интимы. Окраска гематоксилином и эозином. х400; б – обычный размер лейомиоцитов и состояние их тонуса. Ядра клеток имеют веретенообразную форму и лишены изгибов. х200
С другой стороны, наличие хронических воспалительных процессов в органах мочеполовой системы, ассоциированных с ДГПЖ, является фактором развития инфекции органов мочевыделительной системы в послеоперационном периоде после ТУРП. Имеющийся у пациентов цистостомический дренаж еще больше увеличивает процент встречаемости бактериурии у пациентов с аденомой простаты и тем самым приводит к увеличению процента осложнений радикального оперативного лечения у данных пациентов.
ГБО характеризуется комплексным воздействием: устраняет практически любую форму гипоксии, создает определенный резерв кислорода в тканях и обеспечивает метаболические потребности организма при снижении объемной скорости кровотока. Кроме того, ГБО нормализует состояние системы гемостаза и деятельность нервной системы. Кислород под повышенным давлением оказывает бактерицидное (в отношении анаэробов) и бактериостатическое (в отношении некоторых видов аэробных микроорганизмов) действие, а также стимулирует систему антиоксидантной защиты организма [9, 28]. ГБО оказывает также противовоспалительное действие – снимает отек, способствуя тем самым полноценной регенерации тканей. ГБО влияет на высвобождение ряда цитокинов и факторов роста, важных для заживления ран. Исследования показали различные эффекты ГБО на продукцию цитокинов. У пациентов с болезнью Крона, HBO2 уменьшает уровни IL-1, IL-6 и TNF-альфа [32]. VEGF усиливает свою активность при гипероксии вызванной ГБО [20]. Показано что in vitro ГБО временно подавляет провоспалительную продукцию цитокинов в полученных из крови моноцитах и макрофагах [23]. Кроме того, было обнаружено, что ГБО была сравнима с кортикостероидами при снижении воспаления [27].
Применение ГБО позволяет улучшить гемодинамику детрузора и почек, приводя к «обратному развитию» возникших в них структурных нарушений, что позволяет в более короткие сроки снизить уровень остаточного азота крови, добиться улучшения функции детрузора, выражающееся в снижении количества остаточной мочи и ирритативной симптоматики после выполнения ТУРП, а также нормализовать уровень провоспалительных цитокинов и скорректировать системный ответ на операционную травму. Все это позволяет уменьшить количество осложнений после выполнения трансуретральной резекции предстательной железы.
Выводы
Применение гипербарической оксигенации после дренирования мочевого пузыря цистостомией у пациентов с хронической задержкой мочи на фоне ДГПЖ позволяет в более короткие сроки восстановить гемодинамику и уродинамику нижних мочевых путей, улучшить гемоциркуляцию и функциональное состояние почек, ускорить нормализацию иммунного статуса пациентов, а также снизить вероятность возникновения послеоперационных осложнений радикального хирургического лечения. Кроме того, предложенный способ приводит к более ранней и полной обратимости морфологических изменений мочевого пузыря, вызванных длительной инфравезикальной обструкцией.
Рецензенты:Куликов С.В., д.м.н., доцент кафедры патологической анатомии, ГБОУ ВПО «ЯГМУ» Минздрава России, г. Ярославль;
Любошевский П.А., д.м.н., заведующий кафедрой анестезиологии и реаниматологии с курсом ИПДО, ГБОУ ВПО «ЯГМУ» Минздрава России, г. Ярославль.
Работа поступила в редакцию 12.02.2015.



