Доказанными и модифицируемыми факторами риска инсульта остаются артериальная гипертензия, курение, сахарный диабет, дислипидемия, фибрилляция предсердий, стеноз каротидных артерий, ожирение, малоподвижный образ жизни и ряд других [2, 8]. Однако генетические ассоциативные исследования и анализ генов-кандидатов выявили ряд генетических маркеров, предрасполагающих к развитию ишемической болезни сердца и церебральному инсульту. Несомненно, что комбинация результатов генетического тестирования с традиционными факторами позволяет повысить предсказательную способность оценки риска сердечно-сосудистых событий [8]. Однако данные о генетическом полиморфизме, полученные от разных этнических или территориальных групп весьма противоречивы.
Цель работы – описать частоты генотипов и аллелей полиморфизма генов потенциальных предикторов цереброваскулярных заболеваний: AGT-521С > T (rs4762), AGT-704T > C (rs699), AGTR1-1166A > C (rs5186), GpIa-807С > Т (rs1126643), GpIIIa-1565Т > С (rs5918), GpIβα-434C > T (rs2243093), P2RY12-H1 > H2 (С139Т,T74С,G52Т,ins801) (rs482), SELP-1087G > A (rs6131), SELE-128Ser > Pro (rs5361), SELE-554Leu > Phe (rs5355), MTHFR-677C > T (rs1801133), MTHFR-1298A > C (rs1801131), MTR-2756A > G (rs1805087), MTRR-66A > G (rs1801394), PON1-78A > G (rs662), ApoC3-3238C > G (rs5128), ApoE-3100Т > С (rs769452), CNTF-103G > A (rs55890), BDNF-196G > A (rs6265) у больных ишемическим инсультом, а также у резидентов популяции Забайкальского края, не имеющих признаков цереброваскулярной патологии.
Материалы и методы исследования
Методом сплошной выборки в процесс исследования были включены 250 больных атеротромботическим и лакунарным ишемическим инсультом в возрасте 60,2 ± 9,5 лет (123 женщины, 127 мужчин). В большинстве случаев (98,2 %) диагноз инфаркт мозга был подтверждён нейровизуализационными методами (преимущественно КТ). В контрольную группу методом сплошной выборки были включены 211 неродственных человек 51,5 ± 13,7 лет (119 женщин и 92 мужчины), проживающих в Чите и не имеющих объективных признаков цереброваскулярной патологии.
Для выявления генетического полиморфизма использовалась полимеразная цепная реакция с детекцией продукта амплификации в агарозном геле (PCR-EPh) либо в режиме реального времени (PCR-Rt) (амплификаторы «MAXYGENE», Германия; «ДТ-96», Россия) на геномной ДНК лейкоцитов периферической крови (ДНК-экспресс кровь, НПФ «Литех», Москва) с использованием комплекта реагентов «КардиоГенетика тромбофилия» (ООО «ДНК-Технология», Москва) и отдельных SNP-наборов, соответствующих заявленному полиморфизму (НПФ «Литех», Москва, ООО «ДНК-Технология», Москва).
Для оценки соответствия частот генотипов ожидаемым значениям при равновесии Харди ‒ Вайнберга (HWE) и для сравнения распределения частот генотипов и аллелей в двух группах наблюдения использовали критерий χ2. Об ассоциации аллелей или генотипов с предрасположенностью к изучаемой патологии судили по величине относительного риска заболевания (RR) и отношения шансов (OR) с указанием 95 %-го доверительного интервала (95 % CI:). Для выявления зависимости между развитием заболевания и носительством изучаемого полиморфизма использовался метод бинарной логистической регрессии с представлением χ2 Вальда. Значения уровня p < 0,05 рассматривались как статистически значимые. Статистическая обработка данных проводилась с использованием программного пакета Statistica 6.1 (StatSoft, USA).
Проведение исследования одобрено локальным этическим комитетом ГБОУ ВПО ЧГМА, протокол № 2 от 06.11.2009 г., все респонденты подписывали информированное согласие на участие в исследование в соответствии с Хельсинкской декларацией Всемирной медицинской ассоциации (Сеул, октябрь 2008).
Результаты исследования и их обсуждение
В результате молекулярно-генетического исследования были определены все аллели и генотипы выбранного полиморфизма генов, частоты которых не отклонялись от равновесия Харди ‒ Вайнберга (HWE, p > 0,05) как в группе больных инсультом, так и у здоровых исследуемых. При сравнительном анализе частот аллелей и генотипов каждого из SNP между клинической и контрольной группами для AGT-521С > T, AGT-704T > C, AGTR1-1166A > C, GpIa-807С > Т, GpIIIa-1565Т > С, GpIβα-434C > T, P2RY12-H1 > H2 (С139Т,T74С,G52Т,ins801), SELE-554Leu > Phe, MTHFR-677C > T, MTHFR-1298A > C, MTR-2756A > G, MTRR-66A > G, PON1-78A > G, ApoE-3100Т > С, BDNF-196G > A значимых различий выявлено не было, однако почти каждый из полиморфных маркеров у больных ОНМК имел относительное частотное преимущество мутантного аллеля и (или) имеющего этот аллель генотипа (табл. 1). Значимое различие частот показали: полиморфизм генов молекул адгезии SELP-1087G > A, SELE-128Ser > Pro, аполипопротеина С3 ApoC3-3238C > G и цилиарного нейротрофического фактора CNTF-103G > A.
Участие данного полиморфизма в патогенезе ишемического инсульта можно предположить через измененный эффект кодируемых этими генами белков. Так, Р-селектин тромбоцитов важнейший белковый комплекс, опосредующий адгезию пластинок к моноцитам, нейтрофилам и лимфоцитам и активирующий интергрины, необходимые для прочной адгезии тромбоцитов [1]. Е-селектины также способны вступать во взаимодействие с лейкоцитами, обеспечивая им миграцию, в частности, в зону воспаления. Повышенная экспрессия этих молекул отмечается в атеросклеротических бляшках, и это позволяет предполагать роль селектинов в развитии атеросклероза и коронарных заболеваний сердца [9]. Известно, что полиморфизм P-селектина (thr715pro), как и полиморфизм Е-селектина (ser128arg) ассоциированы с увеличенным риском преждевременных коронарных заболеваний сердца [9]. Кроме этого, гомозиготный вариант SELE-128Ser > Pro 4-кратно увеличивает риск развития рецидивирующего тромбоэмболизма [7], а у больных ишемическим инсультом после поправки на другие факторы риска (например, гипертония, диабет, курение табака, потребление алкоголя), он дает риск развития инсульта в 2,73 раза [4]. Mehran Haidari и соавторы (2009) назвали SELE-128Ser > Pro и SELE-554Leu > Phe независимыми факторами риска инфаркта мозга, которые при сочетании минорных аллелей давали сильнейшую восприимчивость к инсульту OR = 5,89 [8].
Учитывая, что в исследовании участвовали пациенты преимущественно с атеротромботическим вариантом инфаркта мозга и, опираясь на вышеописанные данные, можно предположить, как косвенное участие данного полиморфизма в развитии инсульта путем инициации и прогрессии атерогенеза, так и их прямой эффект. Ведь SELP-1087G > A, SELE-128Ser > Pro вызывают преждевременную и стойкую экспрессию одноименных молекул, что, несомненно, сказывается на функции тромбоцитов, усиливая их адгезивные свойства и стимулируя сосудисто-тромбоцитарный гемостаз.
Таблица 1
Частота аллелей и генотипов изучаемого полиморфизма у больных ишемическим инсультом и в контрольной группе
|
Полиморфизм |
SNP-ID |
Аллель |
Частота аллеля, Р |
χ2, (p) df* = 1 |
ОR* (95 % CI) |
Генотип |
Частота генотипа, % |
χ2, (p) df* = 2 |
ОR* (95 % CI) |
||
|
КГ |
ОНМК |
КГ |
ОНМК |
||||||||
|
AGT Thr174Met |
rs4762 |
–521C –521T |
0,9 0,1 |
0,89 0,11 |
0,53, (0,47) |
0,85 (0,35–1,31) 1,17 (0,86–1,81) |
–521CC –521CT –521TT |
82,1 16,4 1,5 |
78,8 20 1,2 |
1,0, (0,61) |
0,81 (0,51–1,3) 1,27 (0,78–2,07) 0,8 (0,16– 4,02) |
|
AGT Met235Thr |
rs699 |
–704T –704C |
0,57 0,43 |
0,44 0,56 |
0,03; (0,85) |
0,98 (0,75–1,27) 1,03 (0,78–1,34) |
–704TT –704TC –704CC |
34 45,5 20,5 |
21,2 46 32,8 |
0,08; (0,96) |
1,0 (0,63–1,58) 0,95 (0,66–1,39) 1,06 (0,71–1,58) |
|
AGTR1 |
rs5186 |
–1166A –1166C |
0,76 0,24 |
0,8 0,2 |
2,83; (0,09) |
1,31 (0,96–1,80) 0,76 (0,55–1,05) |
–1166AA –1166AC –1166CC |
58,5 34,5 7,0 |
66,4 28 5,6 |
2,97; (0,23) |
1,4 (0,95– 2,06) 0,74 (0,49–1,1) 0,79 (0,37–1,69) |
|
GpIa (ITGA2) Phe224Phe |
rs1126643 |
–807C –807T |
0,69 0,31 |
0,64 0,36 |
2,48 (0,12) |
0,8 (0,60–1,06) 1,25 (0,95–1,66) |
–807CC –807CT –807TT |
51,5 35 13,5 |
44,4 39,2 16,4 |
2,32; (0,31) |
0,75 (0,52–1,09) 1,2 (0,81–1,76) 1,26 (0,74–2,13) |
|
GpIIIa (ITGB3) Leu33Pro |
rs5918 |
–1565T –1565C |
0,88 0,12 |
0,87 0,13 |
0,13; (0,72) |
0,93 (0,62–1,38) 1,08 (0,72–1,6) |
–1565TT –1565TC –1565CC |
79,6 16,4 4 |
77,2 19,6 3,2 |
0,89; (0,64) |
0,87 (0,55–1,36) 1,24 (0,76–2,02) 0,8 (0,29 – 2,16) |
|
GpIβα (GpIβ-IX-V) Trp145Met |
rs2243093 |
–434C –434T |
0,89 0,11 |
0,87 0,13 |
0,08; (0,78) |
0,95 (0,64–1,41) 1,06 (0,71–1,57) |
–434CC –434CT –434TT |
78,1 21,4 0,5 |
76 22,4 1,6 |
1,27; (0,53) |
0,99 (0,64–1,54) 0,95 (0,61–1,47) 3,25 (0,36–29,33) |
|
P2RY12 С139Т, T74С, G52Т, ins801 |
rs482 |
гаплотип H1 гаплотип H2 |
0,85 0,15 |
0,82 0,18 |
1,92; (0,17) |
0,78 (0,55–1,11) 1,29 (0,9–1,83) |
H1/H1 H1/H2 H2/H2 |
74,1 21,9 4,0 |
68,8 25,6 5,6 |
1,68; (90,43) |
0,77 (0,51–1,16) 1,23 (0,79–1,9) 1,43 (0,59–3,48) |
|
SELP Thr715Pro |
rs6131 |
–1087G –1087A |
0,89 0,11 |
0,84 0,16 |
3,85; (0,05) |
0,68 (0,46–1,0) 1,47 (1,0–2,18) |
–1087GG –1087GA –1087AA |
79,6 17,9 2,5 |
69,6 28,8 1,6 |
7,46; (0,02) |
0,59 (0,38 – 0,91) 1,85 (1,18 – 2,92) 0,64 (0,17 – 2,41) |
|
SELE Ser128Pro |
rs 5361 |
–128Ser –128Pro |
0,9 0,1 |
0,76 0,24 |
24,87; (0,00006) |
0,39 (0,26–0,57) 2,6 (1,77–3,81) |
–128SerSer –128 SerPro –128 ProPro |
81 16,4 2,6 |
55,2 41,6 3,2 |
33,1; (0,000008) |
0,29 (0,19–0,45) 3,63 (2,29–5,75) 1,22 (0,39–3,78) |
|
SELE Leu554Phe |
rs5355 |
–554Leu –554Phe |
0,92 0,08 |
0,89 0,11 |
1,17; (0,28) |
0,78 (0,5–1,22) 1,28 (0,82–2,02) |
–554LeuLeu –554LeuPhe –554PhePhe |
83,6 15,9 0,5 |
79,6 19,6 0,8 |
1,21; (0,55) |
0,77 (0,47–1,24) 1,29 (0,79–2,1) 1,61 (0,15–17,92) |
|
MTHFR Ala222Val |
rs1801133 |
–677C –677T |
0,71 0,29 |
0,73 0,27 |
0,32; (0,57) |
1,09 (0,81–1,46) 0,92 (0,69–1,23) |
–677CC –677CT –677TT |
48,5 44,5 7,0 |
50 45,2 4,8 |
0,96; (0,62) |
1,05 (0,72– 1,52) 1,04 (0,71–1,51) 0,67 (0,3–1,49) |
|
MTHFR Glu429Ala |
rs1801131 |
–1298A –1298C |
0,64 0,36 |
0,66 0,34 |
1,44; (0,23) |
0,84 (0,63–1,12) 1,19 (0,90–1,58) |
–1298AA –1298AC –1298CC |
52,3 36,8 10,9 |
46,8 39,2 14 |
1,57; (0,46) |
0,79 (0,54–1,14) 1,21 (0,82,1,77) 1,15 (0,66–1,99) |
|
MTR Asp919Gly |
rs1805087 |
–2756A –2756G |
0,75 0,25 |
0,73 0,27 |
0,66; (0,42) |
0,88 (0,65–1,19) 1,13 (0,84–1,53) |
–2756AA –2756AG –2756GG |
54,9 39,6 5,5 |
50 45,2 4,8 |
1,75; (0,42) |
0,8 (0,55–1,16) 1,29 (0,88–1,88) 0,87 (0,37–2,01) |
|
MTRR Ile22Met |
rs1801394 |
–66A –66G |
0,5 0,5 |
0,48 0,52 |
0,47; (0,49) |
0,91 (0,7–1,19) 1,1 (0,84–1,43) |
–66AA –66AG –66GG |
29,8 41,3 28,9 |
24,8 46,8 28,4 |
1,82; (0,4) |
0,78 (0,51–1,18) 1,25 (0,86–1,82) 0,98 (0,65–1,47) |
|
PON1 Gln192Arg |
rs662 |
–78A –78G |
0,71 0,29 |
0,68 0,32 |
0,35; (0,55) |
0,92 (0,69–1,22) 1,09 (0,82–1,44) |
–192GG –192GA –192AA |
49,3 42,8 7,9 |
48,2 38,8 13 |
0,8; (0,67) |
1,17 (0,8–1,7) 0,85 (0,58–1,24) 1,01 (0,58–1,76) |
|
ApoC3 SstI |
rs5128 |
–3238C –3238G |
0,9 0,1 |
0,85 0,15 |
5,29; (0,02) |
0,62 (0,41–0,93) 1,62 (1,07–2,44) |
–3238CC –3238CG –3238GG |
82,7 15,3 2,0 |
72,4 25,6 2 |
6,98; (0,03) |
0,55 (0,35–0,87) 1,89 (1,17–3,04) 1,01 (0,27–3,79) |
|
ApoE Leu28Pro |
rs769452 |
–3100Т –3100С |
0,8 0,2 |
0,81 0,19 |
0,08; (0,78) |
0,95 (0,64–1,4) 1,06 (0,71–1,57) |
–3100ТТ –3100ТС –3100СС |
63,1 35,7 1,2 |
62,8 34,5 2,7 |
0,98; (0,61) |
0,99 (0,63–1,56) 0,95 (0,6–1,5) 2,31 (0,42–12,77) |
|
CNTF G103A |
rs 55890 |
–103G –103A |
0,88 0,12 |
0,84 0,16 |
5,06; (0,015) |
0,72 (0,46–1,13) 1,38 (0,89–2,16) |
–GG –GA –AA |
78,3 18,5 3,2 |
72,4 22,4 5,2 |
1,76; (0,41) |
0,73 (0,43–1,21) 1,27 (0,73–2,19) 1,68 (0,55–5,12) |
|
BDNF Val66Met |
rs 6265 |
–196G –196A |
0,84 0,16 |
0,81 0,19 |
1,29; (0,26) |
0,79 (0,52–1,19) 1,27 (0,84–1,91) |
–196GG –196GA –196AA |
69,6 28,8 1,6 |
66,4 28,4 5,2 |
3,54; (0,17) |
0,86 (0,54–1,38) 0,98 (0,6–1,6) 3,45 (0,88–13,61) |
Примечание. OR – отношение шансов; df – степень свободы; жирным шрифтом выделены генотипы, являющиеся потенциальными факторами риска заболевания.
Другой комплекс – APOC3 является важным модулятором уровня триглицеридов плазмы, влияет на активацию эндотелиальных клеток и последующее повышение экспрессии молекул адгезии, что может представлять дополнительные механизмы, с помощью которых белок способствует развитию атеросклероза [6]. Ассоциации между полиморфизмом гена аполипопротеина C3 (APOC3) и нарушениями липидного и углеводного обмена являются устоявшимися – генотип GG полиморфизма C3238G (известного также как «S2» или «SstI») приводит к увеличению содержания триглицеридов, ЛПНП-холестерина и аполипопротеина В и снижению уровня ЛПВП-холестерина [3]. Также выявлены ассоциации последнего с метаболическим синдромом, диабетической ретинопатией и когнитивным дефектом. Однако, несмотря на описанную связь S2 аллеля с метаболизм липидов Russo G.T. и соавт. (2001) не нашли каких-либо существенных увеличений риска развития ИБС в изучаемой популяции [5]. И наоборот, группа исследователей во главе с J. Shanker (2008) назвала ApoC3-3238C > G важным генетическим вариантом не только для изменения содержания липидов, но и для развития ИБС у индейцев Азии [6]. В нашей работе ассоциацию с развитием инсульта с небольшим риском проявило носительство G-аллеля, преимущественно в гетерозиготном состоянии. Вероятно, подобный эффект косвенный и связан с прогрессированием так значимого для развития цереброваскулярной патологии атеросклероза. Что касается CNTF, то он идентифицирован как фактор, способствующий выживанию нейронов. Он предотвращает дегенерацию моторных аксонов после перерезки (внутриклеточная дегенерация) и способствует дифференцировке астроцитов и созреванию олигодендроцитов. CNTF-103G > A влияет не только на функционирование нейромышечной единицы развития нейронов и мышечных волокон [10], но и ассоциирован с развитием хронической ишемии мозга [2]. Предиктивный эффект данного полиморфизма сложно объяснить однозначно, однако можно предположить, что экспрессия этого пептида влияет на васкуло-глиальные отношения, что в последующем может сказаться на функционировании гематоэнцефалического барьера.
Чтобы построить статистическую модель прогнозирования развития ишемического инсульта, учитывая независимые факторы риска, мы воспользовались бинарной логистической регрессией, результаты которой представлены в табл. 2.
Таблица 2
Результаты многофакторного анализа (логистической регрессии) в прогнозировании ишемического инсульта у носителей изучаемого полиморфизма
|
Аллели/генотип |
Оценка |
р |
χ2 Вальда |
р-Вальда |
ОR* (95 % CI:) |
|
Аллели изучаемого полиморфизма, показавшие максимум правдоподобия |
|||||
|
ВО* |
–1,402 |
0,00014 |
14,73 |
0,00012 |
0,24 (0,12; 0,5) |
|
SELE-128Pro |
1,1459 |
0,00000059 |
25,69 |
0,0000004 |
3,14 (2,02; 4,91) |
|
CNTF-103A |
0,7351 |
0,0018 |
9,86 |
0,0017 |
2,09 (1,32; 3,3) |
|
ApoC3-3238G |
0,6112 |
0,015 |
5,96 |
0,00146 |
1,84 (1,12; 3,01) |
|
Генотипы изучаемого полиморфизма, показавшие максимум правдоподобия |
|||||
|
SELE-128 Ser/Pro |
1,3336 |
0,000000063 |
30,3 |
0,000000037 |
3,79 (2,36; 6,11) |
|
ApoE-3100С/С |
2,4993 |
0,001 |
10,91 |
0,00096 |
12,2 (2,75; 53,86) |
|
ApoC3-3238С/G |
0,6951 |
0,0082 |
7,06 |
0,0079 |
2,0 (1,199; 3,35) |
|
SELP-1087G/А |
0,6091 |
0,016 |
5,88 |
0,015 |
1,84 (1,12; 3,01) |
|
BDNF-196A/А |
1,5292 |
0,019 |
5,59 |
0,018 |
4,61 (1,29; 16,46) |
|
CNTF-103A/А |
1,0377 |
0,044 |
4,22 |
0,0399 |
2,82 (1,05; 7,62) |
Примечание. ВО – свободный член, ОR – отношение шансов.
Итоговое уравнение вероятности развития ишемического инсульта:
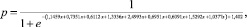
где р – вероятность развития ишемического инсульта, х-принимает значение 1 при наличии аллелей SELE-128Pro, CNTF-103A, ApoC3-3238G и генотипов SELE-128 Ser/Pro, ApoE-3100С/С, ApoC3-3238С/G, SELP-1087G/А, BDNF-196A/А, CNTF-103A/А.
Максимум правдоподобия показали, не только рассмотренные нами SNP, но и ApoE-3100С/С – ответственный за регуляцию липидного обмена, и BDNF-196A/А – оказывающий влияние на метаболизм нейронов.
При построении итогового уравнения бинарной логистической регрессии χ2 = 122,79 для 42 степеней свободы, при уровне значимости р < 0,0001, что свидетельствует о достаточно высокой достоверности данной математической модели.
Заключение
Полученные данные обращают внимание на проблему прогнозирования ишемического инсульта с позиции носительства различных полиморфных маркеров генов, с учетом территориальных особенностей региона. Безусловно, для окончательных выводов участия данных генетических факторов в развитии инфаркта мозга эти результаты должны быть воспроизведены в независимом исследовании.
Рецензенты:Витковский Ю.А., д.м.н., профессор, заведующий кафедрой нормальной физиологии, ГБОУ ВПО ЧГМА Минздрава России, г. Чита;
Цыбиков Н.Н., д.м.н., профессор, заведующий кафедрой патологической физиологии, ГБОУ ВПО ЧГМА Минздрава России, г. Чита.
Работа поступила в редакцию 12.02.2015.



