Хотя алюминий и является третьим по распространенности в земной коре, тем не менее до сих пор его влияние на структурно-функциональные изменения внутренних органов мало изучено [6]. Как известно, кумуляция соединений алюминия в живом организме опосредована поступлением металла с водой, пищей, антацидами, нестероидными противовоспалительными препаратами, диализатом и другими источниками [1, 2, 7]. Алюминий по содержанию в организме относится к примесным микроэлементам, при наибольшей его концентрации в сыворотке крови, печени, легких, костях, почках, структурах оболочек нервных клеток [8]. Предполагается, что всасывание алюминия находится в зависимости от соединения, в состав которого входит металл, и пищи, находящейся в кишечнике или поступающей одновременно с ним [4, 5].
До недавнего времени алюминий считался инертным элементом, не представляющим опасности для человека [3], однако в последнее время появляется все больше сообщений о потенциальной токсичности соединений алюминия для живых организмов, в том числе для человека, что подчеркивает несомненную актуальность проблемы.
Цель исследования – морфологическое и морфометрическое исследование внутренних органов крыс при кратковременной их затравке хлоридом алюминия.
Материалы и методы исследования
В эксперименте использовали 50 крыс-самцов линии Вистар, в возрасте 3–4 месяцев, массой 150–200 г. Животные содержались на стандартном рационе в условиях свободного доступа к воде и пище при естественном световом режиме. Крысы по принципу аналогов были разделены на 3 группы. Первая группа – интактные (n = 10), которым вводили физиологический раствор. Крысы, получавшие 4,24 г (2-я группа n = 20) и 2,12 г (3-я группа n = 20) AlCl3/100 г массы тела в пересчете на металл. Данные дозировки были рассчитаны эмпирическим путем и вводились ежедневно внутрижелудочно в виде раствора. Вывод крыс из эксперимента производили путем декапитации. Морфологическому анализу подвергались сердце, печень, почки, селезенка, желудок, тонкий кишечник. Исследуемые органы фиксировали в 10 % нейтральном формалине, заливали в парафин, изготавливали срезы толщиной 5–6 мкм и окрашивали эозином и гематоксилином. Изучение и фотографирование микропрепаратов проводили на микроскопе Leica 5200 при увеличении х100, х160 и х600. Морфометрическую оценку проводили при помощи окулярной сетки. Статистическую обработку данных проводили при помощи программы Microsoft Exel 2010 с использованием t-критерия Стьюдента.
Результаты исследования и их обсуждение
В первые часы после введения крысам 4,24 г хлорида алюминия в пересчете на металл отмечалась гиподинамия, угнетение общего состояния животных, отказ от пищи и воды. Через 3 часа погибли 10 крыс, спустя сутки – оставшиеся 10 животных. Полученный материал был подвергнут макро- и микроскопическому исследованию. Макроскопически при вскрытии брюшной полости выявлены паретически раздутые петли кишечника и желудок. Преимущественно по большой кривизне желудка отмечались множественные мелкоочаговые кровоизлияния. В полостях сердца отмечалось небольшое количество посмертных сгустков. Почки на разрезе полнокровные, граница коркового и мозгового вещества несколько сглажена при неизмененной чашечно-лоханочной системе. Селезенка на разрезе темно-вишневого цвета, соскоб умеренно кровянистый.
В первой группе животных в печени микроскопически отмечалось умеренное полнокровие центральных вен и синусоидов, слабо выраженное расширение перисинусоидальных пространств. В гепатоцитах наблюдались признаки мелкокапельной жировой дистрофии и гиалиново-капельной альтерации.
В сердечной мышце диффузное капиллярное и венозное полнокровие перемежались с мелкими участками периваскулярных кровоизлияний и гемолизом эритроцитов, неравномерно выраженным отеком межуточного вещества.
В почках отмечались множественные мелкоточечные кровоизлияния с эритростазом и явлениями мелкоочагового гемолиза эритроцитов на фоне выраженного отека межуточной ткани. Отдельные группы почечных клубочков представлялись отечными с признаками незначительной гипертрофии за счет набухания мезангиальных клеток, эндотелиоцитов клубочковых капилляров и эпителия клубочковой капсулы. В большинстве случаев ядра эпителия преимущественно проксимальных канальцев находились на стадии пикноза и лизиса, по этой причине промежутки между эпителиальными клетками по границе их соприкосновения оказались расширенными. Выявлялись признаки некротического нефроза с очаговой эксфолиацией нефроцитов преимущественно проксимальных канальцев.
Изменения, обнаруженные в селезенке, в большей степени касались гемодинамических нарушений в виде неравномерного кровенаполнения органа и мелкоочаговых кровоизлияний (рис. 1).
В подслизистом слое желудка отмечалось значительное полнокровие капилляров, расширение просвета сосудов, стаз эритроцитов с обширными участками мелких очажковых кровоизлияний. Слизистая оболочка с признаками субтотальных некрозов и отторжением эпителия с ярко выраженной очаговой лимфогистиоцитарной инфильтрацией соединительнотканной стромы и парапластической субстанции. В поле зрения определяются множественные очаговые скопления измененных эпителиальных клеток с ядрами овальной формы, признаками кариопикноза и кариолизиса. В просвете концевых отделов желез выявлялось значительное количество эозинофильного вещества. В участках реактивных и деструктивных изменений наблюдалась умеренная гипертрофия подслизистого слоя желудка вследствие выраженного отёка и кровоизлияний, сопровождающаяся очаговым разволокнением тканевых структур и периваскулярной инфильтрацией мононуклеарами.
В третьей группе животных после второго введения 2,12 г хлорида алюминия в пересчете на металл отмечена гибель 50 % крыс от их общего количества, остальные животные были выведены из эксперимента после недельного зондирования. Следует отметить стереотипность макроскопических изменений в опытных группах крыс при большей выраженности микроструктурной патологии в третьей группе.
Так, гистологическое исследование сердца показало набухание кардиомиоцитов с полиморфными и гипохромными ядрами при несколько утраченной их поперечной исчерченности и очаговой деформации.

Рис. 1. Вторая группа крыс. Микропрепарат. Селезенка с признаками гемодинамических нарушений и гемолизом эритроцитов. Окраска эозином и гематоксилином, х160
Микроскопическая картина печени представлена неравномерным капиллярно-венозным полнокровием и отеком пространств Диссе. Гепатоциты находились в состоянии мелкокапельной жировой и вакуольной дистрофии, со светлой цитоплазмой и гиперхромным ядром. Ядра и цитоплазма отдельных групп клеток находились в состоянии пикноза и лизиса. В ткани печени животных, получавших недельное зондирование, обнаруживались диффузно располагающиеся полигональные клетки в виде булыжной мостовой, характерные для тяжелых дистрофических изменений. В строме органа отмечались единичные лимфогистиоцитарные элементы.
В почках – очаговые кровоизлияния, захватывающие органоспецифические и интерстициальные гистоструктуры с накоплением в них эозинофильных белковых масс (рис. 2). Полнокровие микроциркуляторного русла выражается в форме капиллярного и венозного застоя. Морфометрически почечные клубочки увеличены (таблица) за счет отека интеркапиллярного пространства и полнокровия капилляров мальпигиева тельца. В просвете клубочковой капсулы определяются бледно-розовые гомогенные белковые массы. Мезангиальные клетки отечные, приблизительно 1/10 капиллярных петель сосудистых клубочков подвергнуты фрагментации и распаду с формированием фокусных некрозов клубочка. Эпителиальные клетки проксимальных и дистальных канальцев в состоянии гидропической дистрофии, увеличены, не имеют четких границ соприкосновения между собой, базальная мембрана канальцев разрыхлена.
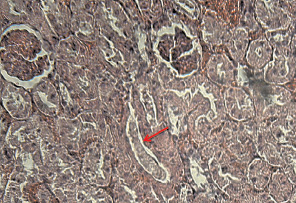
Рис. 2. Гомогенные массы в просвете канальцев (стрелка). Окраска эозином и гематоксилином, х160
Морфометрические показатели почечных клубочков, проксимальных и дистальных канальцев крыс, получавших 2,12 г AlCl3 в пересчете на металл (3-я группа), *(p < 0,001)
|
Показатель |
Интактные (n = 10) |
Группа 3 (n = 20) |
|
Площадь почечного клубочка вместе с капсулой мм2 |
0,015 ± 0,001 |
0,025 ± 0,008 |
|
Площадь сосудистого клубочка, мм2 |
0,06 ± 0,0002 |
0,013 ± 0,0005* |
|
Площадь мочевого пространства, мм2 |
0,007 ± 0,0013 |
0,012 ± 0,0027 |
|
Площадь просвета проксимальных канальцев, мкм2 |
1,32 ± 0,07 |
0,75 ± 0,11* |
|
Высота эпителия проксимальных канальцев, мм |
0,004 ± 0,0007 |
0,010 ± 0,0001* |
|
Высота эпителия дистальных канальцев, мм |
0,005 ± 0,0009 |
0,012 ± 0,001* |
|
Площадь просвета дистальных канальцев, мкм2 |
0,041 ± 0,011 |
0,084 ± 0,013* |
Очаговые некрозы канальцевого эпителия отмечаются преимущественно в корковом слое почки. Отдельные просветы канальцев мозгового вещества заполнены эозинофильными гомогенными белковыми массами. Данные изменения подтверждаются морфометрическими показателями (таблица).
В селезенке – выраженное полнокровие, отдельные лимфоидные фолликулы в состоянии гиперплазии, ростковый центр фолликулов несколько разрежен на фоне отека трабекулярного остова и диффузного гемолиза эритроцитов.
В стенке желудка и двенадцатиперстной кишки выявлено обильное слущивание поверхностных эпителиоцитов с небольшими фокусами некрозов. Желудочные ямки незначительно уплощены. При выраженной гиперемии сосуды микроциркуляторного русла с явлениями стаза и гемолиза эритроцитов. Мышечная оболочка желудка отечная, набухшая. Кишечный эпителий дистрофически изменен: эпителиоциты гипертрофированы, цитоплазма содержит вакуоли, ядра уплощены и оттеснены на периферию клетки. В отечной строме отмечается лейкоцитарная инфильтрация. Экзокринный эпителий отечный, набухший, с большим содержанием эозинофильных гранул.
Выводы
Введение животным 4,24 г хлорида алюминия в дозировке на 100 г массы тела в пересчете на металл вызывает гибель крыс второй группы в первые же сутки эксперимента, что, возможно, объясняется терминальной дозировкой алюминия, вызывающей множественную необратимую полиорганную патологию. Введение животным 2,12 г хлорида алюминия на 100 г массы тела в пересчете на металл вызывает гибель 50 % животных, что указывает на проявление острой токсичности металла, подтвержденной ярко выраженными дистрофическими и некробиотическими изменениями внутренних органов. Литературные данные и результаты настоящих морфологических исследований могут способствовать поиску способов и эффективных методов профилактики экспериментального алюминоза.
Рецензенты:Джиоев И.Г., д.м.н., профессор кафедры нормальной физиологии, зав. ЦНИЛ, ГБОУ ВПО «Северо-Осетинская государственная медицинская академия» Минздрава РФ, г. Владикавказ;
Урумова Л.Т., д.м.н., доцент кафедры патологической физиологии, ГБОУ ВПО «Северо-Осетинская государственная медицинская академия» Минздрава РФ, г. Владикавказ.
Работа поступила в редакцию 12.02.2015.



