β-глюкозидазы – относятся к классу гидролаз (КФ 3.2.1. 21), катализирующих гликолитическое расщепление β-гликозидной связи в глюкозидах, ди- и полисахаридах [7]. Гены β-глюкозидазы, обнаружены в геномах почти всех живых организмов, исключение составляют часть архей и некоторые паразитические одноклеточные эукариоты [11]. У высших растений β-глюкозидазы разделены на несколько групп, благодаря различиям в расщепляемых ими субстратах. Встречаются как высокоспецифичные β-глюкозидазы, расщепляющие только определенные субстраты, например дуриназа, которая расщепляет цианогенный гликозид дурин в растениях сорго [6], так и менее специфические для широкого спектра соединений этого типа [12].
Известно, что β-глюкозидазы могут локализоваться в различных компартментах растительной клетки, включая и клеточную стенку [11]. При этом связанные с клеточной стенкой β-глюкозидазы, как установлено [7], принимают участие не только в разрушении олигосахаридов, образующихся при действии эндо-β-глюканаз, но и в защите растений от фитопатогенных микроорганизмов. Обнаружено, что активность β-глюкозидаз увеличивается в период роста растений, индуцированного ауксинами [11], как полагают за счет возрастания растяжимости клеточных стенок растений [7].
Основной трудностью при изучении ферментов, ассоциированных с клеточной стенкой, является проблема их экстракции без потери активности. В настоящее время существует целый ряд исследований по выделению, очистке и свойствам β-глюкозидаз бактерий, грибов и животных, тогда как для растительных β-глюкозидаз такие работы единичны [6, 7]. Чаще всего изучение свойств большинства растительных β-глюкозидаз проводилось лишь на частичноочищенных препаратах [5]. В связи с этим получение высокоочищенных ферментных препаратов β-глюкозидазы растений разной клеточной локализации и изучение их свойств не только расширит наше представление о роли этих ферментов в процессах жизнедеятельности растений, но и позволит использовать в различных тест-системах, а также биотехнологических процессах наряду с бактериальными. Кроме этого, в клетках растений синтез и гидролиз гликозидов с широким спектром биологической активности также происходит при участии этого класса ферментов [6].
Ранее [1] в растениях гороха была обнаружена β-глюкозидаза, участвующая в расщеплении как специфического для данного растения изосукцинимид-β-D-глюкопиранозида (ИС-гликозида), так и р-НФГ, которая представлена как цитоплазматической, так и связаной с клеточными стенками молекулярными формами. Было показано [2], что эта β-глюкозидаза могла находиться как в адсорбированном на клеточной стенке состоянии, так и ионосвязанной с ней. Активность этих форм β-глюкозидазы менялась как в ходе онтогенеза, так и при действии условий гипоксии растений гороха [1]. Показано, что молекулярные формы связанных с клеточной стенкой β-глюкозидаз растений гороха имели разные величины электрофоретической подвижности и при этом значительно различались как между собой, так и от цитоплазматической формы [3]. Кроме этого, для них была характерна и различная скорость расщепления как ИС-гликозида, так и р-НФГ, что отражалось на Km Vmax [1, 3].
В связи с этим целью работы было выделение, очистка связанной с клеточной стенкой β-глюкозидазы растений гороха до гомогенного состояния и изучение физико-химических свойств, включая оптимальные условия функционирования, молекулярную массу, а также влияние температуры и рН на ее стабильность.
Материалы и методы исследований
Объектом исследования служили листья 10-дневных растений гороха (Pisum sativum L.) сорта Рамонский 77, выращенных методом гидропоники на свету. Навеску листьев (5 г) растирали со средой выделения (1:4), содержащей 0,1 М фосфатно-цитратный буфер (рН 7,0), 0,4 М сахарозу, 0,01 М фосфат калия и фильтровали через капроновую ткань. Полученную фракцию клеточных стенок двукратно отмывали 0,1 М фосфатно-цитратным буфером (рН 6,0) для получения адсорбированной формы β-глюкозидазы [3], которую далее подвергали очистке. На первом этапе осуществляли фракционирование белков сульфатом аммония (60–90 % насыщения). Для освобождения от низкомолекулярных примесей, использовали гель-фильтрацию на сефадексе G-25, после чего полученную обессоленную белковую фракцию пропускали через колонку с сефадексом G-100. Все операции по выделению и очистке фермента проводили при 4 °С.
Чистоту выделенного ферментного препарата контролировали методом электрофореза в ПААГ модифицированным методом Девиса. Молекулярную массу фермента определяли с помощью гель-хроматографии на сефадексе G-100 и электрофоретическим методом по Лэммли в ПААГ с ДДС-Na по маркерным белкам.
Активность β-глюкозидазы определяли спектрофотометрически, используя в качестве субстрата р-нитрофенил-β-D-глюкопиранозида (р-НФГ) [10]. За единицу активности (Е) фермента принимали то его количество, которое катализировало расщепление 1 мкмоль субстрата в 1 мин. Удельную активность фермента выражали в Е/мг белка. Содержание белка в пробах определяли по Лоури или спектрофотометрическим методом при 280 нм.
Оптимум рН фермента определяли при температуре + 37 °С, внося в реакционную среду, содержащую 0,1 мл выделенного фермента, субстрат и 0,1 М фосфатно-цитратный буфер со значениями рН от 3,0 до 7,8 (с шагом 0,4). При определении рН-стабильности β-глюкозидазы среда с ферментными препаратами и различными значениями рН 3,0–7,8, предварительно выдерживалась 30 мин, после чего в нее вносили р-НФГ и определяли остаточную активность фермента.
Температурный оптимум фермента определяли при оптимальном значении рН в диапазоне температур от + 4 до + 80 °С. Термостабильность β-глюкозидазы исследовали, предварительно выдерживая пробы в течение 30 мин при разных температурах (с + 4 до + 100 °С) и после охлаждения добавляли субстрат для определения остаточной активности фермента.
Результаты исследования и их обсуждение
В результате проведенной многостадийной очистки был получен ферментный препарат адсорбированной на клеточной стенке β-глюкозидазы с удельной активностью 281,3 ± 7,73 Е/мг белка, степенью очистки 62,5 и выходом 18 %. Нативный электрофорез в ПААГ показал, что ферментный препарат представлен одной полосой, и, следовательно фермент был получен в гомогенном состоянии (рис. 1, а). Полученный высокоочищенный препарат β-глюкозидазы далее использовался для определения физико-химических свойств фермента, таких как определение влияния температуры и рН на активность, термо- и кислотостабильности. Как показали наши опыты (рис. 1, б), величина Rf для адсорбированной на клеточной стенке β-глюкозидазы была равна 0,72, что значительно отличалось от Rf ионосвязанной и цитоплазматической форм данного фермента, которые составили 0,86 и 0,39 соответственно [1, 3].
Известно, что молекулярная масса большинства β-глюкозидаз, выделенных из различных растений, может сильно варьироваться и фермент может быть представлен не только моно-, но и ди-, три- и даже олигомером [5, 7]. Так, β-глюкозидаза из корней заразихи является мономером с молекулярной массой 30 кДа [8], а для люпина белого 200 кДа [10]. Исследования методом электрофореза с ДДС-Na β-глюкозидазы растений гороха показали, что фермент является мономером (рис. 1, б). Полученные результаты по установлению величины молекулярной массы по маркерным ферментам совпадали с данными, полученными с помощью гель-фильтрации (рис. 2). Молекулярная масса β-глюкозидазы находилась в пределах 42 ± 2 кДа.
 а)
а) 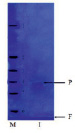 б)
б)
Рис. 1. а – определение гомогенности методом нативного электрофореза в ПААГ; б – определение молекулярной массы методом денатурирующего электрофореза в ПААГ: I – β-глюкозидаза; М – маркерные белки: 1 – каталаза (250 кДа); 2 – целлюлаза (94, 6 кДа); 3 – альбумин бычий сывороточный (66,2 кДа); 4 – яичный альбумин (45 кДа); 5 – карбоангидраза (31 кДа); 6 – лизоцим (14,4 кДа)
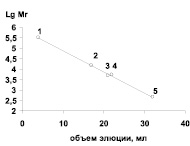
Рис. 2. Определение молекулярной массы β-глюкозидазы гель-хроматографическим методом на cефадексе G-100. Маркерные белки: 1 – каталаза (250 кДа); 2 – альбумин бычий сывороточный (66,2 кДа); 3 – пероксидаза (40 кДа); 4 – β-глюкозидаза (42 кДа); 5 –лизоцим (14,4 кДа)
Как известно, температурный оптимум растительных β-глюкозидаз обычно находится в широких пределах между + 30 и + 50 °С и неодинаков для β-глюкозидаз, выделенных из различных растений. Так, связанная с клеточной стенкой форма β-глюкозидазы из семян риса имела температурный оптимум, равный + 50 °С [5], а из листьев овса [11] и нута (Cicer arietinum L.) [12] – 40 °C. Как показали наши опыты (рис. 3), температурный оптимум для связанной с клеточной стенкой β-глюкозидазы растений гороха, составлял + 37 °С. Для цитоплазматической формы, как было показано ранее [1], он был равен + 30 °С.
Для изучения воздействия различных температур на активность β-глюкозидазы растений гороха, нами были также проведены эксперименты по исследованию термостабильности выделенного ферментного препарата. Как известно, зависимость активности фермента от температуры, с одной стороны, объясняется тем, что данный фактор приводит к его денатурации и снижению активности, а с другой стороны, ускоряет реакции образования фермент-субстратного комплекса. На рис. 4 отражена динамика процесса инактивации β-глюкозидазы под действием температуры. За 100 % была принята максимальная ферментативная активность β-глюкозидазы при оптимальном значении рН и температуры, то есть без какой-либо предварительной инкубации. Как видно, при температурах от + 20 до + 30 °С через 60 минут терялось до 20–30 % каталитической активности фермента. Инактивация ферментного препарата начиналась уже через 10 минут инкубации фермента при + 40 °С и через 60 мин терялось до 50 % его активности. При этом на кривых, полученных в данных опытах, выделялись два четко выраженных участка. Первый, со временем инкубации до 10 минут, отличался высокой скоростью падения активности фермента. Для второго (инкубация 20–60 минут) была характерна стабилизация остаточной активности фермента. Предполагают [4], что наличие подобного излома на кривых термоинактивации фермента, вероятно, может свидетельствовать либо о последовательном развитии двух стадий в процессе инактивации белка, либо о наличии нескольких форм фермента, которые характеризуются различной устойчивостью к температурной денатурации, как это предполагается для ряда других ферментов. Однако, полученные нами данные по электрофоретической подвижности β-глюкозидазы растений гороха в присутствии ДДС-Na показали, что данный фермент является мономером. Вероятнее всего, процесс его термоинактивации, адсорбированной на клеточной стенке β-глюкозидазы, был связан с наличием двух последовательных стадий разрушения фермента под действием высоких температур.
В ранее проведенных исследованиях [1] было показано, что β-глюкозидазы из проростков гороха проявляли четко сдвинутый в сторону кислых значений оптимум pH (цитоплазматическая – 5,2; ионосвязанная – 4,6). Полученные данные согласуются с значениями рН-оптимумов и для других растений; β-глюкозидаза из семян ели обыкновенной имела оптимум рН 4,5–5,5 [11]. Результаты исследования зависимости активности величины активности β-глюкозидазы от рН представлены на рис. 5. Как видно из полученных данных, рН-оптимум исследуемого ферментного препарата составил 4,8. Однако фермент был достаточно стабилен, как видно из кривой 2 рис. 5 в интервале рН от 4,5 до 6,5. При снижении рН до 3,0 сохранялось только 25 % его активности, а при рН 7,0 около 60 %, тогда как для цитоплазматической формы эта величина была значительно ниже, лишь 15 %. Большая кислотостабильность связанной с клеточной стенкой формы β-глюкозидаза ранее была обнаружена у растений риса [5]. Предполагается, что это может быть результатом стабилизирующего взаимодействия ферментов с функциональными группами веществ клеточных стенок [10, 11].
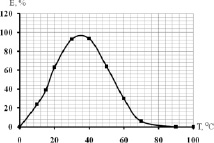
Рис. 3. Влияние температуры на каталитическую активность β-глюкозидазы растений гороха при оптимальной рН = 4,8 (в % от максимальной)
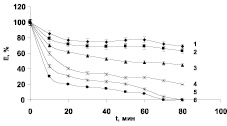
Рис. 4. Изменение активности β-глюкозидазы ( %) при разных температурах в зависимости от времени: 1–20 °С, 2–30 °С, 3–40 °С, 4–50 °С, 5–60 °С, 6–70 °С
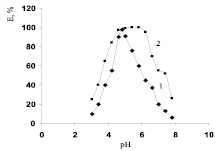
Рис. 5. Влияние рН на активность (1) и стабильность (2) связанной с клеточной стенкой β-глюкозидазы растений гороха
Выводы
Впервые из растений гороха получен электрофоретически гомогенный препарат адсорбированной на клеточной стенке β-глюкозидазы. Разработана трехстадийная схема очистки фермента, что позволило получить β-глюкозидазу со степенью очистки 62,5 и выходом 18 %. С помощью методов гель-фильтрации на сефадексе G-100 и электрофореза была определена молекулярная масса фермента, которая составила 42 ± 2 кДа. Фермент являлся мономером и проявлял максимальную энзиматическую активность при рН 4,8 и температуре + 37 °С, в отличие от цитоплазматической формы. Проведенные исследования по изучению устойчивости фермента к действию экстремальных значений рН и температуры показали, что эта форма β-глюкозидазы обладала большей стабильностью в отличие от цитоплазматической в диапазоне температур + 4–100 °С и рН 3,0–8,0. На кривых термоинактивации обнаружено наличие подобного излома на кривых термоинактивации, вероятно, что может свидетельствовать о последовательном развитии двух стадий в процессе инактивации данного фермента.
Работа выполнена при частичной финансовой поддержке гранта Министерства образования и науки «Развития научного потенциала высшей школы» 2009–2011.
Рецензенты:
Корнеева О.С., д.б.н., профессор, заведующая кафедрой биохимии и биотехнологии технологического факультета ФГБОУ ВПО «Воронежский государственный университет инженерных технологий», г. Воронеж;
Епринцев А.Т., д.б.н., профессор, заведующий кафедрой биохимии и физиологии биолого-почвенного факультета ФГБОУ ВПО «Воронежский государственный университет», г. Воронеж.
Работа поступила в редакцию 30.12.2014.



