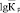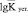Применение катионитов для извлечения, разделения и концентрирования ионов цветных, тяжелых и редких металлов основано на повышенной избирательности. Практическое использование катионитов требует знания механизма сорбции ионов металлов, состав и строение полимерных комплексов, образующихся в фазе полимерной матрицы. Для изучения механизма взаимодействия использовался метод прямой калориметрии, позволяющий установить энтальпию комплексообразования. Исследование термодинамических характеристик представляет практический интерес для управления процессами сорбции ионов переходных металлов.
Целью настоящей работы является изучение влияния степени заполнения фосфорнокислого катионита ионами кобальта на термодинамические характеристики и энтальпию процесса.
Материалы и методы исследования
Объектом исследования служил фосфорнокислый катионит КФП-12 в водородной форме с крупностью зерен в воздушно-сухом состоянии 0,25–0,50 мм. Тепловые эффекты сорбции ионов кобальта из фторидных растворов фосфорнокислым катионитом определяли на микрокалориметре МИД-200 при 298 К. Погрешность калориметрических измерений не превышала 2 %. Методика эксперимента заключалась в следующем. В калориметрический стакан помещали 50 мл раствора фторида кобальта. Концентрация соли менялась с целью получения различных степеней заполнения катионита ионами кобальта. Пробу воздушно-сухого катионита в H+-форме в количестве 0,2 г заливали 2 мл воды, выдерживали 24 часа при комнатной температуре. Этим обеспечивалось набухание образца. Полиэтиленовый стаканчик с образцом помещали в калориметрический стакан, который устанавливали в измерительную ячейку микрокалориметра. Вторая ячейка калориметра заполнялась аналогично первой, но вместо раствора соли брали воду. Измерительный блок калориметра термостатировался при 298 К. После выхода показаний измерительных приборов на базовую линию катионит приводили в контакт с раствором вращением ядра калориметра. Результаты опыта автоматически регистрировались на компьютер. По окончании калориметрического опыта ионит отфильтровывали и раствор анализировали для определения степени обмена.
Результаты исследования и их обсуждение
В теории ионного обмена большое значение придается стандартным термодинамическим функциям (энтальпии и энтропии). Эти величины непосредственно связаны с константой ионного обмена. Калориметрически измеренные тепловые эффекты процесса сорбции ионов дают суммарную величину общей энтальпии. Изменение энтропии, сопровождающее обмен, записывается выражением
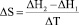 .
.
Энтальпию обмена можно выразить уравнением Вант-Гоффа:
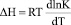 .
.
При наличии значений константы обмена для широкого интервала температур и при построении температурной зависимости по достаточно большому числу точек удается достичь близкого совпадения стандартных теплот обмена, рассчитанных по температурной зависимости и по экспериментальным калориметрическим данным. Таким образом, изменение энтальпии процесса определяется тепловым эффектом ионного обмена, измеренным микрокалориметрически.
Микрокалориметрическим методом была исследована сорбция ионов кобальта на фосфорнокислом катионите КФП-12 с изменяющейся степенью заполнения ионита ионами. Термокинетические кривые, представляющие зависимость интенсивности тепловыделения от времени проведения процесса, подтверждают механизм процесса сорбции ионов кобальта.
На рис. 1 представлены экспериментальные кинетические кривые сорбции ионов кобальта из водных растворов с различной исходной концентрацией. Из данных следует, что интенсивность тепловыделения при сорбции ионов кобальта со временем резко уменьшается. Это объясняется тем, что вначале процесс идет на поверхности гранул ионита и скорость его лимитируется скоростью диффузии в гидродинамической пленке гранулы, поэтому наблюдается резкий спад мощности теплового потока в первые две минуты. В этот период происходит снижение скорости процесса сорбции. Затем во взаимодействие вступают функциональные группы, расположенные внутри гранулы, диффузия ионов в порах замедляется и скорость тепловыделения (теплопоглощения) уменьшается. Интенсивность тепловыделения в этих условиях в расчете на единицу времени обесславливается как энергией связи, так и скоростью диффузии ионов в фазу катионита. Это подтверждается зависимостью доли тепловыделения от времени (рис. 2).
Полученные данные хорошо согласуются с литературными по микрокалориметрическому исследованию сорбции ионов двухвалентных металлов фосфорсодержащими ионитами [2–5].
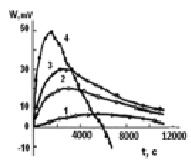
Рис. 1. Зависимость интенсивности тепловыделения (теплопоглощения) от времени при сорбции ионов кобальта катионитом КФП-12 в Н+-форме. Концентрация ионов кобальта, моль/дм3: 0,007 (1), 0,02 (2), 0,036 (3), 0,108 (4)
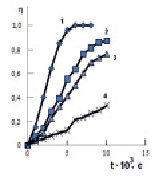
Рис. 2. Зависимость доли тепловыделения от времени при сорбции ионов кобальта катионитом КФП-12 в Н+-форме. Концентрация ионов кобальта, моль/дм3: 0,108 (1), 0,036 (2), 0,02 (3), 0,007 (4)
Для ионов кобальта первоначальный период сорбции является экзотермическим процессом, а затем становится эндотермическим. Это объясняется тем, что в начальный период процесс сорбции происходит на поверхности гранул и не сопровождается значительным изменением конформационного набора макромолекул катионита. Со временем в координационное взаимодействие вовлекается большое количество функциональных групп катионита, расположенных не очень удобно для комплексообразования, увеличиваются затраты на изменение их конформационного набора. Под конец эксперимента процесс сорбции ионов кобальта сопровождается слабым тепловыделением. По-видимому, в этот период практически не наблюдается сорбция ионов, а тепловой эффект процесса обусловливается перестройкой сорбционных центров.
Калориметрические исследования дают возможность рассчитать и тепловой эффект (∆H) при сорбции ионов катионитом. Изменение теплового эффекта при сорбции ионов кобальта от степени заполнения представлены на рис. 3. При сорбции ионов кобальта с увеличением степени заполнения фазы катионита наблюдается изменение знака энергоэффекта. При малых степенях заполнения фазы катионита сорбированными ионами кобальта происходит только выделение энергии. С возрастанием степени заполнения наблюдается поглощение энергии. Энерговыделение в начальный период сорбции объясняется координационным взаимодействием ионов с функциональными группами катионита.
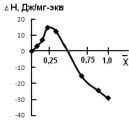
Рис. 3. Зависимость ∆H сорбции ионов кобальта от степени заполнения катионита КФП-12
Состав образующихся координационных центров и их стереохимия зависят от концентрации ионов металла в фазе катионита. Изменение величины энтальпии сорбции ионов кобальта от степени заполнения фазы катионита при малых значениях степени заполнения обусловлено взаимодействием сорбируемых ионов кобальта одновременно с несколькими фиксированными группами ионита.
Рост эндотермичности процесса: с увеличением концентрации ионов кобальта в растворе возрастают энергетические затраты системы, связанные с образованием структур:
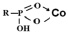 .
.
Изменение не только величины, но и знака теплового эффекта, объясняется влиянием характера гидратации сорбируемых противоионов, процессами сольватации и десольватации ионов в растворе, типом функциональных групп ионитов. На величину теплового эффекта ионообменного процесса значительное влияние оказывает энергетика возникновения связи функциональной группы с противоионом. Влияние природы ионов объясняется тем, что в результате ионного обмена
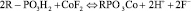
выделяется катион водорода, который взаимодействует с ионом фтора с образованием HF или 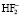 по реакции
по реакции
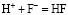 ;
;
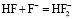 .
.
Для оценки энергии образования вторичных продуктов, проведен термодинамический расчет предполагаемых веществ, исходя из энтальпии образования [1, 6, 7, 9] HF и F–. В данном случае это могут быть не только молекулы фтористоводородной кислоты, а также различные по составу комплексные ионы фторидов металлов. Результаты расчета приведены в табл. 1.
Из данных табл. 1 видно, что образование нейтральных молекул фторида кобальта и фтористоводородной кислоты идет с выделением тепла, а образование комплексных ионов – с поглощением тепла. Таким образом, можно предположить, что в начальный момент сорбции ионов кобальта из фторидных растворов катионитом КФП-12 на общий энергетический эффект процесса существенное влияние оказывает образование фтористоводородной кислоты. Сравнивая данные калориметрических измерений при различных степенях заполнения катионита с учетом поправки на возможное образование фтористоводородной кислоты, можно сделать вывод, что это влияние будет возрастать с увеличением степени заполнения ионита и может привести даже к смене знака суммарного теплового эффекта.
Сорбцию ионов кобальта в водородной форме фосфорнокислого катионита можно выразить уравнением:
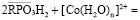
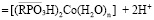 .
.
В процессе сорбции происходит вытеснение ионов водорода ионами кобальта вследствие образования более прочной ионнокоординационной связи с фосфорнокислыми группами.
С увеличением концентрации ионов в растворе увеличиваются энергетические затраты системы, связанные с образованием полимерных комплексов переходных металлов. Для определения термодинамических функций комплексообразования, необходимо исключить все побочные процессы, в частности, ионный обмен, сопровождающийся образованием побочных продуктов. Данные, полученные микрокалориметрическим методом, показывают, что образование комплексов является эндотермическим (∆HКО > 0) процессом и сопровождается увеличением энтропии.
Микрокалориметрические измерения позволяют рассчитать суммарный тепловой эффект сорбционного процесса, который складывается из ряда энергетических эффектов: образование новых химических связей (∆Hреакц.), увеличение степени гидролиза вводимой в ячейку соли (∆Hг), разведения раствора (∆Hразв.) и образование вторичных продуктов реакции (∆Hвт.пр.), т.е.
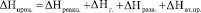 .
.
Вклад ∆Hг и ∆Hразв. в весь процесс происходит в начальный момент времени, поэтому суммарный термоэффект процесса определяется взаимодействием катионов с фосфорнокислыми группами и образованием вторичных продуктов. Учитывая все эффекты, влияющие на суммарный тепловой эффект, были рассчитаны значения энтальпии комплексообразования. На основании полученных результатов были рассчитаны значения термодинамических параметров.
Значения основных термодинамических функций представлены в табл. 2.
Изменение энтропии при комплексообразовании связано с разрушением гидратных оболочек лигандных групп полимера, вытеснением молекул низкомолекулярного лиганда из первой координационной сферы металла и образованием хелатных структур [8]. Изменение энтальпии процесса сорбции ионов кобальта на значительном участке не зависит от степени заполнения катионита. Это означает, что вклад энтальпийного фактора на энергию Гиббса постоянен. Характер изменения термодинамических функций дает основание считать, что с увеличением концентрации ионов металла в растворе процесс комплексообразования становится энергетически более выгодным.
Таким образом, результаты микрокалориметрического метода изучения процесса сорбции ионов кобальта комплексообразующим катионитом являются информативными. Этот метод позволяет не только определить суммарные тепловые эффекты сорбции, но и установить механизм сорбционного процесса, влияние различных факторов на кинетику процесса и установление сорбционного равновесия.
Таблица 1
Энергия образования вторичных продуктов в процессе сорбции ионов двухзарядных металлов [1, 9]
|
Система |
∆Hf, кДж/ моль |
||||
|
HF |
MeF+ |
MeF2 |
[MeF4]2– |
||
|
CoF2 |
– 21,82 |
32,73 |
43,64 |
||
Таблица 2
Термодинамические функции процесса образования полимерных комплексов переходного металла кобальта с катионитом КФП-12
|
Металл |
Степень заполнения |
|
полимерного комплекса |
+ ∆H, кДж/моль |
– ∆G, кДж/моль |
+ ∆S, Дж/моль·град |
|
Co |
0,2 |
6,02 |
3,97 |
4,7 |
34,26 |
130,74 |
|
0,4 |
5,65 |
3,73 |
2,8 |
32,19 |
117,41 |
|
|
0,6 |
4,60 |
3,04 |
1,2 |
26,23 |
92,06 |
|
|
0,8 |
4,43 |
2,92 |
0,9 |
25,20 |
87,59 |
|
|
1,0 |
4,33 |
2,86 |
– 0,6 |
24,68 |
80,81 |
Рецензенты:
Андреев О.В., д.х.н., профессор, заведующий кафедрой неорганической и физической химии, ФГБОУ ВПО «Тюменский государственный университет», г. Тюмень;
Морев А.В., д.ф.-м.н., профессор кафедры физики, ФГБОУ ВПО «Тюменский государственный архитектурно-строительный университет», г. Тюмень.
Работа поступила в редакцию 30.12.2014.