В настоящее время невозможно представить себе практическую деятельность человека без использования органических фосфорсодержащих соединений. Инсектициды, фунгициды, дефолианты и гербициды в сельском хозяйстве, фосфорорганические мономеры, обработка натуральных волокон органическими соединениями фосфора для придания им огнестойкости, аниониты и катиониты, обладающие высокой избирательностью, металлокомплексные катализаторы, позволяющие проводить направленный синтез, использование органических соединений фосфора в нефтехимической промышленности ‒ вот далеко не полный перечень успешного применения этих соединений [14,17–19,21]. К настоящему времени среди фосфорилированных производных алициклических и ацетиленсодержащих аминов найдены вещества с высокой биологической активностью [1–3,6–8,10–13, 15, 16].
Цель исследования. С целью выяснения влияния заместителей в фосфонатной группе на их биологическую активность и для расширения круга соединений этого типа, нами были синтезированы новые 0,0-диалкил-N-(1-этинилциклогексан-1-ил) амидофосфонаты (7, 8).
Материалы и методы исследования
Исходный 1-этинил-1-аминоциклогексан был (3) синтезирован из известного карбинола (1) через получение его хлорпроизводного (2) по известной методике [5, 20]. Исходные диаллилфосфит (4), дипропаргилфосфит (5) и этиленбисфосфит (6) получены по методикам [4, 5].
Хлорирование (1) проводили концентрированной НСl в присутствии каталитических количеств СuCl, медной бронзы и СаСl2. Выход (2) составил 31 %. Дальнейшим аминированием циклогексилхлорида (2) жидким азотом в токе инертного газа получен целевой продукт (3а) с 74,0 % выходом в виде гидрохлорида. Основание (3) получено с 62,0 % выходом. Реакцию 1-этинил-1-аминоциклогексана (3) с диалкилфосфитами (4,5) проводили в избытке CCl4 при эквимолярном соотношении реагентов, в присутствии основания, триэтиламин. Во всех случаях взаимодействие протекает гладко, при комнатной температуре (рис. 1).
Наибольшие выходы 0,0-диалкил-N-(1-этинилциклогексан-1-ил) амидофосфонатов (7, 8) удалось достичь при добавлении эквимолярных количеств диалкилфосфитов (4, 5) к смеси 1-этинил-1-аминоциклогексана (3) и триэтиламина в 50 мл сухого CCl4 при 20 °С и перемешиваем в течение 3–5 ч. Выпавший в результате реакции гидрохлорид триэтиламина отфильтровали, фильтрат отогнали в вакууме. Полученные амидофосфанаты (7, 8) представляют собой белые кристаллические вещества, легко очищающиеся перекристаллизацией из петролейного эфира. Ход реакции и индивидуальность синтезированных соединений контролировали методом тонкослойной хроматографии на оксиде алюминия II степени активности (бензол: этанол; 10: 1).
Состав и строение полученных соединений (7, 8) подтверждены данными элементного анализа, ИК -, ПМР -, ЯМР31Р спектроскопии.
В спектрах ИК эфироамидов (7, 8) имеются полосы поглощения в области 1232, 1235 см-1, характерные для P=O группы, в интервале 1050–1070 см-1 наблюдаются интенсивные дублетные полосы поглощения P-O-C- связи. Вторичной аминогруппе соответствуют полосы поглощения в области 3200 и 3220 см-1 соответственно, табл. 2.
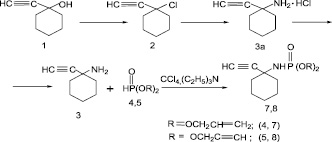
Рис. 1
Таблица 1
Физико-химические свойства соединений (7–9, 11)
|
соед. № |
Выход, % |
Т.пл., °С |
Rf* |
Вычислено % |
Брутто-формула |
Найдено, % |
||||||
|
C |
H |
N |
P |
C |
H |
N |
P |
|||||
|
7 |
76,0 |
48–49 |
0,64 |
59,1 |
7,7 |
4,8 |
10,3 |
С14Н22NO3P |
59,3 |
7,7 |
4,9 |
10,9 |
|
8 |
63,0 |
61–62 |
0,59 |
60,2 |
6,4 |
5,0 |
11,1 |
С14Н18NO3P |
60,0 |
6,2 |
5,3 |
10,8 |
|
9 |
75,0 |
109 |
0,67 |
52,4 |
6,9 |
6,1 |
13,5 |
C20H32N2O6P2 |
52,3 |
6,9 |
6,0 |
13,4 |
|
11 |
72,0 |
72–73 |
0,56 |
49,0 |
7,2 |
8,8 |
9,74 |
C13H23N2O3PS |
48,9 |
7,0 |
8,6 |
9,63 |
Таблица 2
ИК -, ПМР -, ЯМР31Р спектры соединений (7–9, 11)
|
соед. № |
ИК-спектр, n, см-1 |
ПМР-спектр, δ, м.д. |
ЯМР 31Р, δ, м.д. |
||||||
|
P=O |
P-O-C |
NH |
≡CH |
C≡C |
≡CH |
NH |
P-O |
||
|
7 |
1232 |
1050, 1020 |
3200 |
3300 |
2110 |
2,35 с |
3,65 д (J=6 Гц) |
5,2 кв. 4,45м |
6,40 |
|
8 |
1235 |
1070, 1040 |
3220 |
3290 |
2135 |
2,42 с |
5,01 д (J=8 Гц) |
4,62 кв 2,325 |
6,42 |
|
9 |
1260 |
1030, 1050 |
3170 |
3300 |
2110 |
– |
– |
– |
– |
|
11 |
1250 |
1050, 1080 |
3260 |
3320 |
2115 |
– |
– |
– |
– |
В области 2110 и 2135см-1 наблюдаются валентные колебания, характерные для тройной связи (C≡C). Валентным колебаниям концевого ацетиленового водорода соответствуют полосы поглощения в области 3330 и 3290 см-1 соответственно.
В спектрах ПМР соединений (7, 8) сигналы протона амидной группы проявляются в виде дублета в области 3,65 м.д. и 5,01 м.д. с константой спин-спинового расщепления JNH-P = 8 Гц, сигнал этинильного протона проявляется в виде синглета при 2,35 м.д. и 2,42 м.д. Сигналы протонов диалкоксифосфорильных группы проявляются в виде квадруплета в области 5,2 м.д. и мультиплета в области 4,45 м.д. (10Н, POCH2C≡CH).
В спектрах ЯМР31Р продуктов реакции (7, 8) имеются синглетные сигналы в области 6,40 и 6,42 м.д., что соответствует резонансу ядра фосфора в амидах диалкилфосфорных кислот.
Интересной группой диалкилфосфористых кислот в синтетическом отношении являются циклические бисфосфиты, которые представляют собой биофункциональные фосфорсодержащие мономеры. Одним из методов получения фосфорсодержащих продуктов с несколькими функциональными группами является реакция переэтерификации диалкилфосфитов диолами [4, 6, 9, 10].
В дальнейшем в результате подробного изучения этой реакции было показано, что при соотношении диэтилфосфита и гликоля 1:1 в присутствии металлического натрия получается вещество, почти полностью перегоняющееся в вакууме. По данным элементного анализа и молекулярному весу оно соответствовало циклическому десятичленному бисфосфонату. При изучении реакции присоединения различных карбонильных соединений, таких как хлораль, бензальдегид, п-нитробензальдегид, ацетон, параформальдегид к этиленбисфосфиту, были получены и охарактеризованы продукты бис-присоединения, среди которых найдены биологически активные соединения [6, 10].
С целью создания и поиска новых биологически активных соединений исследована реакция этиленбисфосфита (6) с 1-этинил-1-амино-циклогексаном (3) в условиях реакции Тодда-Атертона (рис. 2).
Реакцию этиленбисфосфита (6) с 1-этинил-1-аминоциклогексаном (3) проводили при комнатной температуре в избытке CCl4 при соотношении реагентов 1:2, в качестве акцептора HCl использовали триэтиламин. В результате с выходом 75 % был получен и охарактеризован ранее не описанный диамид этиленбисфосфорной кислоты ‒ 1,6-бис(этинилцикло-гексиламин)-1,6-диоксифосфорил-2,5,7,10-тетраоксоциклодекан (9), который представляет собой белое кристаллическое вещество, хорошо растворимое в воде и в большинстве органических растворителей.
Состав и строение соединения (9) подтверждено данными элементного анализа, ИК-спектрометрии. Физико-химические и спектральные характеристики соединения (9) представлены в табл. 1,2.
В спектре ИК диамида (9) имеются полосы поглощения, характерные для P=O группы в области 1260 см-1, в интервале 1030–1050 см-1 наблюдаются интенсивные полосы поглощения связи P-O-C. Вторичной аминогруппе соответствуют полосы поглощения в области 3170 см-1. Отчетливо проявляются полосы поглощения терминальной ацетиленовой связи C≡C при 2110 см-1, а также концевого ацетиленового водорода (≡CH) при 3300 см-1.
Таким образом, установлено, что в условиях реакции Тодда-Атертона с использованием этиленбисфосфита в качестве алкилирующего агента реакция с 1-этинил-1-аминоциклогексаном проходит с образованием продукта бисприсоединения.
Одной из типичных реакций первичных аминов является реакция с алкилизотиоцианатами, позволяющая синтезировать различно замещенные тиомочевины [6, 10]. Несомненный интерес представляет возможность синтеза новых производных фосфорсодержащих тиомочевин на основе ацетиленовых аминов. В развитие работ по синтезу новых функционально замещенных ацетиленсодержащих аминов было изучено взаимодействие 1-этинил-1-аминоциклогексана (3) и с изотиоцианатом диэтилфосфористой кислоты (10) (рис. 3).
Реакцию проводили в среде сухого бензола при нагревании эквимолярных соотношений реагентов при 80 °С в течение 3–5 ч. В результате с выходом 72 % была выделена и охарактеризована N-диэтокси-N1-(1-этинил-циклогекс-1-ил)тиомочевина (11). Состав и строение целевого продукта (11) установлены на основании данных элементного анализа, ИК-спектроскопии, индивидуальность с помощью тонкослойной хроматографии на оксиде алюминия, (бензол: этанол; 5:1).
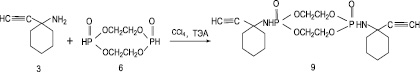
Рис. 2
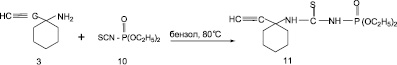
Рис. 3
В ИК-спектре соединения (11) отчетливо проявляются полосы поглощения в области 1250 см-1, характерные для P=O группы. В области 1050–1080 см-1 наблюдаются полосы поглощения P-O-C группы. Валентные колебания NH-групп проявляются в области 3260 см-1 в виде уширенного пика, валентным колебанием (C≡C) тройной связи соответствует полоса поглощения в области 2110 см-1, терминальному ацетиленовому водороду (≡CН) – при 3320 см-1. Физико-химические и спектральные характеристики соединений (11) представлены в табл. 1, 2.
Результаты исследования и их обсуждение
0,0-диаллил-N-(1-этинилциклогексан-1-ил) амидофосфат (7). К смеси 0,025 моля (3,10 г) 1-этинил-1-аминоциклогексана (3) и 0,020 моля (2,63 г) триэтиламина в 50 мл сухого CCl4 при комнатной температуре и перемешивании добавляют 0,025 моль (2,63 г) диаллилфосфита в 10 мл CCl4. Смесь перемешивают в течение 3 ч. Выпавший хлоргидрат, триэтиламина отфильтровывают, фильтрат упаривают в вакууме. Остаток очищают перекристаллизацией из петролейного эфира. Выход 76 %, Т.плав. 48–49 ° (из гексана), Rf 0,64 (AI2O3, II ст. акт., бензол: этанол – 10:1).
0,0-дипропаргил-N-(1-этинилциклогексан-1-ил) амидофосфат (8). Получен аналогично. Выход 63 %, Т.пл. 61–62 °С (из петролейного эфира), Rf 0,59 (AI2O3, II ст. акт., бензол: этанол – 10:1) (табл. 1, 2).
1,6-бис(этинилциклогексиламин)-1,6-диоксифосфорил-2,5,7,10-тетраоксоциклодекан (9). К смеси 0,022 моля (2,7 г) 1-этинил-1-аминоциклогексана (3) 0,022 моля (2,12 г) триэтиламина в 40 мл CCl4 постепенно при перемешивании при комнатной температуре добавили 0,01 моля (2,16 г) этиленбисфосфита (6) в 10 мл CCl4. Температура реакционной смеси поднялась на 6 °С. Перемешивание продолжили в течение 3-х часов при температуре 50 °С. Выпавший осадок гидрохлорида триэтиламина отфильтровали. Фильтрат упарили, остаток после перекристаллизации из ацетона и петролейного эфира представляет собой белое кристаллическое вещество. Выход 75 %, Т.пл. 109–110 °С (из петролейного эфира), Rf 0,67 (AI2O3, II ст. акт., бензол: этанол – 10:1) (табл. 1, 2).
N-(1-этинилциклогекс-1-ил)-N1-диэтоксифосфорилтиомочевина (11). В четырехгорлую колбу, снабженную обратным холодильником, мешалкой, термометром и капельной воронкой, добавляют 0,04 моля (7,8 г) изотиоцианат диэтилфосфористой кислоты (10), в 50 мл сухого бензола постепенно по каплям при комнатной температуре прибавляют 0,04 моля (4,90 г) 1-этинил-1-аминоциклогексана (3). При этом температура реакционной смеси поднимается с 18 до 26 °С. Смесь перемешивают в течение 3-х часов при 80 °С, наблюдается изменение цвета реакционной среды до оранжевого и отделение маслообразной массы. После двухкратной перекристаллизации из ацетона получают кристаллы белого цвета. Выход 72 %, Т.пл. 72-73 °С, Rf 0,56 (бензол:этанол 5:1).
Выводы
Таким образом, взаимодействием 1-этинил-1-аминоциклогексана с диалкилфосфитами различного строения и изотиоцианатом диэтилфосфористой кислоты в условиях реакции Тодда-Атертона получен ряд новых амидофосфонатов. Состав и строение полученных соединений подтверждены данными элементного анализа, ИК-, ПМР -, ЯМР31Р спектроскопии.
Рецензенты:
Бутин Б.М., д.х.н., профессор, советник ректора Республиканского государственного предприятия на праве хозяйственного ведения «Казахский государственный женский педагогический университет» Министерства образования и науки Республики Казахстан, г. Алматы;
Менлигазиев Е.Ж., д.х.н., профессор кафедры химии Республиканского государственного предприятия на праве хозяйственного ведения «Казахский государственный женский педагогический университет» Министерства образования и науки Республики Казахстан, г. Алматы.
Работа поступила в редакцию 30.12.2014.



