Бактерии вида Staphylococcus epidermidis являются частью нормальной микрофлоры кожи и слизистых человека и животных [1]. Однако, согласно последним данным, коагулазонегативные стафилококки, к которым относятся бактерии вида S. epidermidis, занимают лидирующее положение среди всех инфекций (15,3 %), а при попадании их в кровоток обуславливают до 34,1 % инфекционных осложнений, связанных с центральными венозными катетерами [7]. Ключевым этапом в развитии этих инфекций является адгезия бактерий к поверхности использованных имплантатов [13].
Известно, что факторы среды, в том числе её состав, оказывают существенное влияние на бактериальную адгезию. Однако до сих пор остается неясной конкретная роль ионов двухвалентных металлов в процессах адгезии бактериальных клеток. Известно, что ионы кальция вызывают зависимое от их концентрации ингибирование образования биопленок бактерий S. aureus [11], а присутствие в среде ионов магния и кальция в концентрации до 128 мМ значительно усиливает продукцию внеклеточных полимеров и образование биопленок клиническими изолятами S. epidermidis [6].
В связи с этим целью настоящего исследования была оценка процессов адгезии и образования биопленок бактериями S. epidermidis при изменении содержания в среде ионов кальция, магния, цинка и марганца.
Материалы и методы исследования
В качестве объектов исследования использовали три штамма бактерий вида S. epidermidis: S. epidermidis GISK 33 (Государственная коллекция патогенных микроорганизмов «Научного центра экспертизы средств медицинского применения» МЗ России, Москва), S. epidermidis ATCC 12228 и S. epidermidis ATCC 29887. Бактерии выращивали на жидкой питательной среде Luria–Bertani (LB), культивируя при 37 °С и 160 об/мин до достижения культурами логарифмической фазы роста, осаждали (13000 об/мин, 5 мин), осадки дважды промывали 0,14 М NаCl и ресуспендировали в среде LB без KCl, содержащей ионы Ca2+, Mg2+, Zn2+ и Mn2+ в концентрации 0,05; 0,1; 0,5; 1,0 и 2,5 мМ или 2,5 мМ ЭДТА до конечного содержания бактерий 107 КОЕ/мл. В контрольных экспериментах использовали суспензии бактерий среде LB без внесения катионов.
Адгезивные свойства бактерий оценивали в полистироловых чашках Петри (40 мм, «Медполимер», Россия) после инкубации при 37 °С в течение 30 мин [2]. Количество связавшихся с поверхностями полистрола бактерий оценивали прямым подсчетом клеток в поле зрения с помощью микровизора «μViso-103» (Россия) после окрашивания их водным раствором кристаллического фиолетового (0,1 %), учитывая не менее 10 полей зрения при увеличении х2500.
Биопленкообразующую способность бактерий S. epidermidis в присутствии ионов металлов определяли классическим методом выращивания в ячейках 96-луночного плоскодонного планшета с последующим отделением планктонных клеток и окрашиванием биопленок 0,1 % раствором кристаллического фиолетового. Связавшийся краситель экстрагировали 96 % этанолом и оптическую плотность полученных экстрактов измеряли на планшетном ридере «Biorad» (США) при 570 нм [12].
Дзета-потенциал бактериальных клеток определяли на лазерном анализаторе размера частиц и дзета-потенциала Zetasizer NanoZS («Malvern», Великобритания) методом динамического светорассеяния под углом 90° по изменению распределения частиц в электрическом поле. Бактерии, выращенные и подготовленные, как описано выше, суспендировали до концентрации 107 КОЕ/мл в питательной среде LB без KCl, содержащей ионы Ca2+ , Mg2+ , Zn2+, Mn2+ в концентрации 2,5 мМ. Измерения проводили при 37 °С в течение 30 мин.
Результаты исследования и их обсуждение
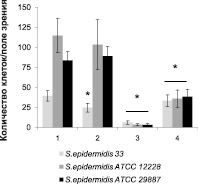
Полученные экспериментальные данные показали, что повышение концентрации ионов кальция в среде культивирования до 2,5 мМ снижает количество сорбированных клеток только штамма S. epidermidis 33, а интенсивность формирования биопленок ‒ почти в 2 раза для штаммов S. epidermidis 33 и S. epidermidis 12228 (рис. 1). Обнаружено, что ионы цинка в концентрации 2,5 мМ оказывают ингибирующий эффект как на адгезию, так и образование биопленок всех исследованных штаммов S. epidermidis. При этом влияние ионов цинка наиболее ярко проявлялось на первых этапах образования биопленок в связи с тем, что число сорбированных клеток снижалось на 85–97 %, тогда как образование биопленок в этих условиях снижалось менее выраженно – на 37–50 %. Однако недостаток свободных ионов кальция и цинка, образующийся при добавлении в среду комплексообразователя (ЭДТА), также приводит к снижению сорбционных характеристик бактерий всех штаммов.
 а
а 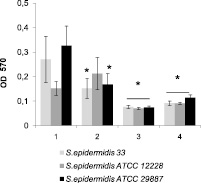 б
б
Рис. 1. Влияние ионов кальция (2,5 мМ), цинка (2,5 мМ) и ЭДТА (2,5 мМ) в среде LB на адгезию (а) и образование биопленок (б) бактериями S. epidermidis
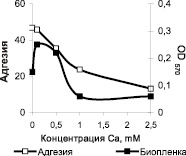
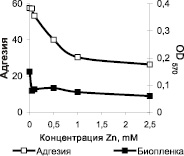
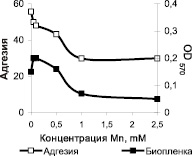
Результаты детального исследования адгезии и образования биопленок бактериями штамма S.epidermidis 33 при внесении в среду инкубации ионов Ca2+, Mg2+, Zn2+ и Mn2+ в диапазоне концентраций от 0 до 2,5 мМ представлены на рис. 2. Полученные данные свидетельствуют о том, что увеличение концентрации ионов Ca2+ и Mn2+ в среде культивирования до 0,5 мМ приводило к небольшому повышению образования биопленок (рис. 2, а, г). Дальнейший рост содержания этих ионов в среде оказывал ингибирующий эффект на процесс формирования биопленок.
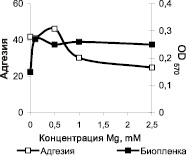
Важно отметить, что возрастание содержания в среде ионов Mg2+ до 2,5 мМ повышает биопленкообразующую активность бактерий примерно в 2 раза (рис. 2, б). В то же время присутствие в среде ионов Zn2+ оказывает ингибирующее действие на формирование биопленок, начиная с минимальной исследованной концентрации (0,05 мМ) (рис. 2, в).
В отличие от процессов биопленкообразования, адгезия бактериальных клеток в значительной мере снижается при внесении в среду всех исследованных в работе катионов, начиная с концентрации 0,5–1,0 мМ.
а б
в г
Рис. 2. Влияние концентрации ионов металлов Ca2+ (а), Mg2+ (б), Zn2+ (в), Mn2+ (г) в среде LB на адгезию и образование биопленок бактериями S. epidermidis 33.
Выраженное ингибирование образования биопленок бактерий S. epidermidis 33 при введении в среду роста ионов Ca2+, Zn2+ и Mn2+ может быть связано с активацией внеклеточных протеолитических ферментов [8], которая приводит к дефициту полноценных белковых компонентов, необходимых для построения матрикса формирующихся биопленок коагулазонегативных стафилококков [9].
Имеющиеся в литературе данные свидетельствуют о том, что ионы кальция и марганца способны ингибировать адгезию к полистиролу, межклеточную адгезию и образование Bap-зависимых биопленок бактериями S. aureus [4]. По-видимому, это обусловлено комплексообразованием ионов кальция с белком Bap через специфический EF-мотив данного белка, так как показано, что после образования такого комплекса бактерии теряют способность к межклеточной адгезии и тем самым к образованию биопленок [4]. Можно предположить, что подобный эффект характерен и для бактерий S. epidermidis, для которых белковые компоненты являются основным компонентом межклеточного матрикса формируемых биопленок.
Кроме того, известно, что в процессах адгезии стафилококков к поверхности полистирола принимают участие белки клеточной стенки Aap и SasG, имеющие специфические Zn-связывающие домены [5]. В связи с этим можно предположить, что избыток ионов цинка способен оказывать влияние на уровень гидрофобности клеточной стенки бактерий и тем самым вызывать снижение количества сорбированных клеток. Ионы марганца, возможно, связываясь с этими белками не специфически, могли блокировать их основные функции и тем самым заметно снижать способность клеток стафилококков к сорбции на поверхности полистирола.
Важно отметить, что имеющиеся в составе клеточной стенки грамположительных бактерий белки, экзополисахариды и липотейхоевые кислоты способны связывать ионы кальция [3]. Такое неспецифическое связывание металлов с поверхностными структурами бактерий может сопровождаться изменением электростатических свойств клеток. Действительно, результаты исследования влияния двухвалентных катионов на дзета-потенциал бактерий S. epidermidis 33 подтвердили предположение об изменении отрицательного заряда бактериальных клеток в их присутствии (таблица). Максимальный эффект на величину дзета-потенциала оказывают ионы магния, изменяя потенциал клеток почти на 30 %, менее выраженно – ионы кальция и цинка (на 20 и 18 % соответственно). Наименьшее влияние на величину дзета-потенциала оказывали ионы двухвалентного марганца, вызывая снижение его величины лишь на 7 %.
Дзета-потенциал клеток S. epidermidis 33 в среде LB, содержащей ионы двухвалентных металлов
|
Среда |
Дзета-потенциал, mV |
|
Контроль |
-21,0 ± 0,4 |
|
LB + 2,5 мМ Mg2+ |
-14,5 ± 1,0* |
|
LB + 2,5 мМ Ca2+ |
-16,7 ± 0,7* |
|
LB + 2,5 мМ Zn2+ |
-17,3 ± 0,6* |
|
LB + 2,5 мМ Mn2+ |
-19,5 ± 0,8* |
Примечание. * достоверное отличие от контроля (p < 0,05).
Таким образом, присутствие двухвалентных катионов в среде оказывает влияние на адгезию бактерий S. epidermidis, по-видимому, двумя путями: специфическим связыванием с белковыми молекулами и неспецифическим связыванием с отрицательно-заряженными группировками на поверхности бактериальных клеток, приводящее к изменению дзета-потенциала клеток.
Заключение
Известно, что двухвалентные катионы способны ингибировать образование биопленок бактериями вида S. aureus [11] и усиливать образование этих структур бактериями вида S. epidermidis [6; 10]. Однако результаты наших исследований показали, что влияние двухвалентных катионов как на сорбцию, так и на образование биопленок изученными нами штаммами S. epidermidis в большой степени зависит от концентрации ионов в среде инкубирования (рис. 1). При этом повышение содержания в среде одного из катионов Ca2+, Mg2+, Zn2+ или Mn2+ до 2,5 мМ в большинстве случаев приводит к ингибированию процессов бактериальной колонизации. Наиболее вероятным механизмом действия ионов металлов на адгезию бактерий S. epidermidis является изменение дзета-потенциала бактерий (таблица), ослабляющее их взаимодействие с атакуемой поверхностью.
Работа выполнена при поддержке Российского фонда фундаментальных исследований (проект № 14-04-00687), а также Министерства образования и науки Пермского края по реализации научных проектов международными исследовательскими группами ученых (соглашение № С-26/632).
Рецензенты:
Плотникова Е.Г., д.б.н., профессор, Пермский государственный национальный исследовательский университет, г. Пермь;
Горовиц Э.С., д.м.н., профессор, Пермский государственный медицинский университет имени академика Е.А. Вагнера, г. Пермь.
Работа поступила в редакцию 27.12.2014.



