В общей структуре травматизма по данным ВОЗ ожоги занимают третье место в мире. Ежегодно в развитых странах регистрируется 290–300 ожогов на 100 тыс. населения. В Российской Федерации ежегодно около 500 тыс. населения получают ожоги, в том числе 29–46 % из них нуждаются в госпитализации [1, 2, 3], в 5–7 % случаев причиной гибели пациентов является патология головного мозга [4, 5]. Удельный вес детей, пострадавших от термической травмы, составляет 13,8–75,3 % с высоким процентом летальности [6, 7, 8, 9, 10, 11]. Одной из основных причин высокой летальности при ожоговой болезни является возникновение генерализованной инфекции с последующим развитием полиорганной недостаточности [12, 13, 14, 15].
В связи с развитием полиорганного патологического процесса, отсутствием единой тактики лечения инфекционных осложнений, возникающих при ожоговой болезни, возникает необходимость более детального изучения влияния патогенной и условно патогенной микрофлоры на развитие патологического процесса при ожоговой болезни и совершенствования методов лечения пациентов с тяжелой термической травмой.
Цель исследований. На модели кроликов породы «шиншилла» изучить динамику развития инфекционного процесса, вызванную культивируемыми и некультивируемыми бактериями на фоне ожоговой травмы.
Задачи
1. В опытах на кроликах породы шиншилла выявить особенности течения инфекционного процесса, вызванного культивируемыми и некультивируемыми бактериями P. aeruginosa и S. aureus, на фоне ожоговой травмы, на основании клинических, микробиологических и гистологических исследований.
2. На модели экспериментальных животных, кроликов породы шиншилла, изучить влияние динамики транслокации культивируемых и некультивируемых бактерий на развитие инфекционного процесса.
3. Выявить особенности патологических изменений в организме лабораторных животных, вызванных культивируемыми и некультивируемыми бактериями на фоне ожоговой травмы.
Материалы и методы исследований
Динамику транслокации микробных популяций изучали в организме кроликов породы шиншилла. Под наблюдением находилось 2 группы животных по 16 кроликов в каждой группе. Одной группе животных на фоне ожоговой травмы вводили подкожно смесь культивируемых бактерий P. aeruginosa и S. aureus в концентрации 105 степени микробных клеток, а другой – некультивируемые бактерий P. aeruginosa и S.aureus в такой же концентрации. После предварительного наркоза по методике, предложенной А.В. Разиной [16], животным наносили термическую травму. Поверхность спины и боковые поверхности туловища кроликов погружали в водяную баню на 10 с при температуре 90 °С. Кролики получали ожоговую травму со степенью поражения IIIАБ. На ожоговой поверхности кроликов фиксировали перевязочный материал [17]. Средняя масса тела кроликов в исследуемых группах животных составила 2262,5 ± 28,4 и 2386,7 ± 48,5 грамм, а ожоговая поверхность – 15,98 ± 0,53 и 17,29 ± 0,4 % площади поверхности тела соответственно.
Для заражения кроликов использовали культуры бактерий P. aeruginosa и S. aureus, выделенные от больных, находящихся на лечении в ожоговом отделении ГБУЗ ТО «Областной клиническая больница № 1» г. Тюмени. Идентификацию бактерий проводили по общепринятым методикам, используя двухтомное руководство по определению бактерий [18]. Микробиологические исследования проводили в соответствии с требованиями приказа МЗ РФ № 535 «Об унификации микробиологических (бактериологических) методов исследований, применяемых в клинико-диагностических лабораториях лечебно-профилактических учреждений». Некультивируемые бактерии получали по методике, предложенной Л.Б. Козловым с соавт., используя хладотермостат [19, 20].
Опыты на кроликах проводили в виварии ФГБОУ ВПО «Государственный аграрный университет Северного Зауралья». Здоровых кроликов содержали в клетках в соответствии с требованиями санитарных правил (Утв. Главным государственным санитарным врачом № 1045-73).
Для выявления преморбидного фона за кроликами до проведения опыта наблюдали в течение 21 дня. После карантина кроликов помещали в экспериментальные клетки собственной конструкции [21] и в течение 3 дней наблюдали за животными (процесс адаптации животных к новым клеткам). В виварии поддерживали температуру воздуха 24–26 °С в соответствии с приказом МЗ РФ № 267 от 19.06.2003 и требованиями Европейской конвенции (Страсбург, 1986) по содержанию, кормлению и уходу за подопытными животными, выводу их из эксперимента и последующей утилизации.
В период эксперимента за кроликами проводили наблюдение в течение 21 дня. У погибших животных проводили вскрытие и исследование следующих органов: почек, легких, печени и головного мозга. Определяли в органах концентрацию культивируемых бактерий. Из органов готовили гистологические срезы и определяли наличие патологических изменений в органах. Для гистологических исследований внутренние органы фиксировали в 10 % растворе нейтрального формалина. Гистологические срезы готовили методом заморозки и заливки в парафин. Гистологические препараты окрашивали гематоксилином и эозином, суданом III (выявление капель жира), по Pero, Бесту (выявление гранул гликогена), скопление фибрина определяли по методу Д.Д. Зербино.
Статистическую обработку результатов исследования осуществляли с помощью компьютерной программы Statistikav 6.0, с использованием средней арифметической ошибки (М ± m). Все полученные данные статистически обрабатывали с определением критерия t Стьюдента и Вилкоксона – Манна – Уитни. Корреляционный анализ некоторых данных провели с помощью программного комплекса «Microsoft Exel-97» для IBM PC с вычислением коэффициента корреляции и его ошибки.
Результаты исследования и их обсуждение
Анализ проведенных исследований показал, что наблюдались существенные отличия в сроках гибели животных после подкожного введения культивируемых и некультивируемых бактерий P. aeruginosa и S. aureus на фоне ожоговой травмы (рис. 1). Гибель животных после введения некультивируемых бактерий наблюдалась в период с 18 часов по 13 сутки и достигала 87,5 % от числа животных взятых в опыт. Четыре кролика погибло в течение 23-х часов. Через 56 часов погибало 62,5 % животных. После введения культивируемых бактерий гибель животных регистрировалась с 12 по 15 день после термической травмы. Погибало 75,0 % животных.
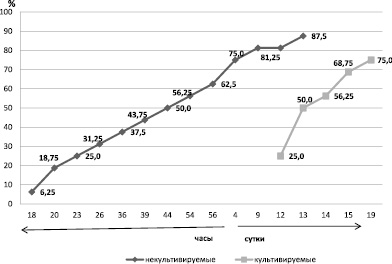
Рис. 1. Динамика гибели животных после подкожного введения культивируемых и некультивируемых бактерий S.aureus и P.aeruginosa на фоне ожоговой травмы
Микробиологические исследования внутренних органов животных показали, что у кроликов, погибших с 1 по 4 день после введения некультивируемых бактерий, инфекционный процесс был вызван культивируемыми бактериями P. aeruginosa. В печени кроликов, погибших в первый день инфекционного процесса, концентрация культивируемых P. aeruginosa составила 2,04 ± 0,3∙103 микробных клеток в 1 мл, а к 4-му дню болезни достигла 1,6 ± 0,06∙108 микробных клеток в 1 мл. Культивируемые бактерии S. aureus и E.coli в печени в течение первых суток выделить не удалось. Аналогичная тенденция увеличения концентрации P. aeruginosa отмечалась в легких и почках.
Микробиологические исследования внутренних органов животных после введения культивируемых бактерий P. aeruginosa и S. aureus на фоне ожоговой травмы показали, что в органах животных происходило увеличение концентрации P. aeruginosa в острой стадии ожоговой болезни.
У кроликов, погибших после подкожного введения культивируемых бактерий на фоне ожоговой травмы, температура тела повышалась за 4 дня до летального исхода до 39,8–40,7 °С, что характерно для развития инфекционного процесса.
Отмечались различия в типах температурных кривых у кроликов, инфицированных некультивируемыми бактериями на фоне термической травмы. У кроликов, погибших на 2–3 сутки, перед гибелью наблюдалось снижение температуры тела до 37,2–37,4 °С. Гибель кроликов в первые сутки (4 кролика) и снижение температуры тела кроликов перед гибелью характерно для шокового состояния. У кроликов, погибших на 4-е сутки, наблюдалась атипичная лихорадка с большими перепадами температуры в течение суток, достигающими 2–2,5 °С. Подобная динамика температурной кривой характерна для септических состояний. У животных, погибших на 11,0 ± 2,5 сутки, перед гибелью наблюдалось повышение температуры тела до 40,2–40,5 °С, что характерно для развития генерализованного инфекционного процесса.
Таким образом, температурная кривая у животных, инфицированных некультивируемыми бактериями, свидетельствует о различном патологическом процессе в организме животных в различные периоды ожоговой болезни.
Культивируемые бактерии на фоне ожоговой травмы вызывали клиническую симптоматику поражения желудочно-кишечного тракта на 12–15 день заболевания, а при введении некультивируемых бактерий в первые дни болезни у животных наблюдались симптомы поражения центральной нервной системы, в период с 4 дня болезни появилась клиническая симптоматика поражения желудочно-кишечного тракта.
При патологоанатомическом вскрытии животных, инфицированных некультивируемыми бактериями на фоне ожоговой травмы, отмечался отек головного мозга у 4 кроликов (28,6 %).
Клиническая симптоматика поражения головного мозга, развитие шокового состояния, гибель животных в течение первых двух суток и отек мозговой ткани при патологоанатомическом вскрытии согласуются с данными гистологических исследований. В гистологических срезах головного мозга погибших животных обнаружены признаки отека мягких мозговых оболочек, их утолщение, разрыхление волокнистых структур (рис. 2).
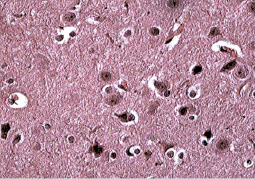
Рис. 2. Периваскулярный и перицеллюлярный отек головного мозга у кролика, погибшего после подкожного введения некультивируемых бактерий на фоне ожоговой травмы. Окр. ГЭ, х 40
В крупных оболочечных сосудах наблюдалось полнокровие, а в мелких – стаз. Наблюдался неравномерно выраженный перицеллюлярный отек мозговой ткани. В эндотелии сосудов наблюдались клетки с набухшими ядрами и со сморщиванием ядра вплоть до пикноза. Накапливались липиды в эндотелии сосудов и адвентициальных клетках. В отделах коры больших полушарий, мозжечка, в полосатом теле, ядрах зрительного бугра, субталамическом ядре Льюиса обнаружены различной формы некробиотические изменения нервных клеток. На рис. 2 видны дистрофически-дегенеративные изменения нервных клеток.
Анализ микробного пейзажа внутренних органов животных, инфицированных культивируемыми и некультивируемыми бактериями на фоне ожоговой травмы, согласуется с микробным пейзажем выделения культивируемых бактерий от больных с ожоговой болезнью. На ожоговой поверхности и в организме пациентов определялись условно-патогенные и патогенные бактерии, биопленкообразующие бактерии и их планктонная фракция, на поверхности ожоговой раны уже через 48 часов бактерии P. aeruginosa формировали биопленку [22, 23, 24, 25, 26].
В результате проведенных нами исследований установлено, что в различных стадиях инфекционного процесса в организме кроликов наблюдались изменения в соотношениях между количеством культивируемых и некультивируемых бактерий (рис. 3).
Непосредственно после введения некультивируемых бактерий при наличии благоприятных условий для размножения бактерий в организме кроликов происходил процесс перехода некультивируемых бактерий в культивируемое состояние. В остром периоде болезни в микробных популяциях преобладали культивируемые бактерии, а в период реконвалесценции происходило снижение в микробных популяциях концентрации культивируемых бактерий и увеличение количества некультивируемых бактерий.
В организме кроликов переход некультивируемых бактерий в культивируемое состояние происходил в течение 2–3 суток. В более поздний период наблюдался переход культивируемых бактерий в некультивируемое состояние под влиянием специфических и неспецифических защитных факторов макроорганизма. Бактерии теряли способность размножаться в различных биологических жидкостях животных. Формировалось определенное количество бактерий с признаками анабиоза.
На развитие патологических процессов в организме кроликов существенное влияние оказывала транслокация бактерий (рис. 4).
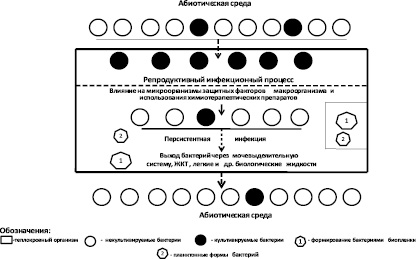
Рис. 3. Принципиальная схема изменчивости биопленкообразующих бактерий P. aeruginosa в организме кроликов породы шиншилла
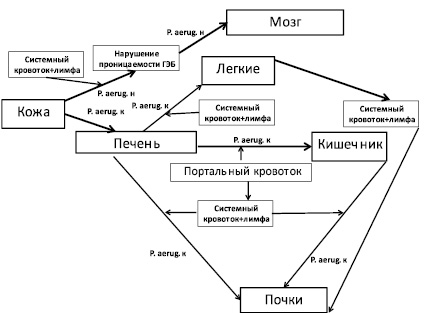
Рис. 4. Динамика транслокации P. aeruginosa в организме кроликов породы шиншилла после подкожного введения животным некультивируемых бактерий на фоне ожоговой травмы. Обозначения: P. aerug. н – некультивируемые бактерии P. aeruginosa; P. aerug. к – культивируемые бактерии P. aeruginosa
В течение первых двух суток некультивируемые бактерии P. aeruginosa из подкожных локусов при нарушении проницаемости гематоэнцефалитического барьера (ГЭБ) проникали в головной мозг животных.
Через 24–54 часа после подкожного введения некультивируемых бактерий P. aeruginosa лабораторным животным наблюдался переход их в культивируемое состояние и происходила транслокация культивируемых бактерий P. aeruginosa в печень из подкожных локусов. Из печени культивируемые бактерии P. aeruginosa проникали через портальный кровоток в легкие, почки и в кишечник.
Наличие культивируемых бактерий P. aeruginosa в выше перечисленных органах подтверждено результатами микробиологических исследований (табл. 1).
Таблица 1
Динамика изменения концентрации культивируемых P. aeruginosa во внутренних органах животных, инфицированных некультивируемыми бактериями на фоне ожоговой травмы
|
Сроки микробиологических исследований |
Количество бактерий в органах |
||
|
печень |
легкие |
почки |
|
|
20–23 часа |
2,04 ± 0,3∙103 |
3,96 ± 0,1∙103 |
1,8 ± 0,05∙103 |
|
4 день |
1,55 ± 0,06∙108 |
1,7 ± 0,05∙109 |
7,55 ± 0,04∙108 |
|
9–13 день |
7,8 ± 0,1∙109 |
3,6 ± 0,3∙108 |
3,75 ± 0,2∙105 |
|
21 день |
5,2 ± 0,02∙101 |
2,85 ± 0,14∙101 |
6,3 ± 0,03∙102 |
На 4–13 день болезни кроликов культивируемые бактерии синегнойной палочки начинали переходить в некультивируемое состояние и на 21 день, в стадии реконвалесценции, культивируемые бактерии P. aeruginosa в организме животных определялись в количестве 1–2 логарифма. Снижение концентрации культивируемой P. aeruginosa во внутренних органах животных в стадии реконвалесценции инфекционного заболевания свидетельствовало о переходе бактерий в некультивируемое состояние.
При проникновении P. aeruginosa в кишечник наблюдались дегенеративные изменения в слизистой оболочке кишечника (рис. 5).
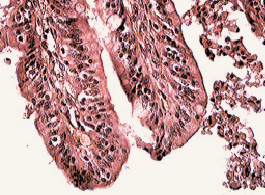
Рис. 5. Отсутствие слизистой оболочки в кишечнике у кролика, инфицированного некультивируемыми бактериями на фоне ожоговой травмы. Окр.ГЭ х 40
В кишечнике наблюдалось полнокровие сосудов подслизистого слоя и повреждение слизистой оболочки кишечника. В результате поражения кишечника микробами P. aeruginosa наблюдалась транслокация кишечной палочки из кишечника во внутренние органы животного. Подтверждением транслокации E. coli во внутренние органы животных служат результаты микробиологических исследований печени, легких и почек животных, погибших на 2–15 день после термической травмы (табл. 2).
Таблица 2
Динамика изменения концентрации культивируемой E. coli во внутренних органах животных, инфицированных некультивируемыми бактериями на фоне ожоговой травмы
|
Сроки микробиологических исследований |
Количество бактерий в органах |
||
|
печень |
легкие |
почки |
|
|
20–23 часа |
0 |
0 |
0 |
|
4 день |
3,15 ± 0,04∙106 |
0 |
0 |
|
9–13 день |
4,4 ± 0,4∙104 |
2,4 ± 0,2∙104 |
0 |
|
21 день |
0 |
0 |
0 |
Обозначения: 0 – культивируемые бактерии в органах не определялись.
В течение первых суток кишечная палочка во внутренних органах не определялась. Через 36 часов после введения некультивируемых бактерий на фоне ожоговой травмы количество культивируемой E. coli в печени составило 5,8∙103 и достигло максимальных показателей к 4 дню болезни кроликов (3,15 ± 0,04∙106). К 9–13 дню количество культивируемой кишечной палочки в печени уменьшилось до 4,4 ± 0,4∙104, а к 21 дню болезни, в стадии реконвалесценции, в печени культивируемых E. coli выделить не удалось. В почках кишечная палочка не определялась с 9 по 21 день исследования органов животных. Очевидно, в этот период в почках находилась некультивируемая кишечная палочка, то есть в стадии реконвалесценции наблюдался переход культивируемой E. coli в некультивируемое состояние.
Процесс транслокации кишечной палочки в организме кроликов представлен на рис. 6.
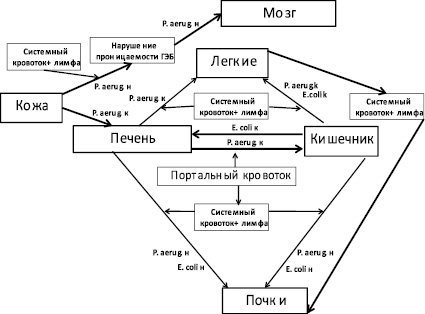
Рис. 6. Транслокация E. coli в организме кроликов породы шиншилла в результате повреждения эндотелия кишечника при инфекционном процессе, вызванном некультивируемыми бактериями на фоне ожоговой травмы. Обозначения: E. coli к – культивируемая культура кишечной палочки; E. coli н – некультивируемая культура кишечной палочки. P. aerug. н – некультивируемые бактерии P. aeruginosa; P. aerug. к – культивируемые бактерии P. aeruginosa
Проведенные исследования на кроликах породы шиншилла показали, что имеются различия в динамике развития инфекционного процесса на фоне ожоговой травмы, вызванного культивируемыми и некультивируемыми бактериями.
При развитии инфекционного процесса, вызванного культивируемыми бактериями на фоне ожоговой травмы, не наблюдалось поражение головного мозга на основании клинических и гистологических исследований (рис. 7), а транслокация синегнойной палочки и кишечной палочки с развитием инфекционного процесса в организме кроликов наблюдалась в более поздние сроки – на 12–15 день болезни.
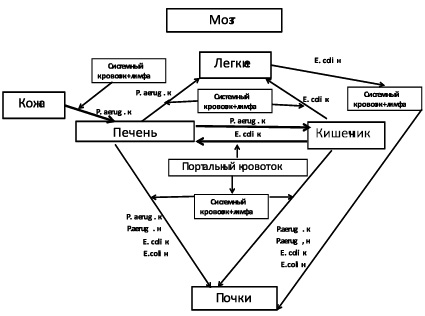
Рис. 7. Транслокация P. aeruginosa и E. coli в организме кроликов, инфицированных культивируемыми P. aeruginosa и S. aureus на фоне ожоговой травмы. Обозначения: P. aerug. н – некультивируемые бактерии P. aeruginosa; P. aerug. к – культивируемые бактерии P. aeruginosa; E. coli к – культивируемая культура кишечной палочки; E. coli н – некультивируемая культура кишечной палочки
Результаты проведенных исследований показали, что культивируемая и некультивируемая культуры S. aureus в инфекционном процессе не участвовали, очевидно, в результате однонаправленного антагонизма между синегнойной палочкой и стафилококком. Возможно, в присутствии синегнойной палочки культура S. aureus переходила в некультивируемое состояние.
Результаты наших исследований коррелируют с клиническими наблюдениями И.В. Шлык с соавт. [27]. При обследовании 262 больных, пострадавших от ожоговой травмы, осложненной сепсисом, установлено, что в динамике развития системного воспалительного ответа у больных с тяжелой термической травмой в начальном периоде болезни ведущую роль играла не только тяжесть термического поражения, но и инфекционный процесс при нарушении иммунной реактивности организма.
Поражение головного мозга при ожоговой болезни наблюдал С.В. Хрулев [28]. На основании морфометрических показателей компьютерных томограмм головного мозга установлены периоды поражения головного мозга: с 1 по 5 и с 16 по 18 день. Именно в эти сроки нами наблюдалась гибель экспериментальных животных и поражение головного мозга, вызванные подкожным введением некультивируемых бактерий P. aeruginosa.
Выводы
1. На основании клинических, микробиологических и гистологических исследований на лабораторных животных ожоговую болезнь следует рассматривать как полиорганное поражение организма с генерализованным инфекционным процессом в результате транслокации культивируемых и некультивируемых бактерий, сопровождающееся развитием токсического шока, сепсиса, поражением головного мозга с высоким процентом летального исхода заболеваний.
2. Культивируемые и некультивируемые бактерии на фоне ожоговой болезни оказывали различное влияние на клиническое течение и патогенез ожоговой болезни у кроликов, проявляющееся, прежде всего, в сроках развития инфекционного и патологического процессов и в возможности поражения головного мозга.
3. На динамику развития инфекционного процесса существенное влияние оказывала транслокация бактерий из подкожных локусов, а также из кишечника животных в результате повреждения слизистой оболочки кишечника возбудителем инфекционного заболевания.
Рецензенты:
Мальчевский В.А., д.м.н., главный научный сотрудник отдела протекторных механизмов репродуктивных систем криосферы, ФГБУН «Тюменский научный центр» (ТюмНЦ) СО РАН, г. Тюмень;
Разин М.П., д.м.н., профессор, заведующий кафедрой детской хирургии, Кировская государственная медицинская академия, г. Киров.
Работа поступила в редакцию 19.12.2014.



