Устойчивость к лекарственным средствам (лекарственная адаптация, фармакорезистентность (ФР), терапевтическая резистентность) является серьезной проблемой современной фармакологии и лекарственной терапии.
Диагностические критерии ФР – это ситуации, когда для адекватных, ранее хорошо действующих препаратов у аналогичных больных или данного больного нет ожидаемого эффекта при стандартных монотерапии или комбинации двух или нескольких лекарств.
К плохим прогностическим факторам в плане развития ФР относят: низкий ответ на первые дозы препарата, семейный анамнез, особые взаимодействия препаратов, некоторые сопутствующие заболевания.
Работы, связанные с изучением ФР, посвящены в основном исследованию терапевтической неэффективности в лечении больных с эпилептическими нарушениями [3], толерантности к антибактериальным и онкологическим лекарствам [2, 4]. Однако, в настоящее время эта проблема актуальна и для других заболеваний. В частности, для тяжело протекающих хронических дерматозов, когда длительное многолетнее лечение приводит к значительному снижению терапевтического эффекта от применяемых препаратов, а в ряде случаев он вообще отсутствует [7]. То же самое отмечено и для кислотозависимых заболеваний в гастроэнтерологии [2]. В кардиологии подобный эффект наблюдают при лечении ишемической болезни сердца (в том числе при сочетании с сахарным диабетом) такими антиагрегантами, как аспирин и клопидогрель [10, 11, 12].
Базовой причиной развития ФР [4] может быть то обстоятельство, что фармакологическое средство является для организма ксенобиотиком, «чужеродность» которого может приводить к противодействию в виде выработки «противоядия» (специфических антител, изменения активности соответствующих ферментов, чувствительности и специфичности мембранных рецепторов и т.п.).
В основе ФР могут лежать несколько механизмов, таких как фармакокинетический, фармакодинамический, иммунологический, нейроэндокринный, хронобиологический и др. Различают истинную и псевдофармакорезистентность.
Истинная ФР обусловлена особой генетически зависимой индивидуальной нечувствительностью больного к некоторым препаратам. Эта форма ФР достаточно редка.
Псевдофармакорезистентность (ПФР) ряд авторов относят на счет стандартной терапии, в течение которой развивается феномен постепенной адаптации к используемым препаратам, обозначаемой как вторичная, генетически не обусловленная, приобретенная ФР. Она встречается в клинической практике чаще, чем истинная ФР.
Процессы усвоения лекарственного средства (ЛС) и ответа на его воздействие представлены на рисунке.
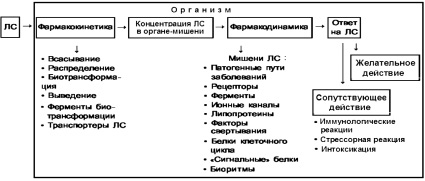
Соотношение фармакокинетики, фармакодинамики и ответа на лекарство и факторов, оказывающих на них влияние (в том числе и при фармакорезистентности). ЛС – лекарственное средство
ПФР в гастроэнтерологии, как упоминалось выше, особенно актуальна в отношении препаратов, применяемых для лечения кислотозависимых заболеваний (гастроэзофагеальной рефлюксной болезни, язвенной болезни желудка и двенадцатиперстной кишки). Имеются два основных направления в их лечении:
1) снижение кислотности в желудке и в пищеводе;
2) уничтожение (эрадикация) возбудителя Helicobacter pylori.
Для обоих направлений выявлена ФР; она проявляется в отсутствии положительного эффекта от лекарственного лечения, появлении новых симптомов, отрицательной динамике заживления повреждения слизистой оболочки.
Для снижения кислотности основной группой препаратов, применяемых в настоящее время, являются ингибиторы протонной помпы; родоначальник группы – омепразол. Для него и его производных существует понятие «омепразоловая резистентность», означающее поддержание кислотности в теле желудка ниже 4 на протяжении не менее 12 часов после двукратного приема стандартной дозы препарата. Такая ФР у взрослых в первые сутки приема препаратов колеблется от 25,7 до 42,4 %, а на четвертые сутки – от 5,6 до 27,8 % [2].
ПФР в кардиологии является большой проблемой при лечении ишемической болезни сердца и так называемой рефрактерной гипертензии [15]. То же самое наблюдается у ряда больных с тяжелым течением сердечной недостаточности, легочной гипертензией и легочно-сердечной недостаточностью [10, 13]. ПФР существенно повышает смертность больных, попытки ее преодоления заставляют искать новые пути лечения вплоть до применения нехирургических методов [9, 15].
ПФР у дерматологических больных проявляется снижением эффективности лекарственных воздействий и часто наблюдается при многолетних хронических процессах [9]. Это приводит к уменьшению сроков ремиссии заболевания и необходимости либо повышения дозы препаратов, либо назначения новых, далеко не безопасных средств.
Однако ФР на одни и те же препараты возникает не у всех больных. Поэтому актуальным является поиск маркеров, позволяющих выявить пациентов, у которых ФР разовьется с высокой долей вероятности.
Целью настоящего исследования явилось изучение и сопоставление уровня молекул средней массы и окисленно-модифицированных белков в плазме крови больных хроническими распространенными дерматозами (ХРД) как возможных маркеров ФР.
Материалы и методы исследования
Обследовано 68 больных хроническими распространенными дерматозами (ХРД), которые характеризуются значительной длительностью патологического процесса (до 20 лет и более), высокой частотой торпидности и резистентности к традиционно применяемым средствам. В группу обследованных вошли больные псориазом (ПС) и атопическим дерматитом (АД). Они были разделены на две группы. В первую, которая составила 32 человека, вошли пациенты с обычным течением заболевания и хорошим эффектом после проведенной комплексной терапии. Вторая группа включила 36 пациентов, у которых выявлялось почти универсальное поражение кожного покрова, непрерывно рецидивирующее течение, практически полное отсутствие «светлых» промежутков, недостаточная эффективность терапии метотрексатом (больные ПС), кортикостероидами (больные АД), десенсибилизирующими и антигистаминными препаратами, энтеросорбентами.
Все больные находились на стационарном лечении в отделении общей дерматологии Нижегородского филиала государственного научного центра дерматовенерологии и косметологии Минздрава России.
В сыворотке крови больных определяли уровень молекул средней массы (МСМ) по методу [5] количество окисленно-модифицированных белков (ОМБ) по методу [1]. Рассчитывали коэффициент К = МСМ/ОМБ.
Статистическая обработка данных осуществлялась стандартными параметрическими и непараметрическими методами вариационной статистики с применением критериев Стъюдента (t), знаков (z), Вилкоксона – Манна – Уитни, точного метода Фишера (ТМФ), χ2 (хи-квадрат). Достоверность различий признавалась при p < 0,05 и ниже.
Результаты исследования и их обсуждение
Как уже говорилось выше, основные механизмы развития ФР на сегодняшний день связывают с нарушениями на уровне систем биотрансформации и транспорта лекарственных средств. Причем эти нарушения, естественно, более выражены в случаях тяжелых, длительно протекающих заболеваний, к которым относится и ряд дерматозов. Участниками системы биотрансформации и транспорта являются специализированные белки. Это ферменты биотрансформации, осуществляющие реакции 1 и 2 фаз метаболизма ксенобиотиков; гликопротеин-Р – транспортный белок, основными функциями которого являются препятствие к всасыванию ксенобиотиков и ЛС в кишечнике, предотвращение их проникновения через гисто-гематический барьер и скорейшее выведение печенью и почками; транспортеры органических ионов. Кроме этого, ряд исследователей считает, что проблема ФР может быть связана с блокированием рецепторного аппарата клеток вследствие сорбции эндогенных токсинов в виде молекул средней массы [6] или нарушением проницаемости мембран вследствие изменения соотношения фосфолипидов или модификаций белок-липидных взаимодействий за счет переокисления белков и липидов, так называемой окислительной модификации белков и перекисного окисления липидов [1]
Чаще всего ЛС влияют на ферменты 1-й фазы биотрансформации – система цитохрома Р450, затем на активность глутатионтрансферазы и в меньшей степени, на функционирование гликопротеина-Р. При этом считается, что главными причинами межиндивидуальных различий фармакологического ответа являются генетические особенности пациента и совместно применяемые ЛС. Хотя роль наследственности в формировании индивидуального ответа на ЛС известна давно, понимание механизмов, связывающих генетические особенности пациента с изменением эффективности и безопасности фармакотерапии, стало возможным лишь к настоящему времени, в связи с развитием соответствующих методов молекулярной биологии и реализацией международной программы «Геном человека». Эти генетические факторы, как правило, представляют собой полиморфные участки генов, продукты которых так или иначе участвуют в осуществлении различных фармакокинетических и фармакодинамических процессов. В настоящее время достаточно хорошо изучен генетический полиморфизм изоферментов системы Р450, фермента глутатионтрансферазы и активно изучается генетическая детерминированность гликопротеина-Р. Гликопротеин-Р – рецепторный белок, который находится преимущественно в клетках слизистых оболочек органов ЖКТ и обеспечивает главный транспортный механизм выведения ЛС. Например, в случае применения дигоксина он осуществляет активную секрецию этого препарата в желчь и мочу. Снижение экспрессии гена MDR1 в кишечнике и почках должно приводить к снижению количества гликопротеина-Р в этих органах и, следовательно, к более полному всасыванию и замедленному выведению ЛС – субстратов гликопротеина-Р. В результате у носителей определенного генотипа вероятно значительное повышение концентрации ЛС – субстратов гликопротеина-Р в плазме крови, что может сопровождаться увеличением риска развития нежелательных лекарственных реакций (НЛР).
Ряд ЛС являются ингибиторами гликопротеина-Р (верапамил, спиронолактон, карведилол, хинидин, противогрибковые ЛС). При этом отмечается увеличение концентрации ЛС – субстратов гликопротеина-Р (за счет более полного всасывания и замедления выведения), а следовательно, увеличивается и риск развития НЛР. У гликопротеина-Р имеются и индукторы (экстракт зверобоя, рифампицин и др.), повышающие его активность, при этом отмечается снижение концентрации ЛС – субстратов гликопротеина-Р в плазме крови (за счет угнетения всасывания и ускорения выведения), а следовательно и недостаточная эффективность ЛС. Однако, в связи с трудоемкостью изучения этих показателей большое значение приобретают другие способы изучения биохимической основы ФР.
По результатам нашего клинико-лабораторного анализа было установлено, что в группе больных ХРД с хорошим эффектом от проведенной комплексной терапии значения коэффициента К = МСМ/ОМБ < 0,4 выявлены у 62,5 % обследованных. Коэффициент от 0,4 до 0,5 определялся у 18,8 %, а больше 0,5 – у 18,7 %. В группе больных с тяжелым, резистентным течением заболевания значения этого коэффициента больше 0,5 были у 45,0 % больных, от 0,4 до 0,5 – у 25,0 % и меньше 0,4 – у 30,0 %. Статистическая обработка полученных данных показала высоко достоверное распределение по группам больных (χ2 = 5,73 с одной степенью свободы; р = 0,017). Сопоставление полученных данных с клинической картиной заболевания позволило предположить, что значение К = МСМ/ОМБ < 0,4 соответствовало адекватной реакции организма больного на проводимую терапию, значение > 0,5 – резистентности к используемой терапии, значение от 0,4 до 0,5 – возможной резистентности к используемой терапии. То есть в группе с тяжелым, резистентным течением заболевания возможность ФР выявлялась у 70,0 % больных.
Таким образом, сопоставление уровня молекул средней массы и окисленно-модифицированных белков показало, что эти компоненты плазмы крови могут быть маркерами фармакорезистентности.
Рецензенты:Клеменов А.В., д.м.н., профессор, консультант, ГБУ «Городская клиническая больница № 30», г. Нижний Новгород;
Обухова Л.М., д.б.н., доцент кафедры биохимии им. Г.Я. Городисской, ФГОУ ВПО «Нижегородская государственная медицинская академия», г. Нижний Новгород.
Работа поступила в редакцию 25.12.2014.



