Флавоноиды являются важной группой биологически активных веществ, присутствующей во всех видах лекарственного растительного сырья. Они обуславливают наличие у растений широкого спектра фармакологического действия: седативного, противовоспалительного, кровоостанавливающего, противоязвенного, желчегонного, капилляроукрепляющего. В то же время известно, что флавоноиды практически нетоксичны [1].
Известно, что химический состав травы пиона уклоняющегося (Paeonia anomala L.) представлен группами биологически активных веществ (БАВ): монотерпеновыми гликозидами, флавоноидами, дубильными веществами и др. [2].
Недостаточные объемы заготовок пиона уклоняющегося обуславливают целесообразность проведения исследований по внедрению в медицинскую практику нового вида лекарственного сырья – травы пиона садовых сортов.
Целью нашей работы являлась разработка методики количественного определения суммы флавоноидов в траве пиона садового.
Материалы и методы исследования
Для анализа использовали 1 образец травы пиона уклоняющегося и 6 образцов травы пиона садовых сортов, заготовленные: в Пермском крае, в Челябинской, Свердловской областях и в Удмуртской Республике.
Для проведения качественного анализа навеску измельченного до размера частиц 1 мм воздушно-сухого сырья заливали 70 % этанолом в соотношении 1:10 и кипятили на водяной бане с обратным холодильником в течение 30 минут. Полученное извлечение охлаждали, фильтровали через бумажный фильтр и использовали для проведения характерных для флавоноидов качественных реакций: проба Синода, проба Брианта, реакция с 2 % раствором хлорида алюминия, 1 % раствором ацетата свинца основного, 10 % раствором натрия гидроксида.
В качестве отправной точки для разработки методики количественного определения флавоноидов в траве пиона уклоняющегося и пиона садового использовали методику количественного определения суммы флавоноидов в траве зверобоя спектрофотометрическим методом, по реакции комплексообразования с 2 % спиртовым раствором алюминия хлорида [3].
Статистическую обработку результатов исследований проводили по общепринятым методикам ГФ XII издания и с помощью программы Microsoft Excel [5].
Результаты исследования и их обсуждение
В результате проведения качественных реакций получены характерные результаты реакций во всех изучаемых образцах, подтверждающие присутствие флавоноидов.
При исследовании всех образцов методом бумажной хроматографии на хроматограммах в видимом свете окрашенные зоны отсутствуют. В ультрафиолетовом свете выявлено 5 пятен с голубой, фиолетовой, светло-коричневой, темно-коричневой флюоресценцией при хроматографировании в системе уксусная кислота:вода (15:85) и 3 пятна с фиолетовой, светло- и темно-коричневой флюоресценцией – в системе бутанол : уксусная кислота:вода (4:1:2). Флюоресценция усиливалась после обработки хроматограмм 25 % раствором аммиака. Окрашивание пятен 1, 2, 3 в желтый цвет после обработки 2 % спиртовым раствором алюминия хлорида при хроматографировании в системе уксусная кислота : вода и 2, 3 – в системе бутанол : уксусная кислота : вода показало, что пятна имеют флавоноидную природу. Пятна 4, 5 не изменили своей окраски. Для полученных пятен рассчитывали значения Rf. Пятно 3 со значением Rf = 0,68 ± 0,03 идентифицировано относительно свидетеля как рутин (0,67 ± 0,03), а пятно 1 со значением Rf = 0,0,10 ± 0,03 идентифицировано относительно свидетеля как кверцетин (0,09 ± 0,03). Хроматографическая характеристика водно-спиртовых извлечений из травы пиона садовых сортов приведена в табл. 1.
Таблица 1
Хроматографическая характеристика водно-спиртовых извлечений из травы пиона садовых сортов в системе растворителей уксусная кислота:вода (15:85)
|
№ пятна |
Значение Rf |
В УФ-свете |
В УФ-свете после обработки парами аммиака |
После обработки раствором алюминия хлорида |
|
1 |
0,10 |
светло-коричневая |
желто-коричневая |
желтая |
|
2 |
0,42 |
темно-коричневая |
желто-коричневая |
желтая |
|
3 |
0,68 |
светло-коричневая |
желто-коричневая |
желтая |
|
4 |
0,75 |
фиолетовая |
ярко-фиолетовая |
фиолетовая |
|
5 |
0,83 |
голубая |
ярко-голубая |
голубая |
Исследования показали, что в системе бутанол:уксусная кислота:вода (4:1:2) пятна флавоноидов не имели четких границ и интенсивной флюоресценции в отличие от хроматографической картины в системе уксусная кислота:вода (15:85).
Таким образом, оптимальным условием для хроматографирования является система растворителей уксусная кислота:вода (15:85). По значениям Rf нами идентифицированы рутин и кверцетин. Установлена идентичность люминесцентно-хроматографических характеристик извлечений из травы пиона уклоняющегося и пиона садового.
Для проведения количественного определения биологически активных веществ спектрофотометрическим методом предварительно определена длины волны (λmax) с максимальным значением оптической плотности исследуемого раствора. Реакция комплексообразования флавоноидов с хлоридом алюминия в слабокислой среде наиболее избирательна, специфична и дает стабильные результаты, в частности, при определении сложных растительных объектов, содержащих окрашенные сопутствующие вещества [4]. Эта реакция положена в основу разрабатываемой нами методики количественного определения суммы флавоноидов в надземной части пиона садового.
В результате определения спектральной характеристики извлечений из травы пиона садового, полученных исчерпывающей экстракцией 70 % этанолом, установлено, что максимум находится в области 255 нм (рис. 1).

Рис. 1. Спектр поглощения спиртового извлечения травы пиона садового
Для установления аналитической длины волны получали комплекс извлечения из травы пиона с 2 % раствором хлорида алюминия, максимум поглощения наблюдается при λmax = 405 нм. Близкий по значению максимум поглощения (λmax) комплекса рутина с 2 % раствором хлорида алюминия позволяет выбрать его в качестве стандартного образца. Спектры поглощения комплекса с алюминия хлоридом флавоноидов и рутина представлены на рис. 2.
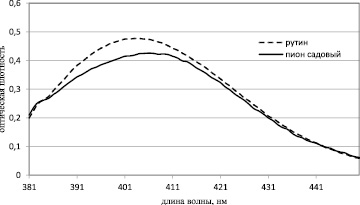
Рис. 2. Спектр поглощения комплекса флавоноидов травы пиона садового и ГТО рутина с алюминия хлоридом
Таблица 2
Результаты определения оптимального экстрагента для извлечения флавоноидов из травы пиона садового
|
Экстрагент |
Содержание флавоноидов, % |
|
Вода |
1,10 ± 0,02 |
|
20 % этанол |
1,37 ± 0,03 |
|
30 % этанол |
1,39 ± 0,05 |
|
40 % этанол |
1,48 ± 0,03 |
|
50 % этанол |
1,53 ± 0,02 |
|
70 % этанол |
1,73 ± 0,05 |
|
90 % этанол |
1,70 ± 0,03 |
В методиках количественного определения большинства флавоноидов и других биологически активных веществ для извлечения используются водно-спиртовые растворы различной концентрации. Нами в качестве экстрагента использованы вода и водно-спиртовые растворы 20 %, 30 %, 40 %, 50 %, 70 %, 90 % концентрации. В ходе эксперимента установлено, что оптимальным экстрагентом является 70 % этанол. Результаты представлены в табл. 2.
Размер частиц так же оказывает влияние на процесс экстрагирования, т.к. от него зависит поверхность раздела фаз между сырьем и экстрагентом. Нами изучена степень измельчения сырья от 0,5 до 3 мм. Результаты показали, что наиболее полный выход флавоноидов происходит из сырья с размером частиц 1 мм (1,94 ± 0,05).
Следующим фактором, влияющим на степень извлечения флавоноидов из сырья, является соотношение «твердое тело – жидкость». Исследование проводили при соотношениях сырья и экстрагента 1:5, 1:10, 1:15, 1:20. Экспериментальные данные свидетельствуют о том, что максимальный выход флавоноидов наблюдается при соотношении 1:10 (1,82 ± 0,04 %).
Для определения продолжительности экстракции изучено время наступления равновесной концентрации в системе сырье-экстрагент. Для этого серию навесок сырья травы пиона садового настаивали с учетом ранее установленных параметров до прекращения прироста концентрации флавоноидов. Определение проводили через каждые 10 минут. Результаты исследований показали, что равновесная концентрация устанавливается через 30 минут.
С целью максимального извлечения биологически активных веществ из растительного материала, проводили определение количества ступеней экстракции и времени наступления равновесной концентрации на каждой из них. Равновесная концентрация на второй и третьей ступени наступала также через 30 минут.
При проведении спектрофотометрического определения величина оптической плотности должна находиться в пределах от 0,2 до 0,7. Поэтому нами изучено соотношение извлечения и 2 % раствора алюминия хлорида. Разведения готовили в мерной колбе вместимостью 25 мл в соотношениях 1:1, 1:2, 1:3 (табл. 3).
Таблица 3
Зависимость оптической плотности от соотношения объема извлечения и 2 % раствора алюминия хлорида
|
Соотношение |
Оптическая плотность |
Содержание суммы флавоноидов, % |
|
1:1 |
0,175 |
1,82 |
|
1:2 |
0,223 |
2,37 |
|
1:3 |
0,180 |
1,90 |
Из данных таблицы следует, что оптимальным является соотношение извлечения и 2 % раствора алюминия хлорида 1:2.
Таблица 4
Изменение оптической плотности комплекса с раствором алюминия хлорида во времени
|
Время |
Оптическая плотность |
Содержание флавоноидов, % |
|
10 мин |
0,204 |
2,13 |
|
20 мин |
0,205 |
2,14 |
|
30 мин |
0,212 |
2,22 |
|
40 мин |
0,211 |
2,21 |
|
50 мин |
0,211 |
2,21 |
|
60 мин |
0,211 |
2,21 |
|
1,5 часа |
0,206 |
2,15 |
Для определения времени устойчивости комплекса измеряли величину оптической плотности фотометрируемого раствора через каждые 10 минут в течение 1 часа с момента получения комплекса, а также через 1,5 часа. Как показывают данные, представленные в табл. 4, стабильность эффекта реакции наблюдается через 40 минут с момента получения комплекса флавоноидов с хромогенным реагентом и сохраняется в течение часа, через 1,5 часа она незначительно изменяется. Изменение величины оптической плотности, очевидно, связано с окислительно-восстановительными процессами, но на результаты анализа не оказывающими существенного влияния.
Методика количественного определения суммы флавоноидов в траве пиона: сырье измельчают до размера частиц, проходящих через сито с отверстиями диаметром 1 мм. Около 1 г (точная навеска) измельченного сырья помещают в колбу со шлифом вместимостью 100 мл, прибавляют 30 мл 70 % этанола. Колбу присоединяют к обратному холодильнику и нагревают на кипящей водяной бане в течение 30 минут, периодически встряхивая для смывания частиц сырья со стенок. Горячее извлечение фильтруют через ватный тампон в мерную колбу вместимостью 100 мл, фильтр с попавшими на него частицами сырья помещают в колбу для экстрагирования. Экстракцию повторяют еще дважды в тех же условиях, фильтруя извлечение в ту же мерную колбу. После охлаждения объем извлечения доводят до метки 70 % этанолом и перемешивают (раствор А).
В мерную колбу вместимостью 25 мл помещают 1 мл раствора А, прибавляют 2 мл 2 % раствора алюминия хлорида в 95 % этаноле, 1 каплю разведенной уксусной кислоты и доводят объем раствора до метки 95 % этанолом. Через 40 минут измеряют оптическую плотность раствора на спектрофотометре при длине волны 405 нм в кювете с толщиной слоя 10 мм. В качестве раствора сравнения используют следующий раствор: 1 мл извлечения (раствор А) помещают в мерную колбу вместимостью 25 мл, прибавляют 1 каплю разведенной уксусной кислоты и доводят объем раствора 95 % этанолом до метки.
Параллельно измеряют оптическую плотность раствора Государственного стандартного образца (ГСО) рутина, приготовленного аналогично испытуемому раствору.
Содержание суммы флавоноидов в пересчете на рутин и абсолютно сухое сырье в процентах (X) вычисляют по формуле:
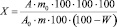 ,
,
где А – оптическая плотность испытуемого раствора; А0 – оптическая плотность раствора ГСО рутина; m – масса сырья в граммах; m0 – масса ГСО рутина в граммах; W – потеря в массе при высушивании сырья в процентах.
Для определения относительной ошибки метода проводили серию опытов по приведенной выше методике. Результаты статистической обработки полученных данных представлены в табл. 5.
Таблица 5
Метрологические характеристики количественного определения суммы флавоноидов в траве пиона садового
|
N |
X |
S2 |
S |
Sx |
P, % |
T(P,f) |
Σ, % |
|
10 |
2,403 |
0,000757 |
0,02751 |
0,008699 |
95 |
2,26 |
2,59 |
Относительная ошибка единичного определения с доверительной вероятностью 95 % составляет 2,59 %. Результаты проведенных исследований подтверждают воспроизводимость методики.
Выводы
1. В результате проведения качественных реакций в образцах травы пиона садовых сортов подтверждено присутствие флавоноидов. Методом бумажной хроматографии в системе уксусная кислота:вода (15:85) идентифицированы рутин и кверцетин.
2. На основании проведенных исследований установлена возможность оценки качества травы пиона по сумме флавоноидов в пересчете на рутин. Определены условия проведения количественного анализа травы пиона: экстрагент 70 % этанол, степень измельчения сырья 1 мм, соотношение сырья и экстрагента 1:10, трехкратная экстракция по 30 минут. Оптимальное значение оптической плотности при длине волны λmax = 405 нм наблюдается при соотношении извлечения и 2 % раствора хлорида алюминия 1:2, время устойчивости комплекса от 40 до 60 минут.
3. Разработана методика количественного определения флавоноидов в сырье спектрофотометрическим методом. Методика обладает хорошей воспроизводимостью. Относительная ошибка метода, при доверительной вероятности 95 %, не превышает 2,59 %.
Рецензенты:Пулина Н.А., д.фарм.н., доцент, заведующая кафедрой фармацевтической технологии, ГБОУ ВПО «Пермская государственная фармацевтическая академия Минздрава России», г. Пермь;
Белоногова В.Д., д.фарм.н., профессор, заведующая кафедрой фармакогнозии с курсом ботаники ГБОУ ВПО «Пермская государственная фармацевтическая академия Минздрава России», г. Пермь.
Работа поступила в редакцию 05.12.2014.



