Одной из наиболее древних, эволюционно сложившихся и сложноустроенных биологических систем у человека является система редокс-гомеостаза, главным компонентом которой является сеть ферментов антиоксидантной защиты (АОЗ), контролирующих течение, направленность и интенсивность процессов свободнорадикального окисления (СРО) в органах и тканях и обеспечивающих приспособление организма к изменяющимся условиям внешней среды [1]. Около 90 % потребляемого человеком молекулярного кислорода вовлекаются в реакции окислительного фосфорилирования, при этом образуются в небольших концентрациях свободные радикалы, которые участвуют в регуляции роста и дифференцировки клеток [2; 5]. Повышение уровня свободнорадикального окисления приводит к быстрому разрушению клеточных структур в результате их повреждения; происходит нарушение окислительно-восстановительного статуса клеток, получивший название окислительный стресс, который выступает как одно из патогенетических звеньев канцерогенеза [8]. Эритроцит – один из важнейших носителей информации о процессах, протекающих в тканевых структурах. Его мембрана контактирует с опухолевой тканью, что приводит к нарушению метаболизма эритроцитов, в результате чего снижается их жизнеспособность, изменяется морфофункциональное состояние [3]. Использование перевиваемых опухолей, в частности асцитной опухоли яичников крыс (АОЯ), позволяет четко отслеживать стадии канцерогенеза. Целью исследования явилось изучение про- и антиоксидантного статуса эритроцитов при прогрессировании экспериментального рака яичников.
Материалы и методы исследования
Экспериментальные исследования проведены на белых беспородных крысах массой 180–200 г. с перевиваемой асцитной опухолью (штамм РЯ, РОНЦ им. Н.Н. Блохина, г. Москва). Прогрессирование данного типа опухоли проходит в 3 фазы: логарифмическая (с 4-суток после перевивки), стационарная (с 8-суток после перевивки), терминальная стадия (с 13 суток после перевивки). Материалом для исследований послужили эритроциты крыс в стационарную (n = 22) и в терминальную фазу роста опухоли (n = 22) . Контрольную группу составили здоровые половозрелые крысы (n = 24). Для оценки продуктов липопероксидации ЛПО в гемолизате эритроцитов (1:10) оценивали уровень диеновых конъюгатов (ДК) – при Е232/220 нм, кетодиенов (КД) – при Е278/220 нм, шиффовых оснований (ШО) – при Е400/220 нм. по методу Волчегорского И.А. (1989). Содержание ТБК-активного продукта перекисного окисления липидов (ПОЛ) – малонового диальдегида (МДА) оценивали в тесте с тиобарбитуровой кислотой по методу Андреевой Л.И. (1988). Для оценки ферментативного звена антиоксидантной системы (АОЗ) изучали активность супероксиддисмутазы (СОД) по методу Nishikimi M. (1972), каталазы и глутатион-S-трансферазы (ГТ) по методу Карпишенко А.И. (1999). Исследования форм и размеров эритроцитов проводилось методом атомно-силовой микроскопии (АСМ) Solver Pro (NT-MDT, Зеленоград, Россия) в полуконтактном режиме, использовались фирменные кремниевые зонды с жесткостью 0,2 N/m, радиус закругления кончика зонда примерно 50 нм. Поскольку распределение в выборках отличалось от нормального, для оценки достоверности различий между группами использовали непараметрический критерий Манна-Уитни (Statav.6.0). Различия считались статистически значимыми при р ≤ 0,05 от уровня контрольной группы.
Результаты исследования и их обсуждение
Известна роль СОД в поддержании уровня активных форм кислорода (АФК) в клетке. СОД в качестве начального звена защиты от супероксиданионов ускоряет реакции превращения кислородного радикала (супероксид ОО) в перекись водорода и молекулярный кислород [4]. В нашем исследовании установлена тенденция к повышению СОД как в стационарную, так и в терминальную фазу (табл. 1).
Таблица 1
Активность ферментов АОЗ в эритроцитах при экспериментальном РЯ(M ± m)
|
Ферменты АОС |
Контроль n = 24 |
Стац. фаза n = 22 |
Терм. фаза n = 22 |
|
СОД, усл.ед./гр Hb |
1,178 ± 0,064 |
1,245 ± 0,075 |
1,372 ± 0,122 |
|
Каталаза,ммоль/мин/гр Hb |
10,37 ± 0,890 |
16,13 ± 1,140* |
13,16 ± 1,242* |
|
ГТ, ммоль/мин/гр Hb |
0,063 ± 0,003 |
0,087 ± 0,005* |
0,076 ± 0,007* |
Примечание: * – р ≤ 0,05; данные, статистически значимо отличающиеся от контроля.
Нами установлено статистически значимое увеличение уровня каталазы и ГТ в эритроцитах в стационарную фазу и незначительное снижение их активности в терминальную фазу (табл. 1).Однако имеющие более высокие значения, чем в контрольной группе.
Диеновые конъюгаты (ДК) являются первичными продуктами ПОЛ. При свободнорадикальном окислении арахидоновой кислоты происходит отрыв водорода в α-положении по отношению к двойной связи, что приводит к перемещению этой двойной связи с образованием ДК [7]. Диеновые конъюгаты, являющиеся первичными продуктами ПОЛ, относятся к токсическим метаболитам, которые оказывают повреждающее действие на липопротеиды, белки, ферменты и нуклеиновые кислоты. Шиффовы основания (ШО) образуются в результате обратимой реакции между карбонильной группой альдегида или кетона со свободной аминогруппой. Непрерывное накопление оснований Шиффа дестабилизирует мембраны и способствует деструкции клеток [6]. Изучение уровня продуктов ЛПО в эритроцитах интактных животных показало, что в стационарную и терминальную фазы роста опухоли выявлены изменения концентраций ДК, КД, ШО (рис. 1).

Рис. 1. Содержание продуктов ЛПО при прогрессировании экспериментального РЯ: ДК-диеновые конъюгаты; КД-кетодиены; ШО-шиффовы основания
Наиболее выраженное увеличение в динамике роста асцитной опухоли яичников отмечается в группе первичных продуктов ДК. Малоновый диальдегид является вторичным продуктом перекисного окисления липидов, увеличение которого провоцирует синдром интоксикации, он сшивает молекулы липидов и понижает текучесть мембраны (вследствие этого мембрана становится более хрупкой, нарушаются процессы, связанные с изменением поверхности мембраны: фагоцитоз, пиноцитоз, клеточная миграция [6]. Нами установлено повышение уровня МДА в эритроцитах в стационарную фазу роста опухоли до 6,696 ± 0,801 мкмоль/гр Hb в сравнении с контролем 4,379 ± 0,611 мкмоль/гр Hb. В терминальную фазу уровень МДА в эритроцитах также увеличен и составляет 7,197 ± 0,501 мкмоль/гр Hb. (рис. 2).
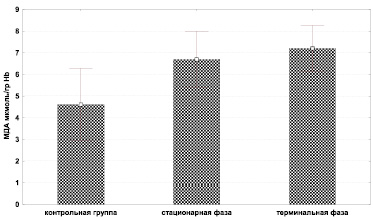
Рис. 2. Концентрация продукта МДА при прогрессировании экспериментального РЯ
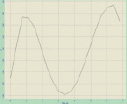
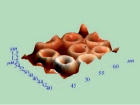
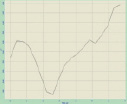
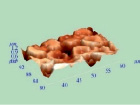
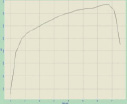
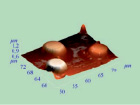
Метод АСМ предоставляет возможность изучать параметры клеток, не прибегая к длительной и сложной фиксации, тем самым минимально искажая получаемую информацию. АСМ позволяет измерять упругие свойства поверхности клеток [9]. Также АСМ обеспечивает получение пространственного изображения поверхности. На рис. 3–5 представлены топология, боковое сечение профиля и изображение в 3D эритроцитов здорового животного и животных-опухоленосителей. При сканировании образцов интактных эритроцитов методом АСМ в основном обнаруживается с типичной дисковидной формой нормоциты (рис. 3). В стационарную фазу цитоархитектоника эритроцитов меняется. На сканированном снимке появляются обратимо деформированные формы – эхиноциты (рис. 4). Их появление в физиологических условиях связано с изменением ионной проницаемости мембраны, с нарушением работы каналов. В терминальную фазу у животных-опухоленосителей практически все эритроциты представляют собой сфероциты. Они могут быть неправильной формы с измененными линейными размерами (рис. 5). Таким образом, в стационарную и терминальную фазу у животных-опухоленосителей изменяется содержание обратимо и необратимо измененных форм эритроцитов. Эритроциты увеличивает гемолиз, что снижает дыхательную функцию крови и усугубляет гипоксию у животных-опухоленосителей.

а б в
Рис. 3. Топология (а), боковое сечение профиля (б) и изображение в 3D (в) интактных эритроцитов

а б в
Рис. 4. Топология (а), боковое сечение профиля (б) и изображение в 3D (в) эритроцитов в стационарную фазу

а б в
Рис. 5. Топология (а), боковое сечение профиля (б) и изображение в 3D (в) эритроцитов в терминальную фазу
Заключение
Таким образом, в стационарную фазу роста АОЯ на фоне увеличения липопероксидации и активности ферментов АОЗ система редокс-гомеостаза переходит на более высокий уровень функционирования. В терминальную фазу при продолжающемся накоплении продуктов окисления липидов наблюдается некоторое угнетение активности каталазы и ГТ, что может свидетельствовать о снижении адаптивных реакций антиоксидантного статуса эритроцитов и развитии окислительного стресса. Методом АСМ показано изменение цитоархитектоники эритроцитов и преобладание эхиноцитов в стационарную фазу и сфероцитов в терминальную фазу. Все эти морфофункциональные изменения эритроцитов в динамике экспериментального канцерогенеза приводят к гипоксии в организме для опухоленосителя и усилению паранеопластических процессов.
Работа выполнена в рамках гос. задания МИНОБРНАУКИ России.
Рецензенты:Каталымов Л.Л., д.б.н., профессор кафедры анатомии, физиологии и гигиены человека и животных ФГБОУ ВПО «Ульяновский государственный педагогический университет им. И.Н. Ульянова», г. Ульяновск;
Любин Н.А., д.б.н. профессор, заведующий кафедрой морфологии, физиологии и патологии животных ФГБОУ ВПО «Ульяновской государственной сельскохозяйственной академии имени П.А. Столыпина», г. Ульяновск.
Работа поступила в редакцию 05.12.2014.



