В практическом отношении основными экономически приемлемыми и наиболее освоенными на данный момент источниками рения являются продукты и полупродукты, полученные при переработке молибденового и медного сульфидного сырья. [1]
Переработка ренийсодержащего рудного медного и молибденового сырья основана на различных пирометаллургических процессах. В условиях высоких температур рений возгоняется из рудного сырья с газовым потоком в виде легколетучего оксида Re2О7 [1]. При мокрой очистке технологических газов (смесь электропечных и конвертерных), поступающих в сернокислотное производство, до 50 % рения переходит в промывную серную кислоту. Переработка промывной кислоты с получением товарного перрената аммония основана на процессах сорбции и экстракции.
При этом на операциях получения перрената аммония некоторое количество рения (5,6 %) и сопутствующего рению осмия в восстановленной форме выделяется в самостоятельный промпродукт – межфазные осадки. Среднее содержание рения в промпродукте составляет 131,6 кг/т [2, 3]. Осадок сорбционной технологии представляет рыхлую рассыпчатую массу, экстракционной – мазуто-, смоло- или гудроноподобную [4].
Технологии извлечения осмия и рения из межфазных осадков основаны на окислении различных малорастворимых соединений элементов с целью перевода в газовую фазу либо в раствор. На данном принципе построена схема переработки осадков, по которой межфазный осадок переводят в сернокислый раствор и обрабатывают дихроматом калия, взятом в избытке для максимальной отгонки осмия и перевода рения в раствор. В результате образуются хромсодержащие растворы с концентрацией рения до 1,3 г/л на фоне высоких концентраций хрома, селена и серной кислоты. Согласно данным работы [5] показатели извлечения рения из сернокислых растворов низкоосновным анионитом Purolite A170 в присутствии ионов хрома и селена существенно снижаются.
Цель исследования. Высокое содержание рения в растворах от переработки межфазных осадков определяет необходимость извлечения рения из этих растворов. В связи с этим были изучены характеристики сорбции рения из сернокислых растворов низкоосновными анионитами Cybber с различными функциональными группами и типом матрицы (табл. 1).
Материалы и методы исследования
Предварительное кондиционирование ионитов проводилось по следующей методике. Анионит обрабатывали 1 н. раствором NaCl в течение 2–4 часов, затем промывали водой и помещали в 1 н. раствор NaOH. По истечении 2–4 часов анионит промывали водой и повторяли описанный цикл. После чего анионит переводили в требуемую форму выдержкой в подготовленном растворе в течение суток. Затем раствор декантировали и промывали сорбент водой до слабокислой реакции.
Таблица 1
Характеристика анионитов CYBBER
|
№ п/п |
Характеристика |
Наименование сорбента |
||||
|
EV009 |
EV011 |
ALX260 |
ALX220 |
SX002 |
||
|
1 |
Функциональная группа |
Полиамин |
Полиамин |
Третичный амин |
Третичный амин |
Третичный |
|
2 |
Тип матрицы |
Макропористая |
Макропористая |
Гелевая |
Макропористая |
Макропористая |
|
3 |
Общая обменная емкость, мэкв/л |
7,0 |
9,0 |
1,6 экв/л |
≥ 1,45 экв/л |
1,7 экв/л |
|
4 |
Размер гранул, мм |
0,315–1,25 |
0,315–1,25 |
0,45–1,20 |
0,60–1,20 |
0,71–1,25 |
|
5 |
pH диапазон |
1–9 |
– |
0–8 |
0–8 |
1–9 |
Емкостные свойства сорбентов изучались в статических условиях на модельных и реальных технологических растворах. В статике навеску сорбента массой 2 г обрабатывали в течение определенного времени раствором объемом 100 мл, содержащим рений, при заданной температуре. Перемешивание осуществлялось в закрытых конических колбах на механическом встряхивателе. Предварительные эксперименты показали, что время, необходимое для установления равновесия при работе на всех исследованных сорбентах, составило 5 часов. Модельные растворы содержали 0,05–0,5 г/л рения, вводимого в виде перрената калия. При изучении кинетики сорбции были использованы растворы с исходным содержанием 0,05 г/л рения и концентрации серной кислоты 200 г/л. Скорость перемешивания устанавливалась в диапазоне 50–150 об/мин. В реальных растворах содержание основных элементов колебалось в пределах (г/л): 150–200 H2SO4, 20–80 Сr; 2,5–5,0 Se, 0,1–1,3 Re. Десорбцию рения проводили раствором аммиака объемом 50 мл. Растворы после сорбции анализировали на содержание рения. Состав полученных растворов изучался с использованием масс-спектрометрии с индукционно-связанной плазмой (ICP-MS) на спектрометре Spectrace 5000 Tracor X–ray и атомно-абсорбционным методом.
Результаты исследования
и их обсуждение
Изотермы сорбции были сняты при варьировании исходной концентрации рения в растворе от 0,05 до 0,5 г/л и концентрации серной кислоты в растворах 50 г/л. Уравнение взаимодействия перренат-ионов с функциональными группами (третичные амины) анионитов может происходить по следующей реакции:
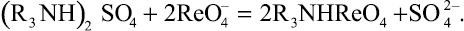 (1)
(1)
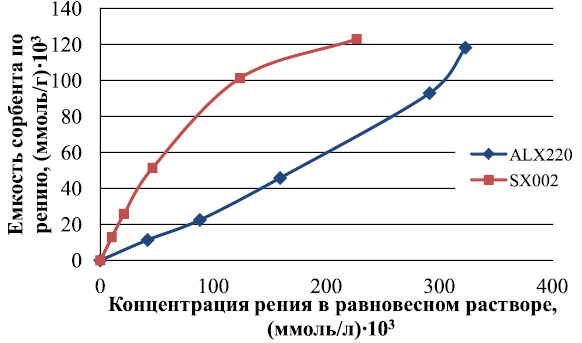
Рис. 1. Изотермы сорбции рения
из сернокислых модельных растворов анионитами SX002 и ALX220
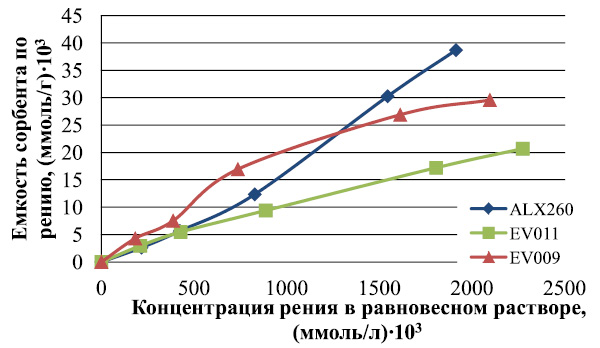
Рис. 2. Изотермы сорбции рения
из сернокислых модельных растворов анионитами ALX260, EV011, EV009
Из полученных данных видно, что в условиях эксперимента все опробованные аниониты способны поглощать рений. Наиболее высокие емкостные характеристики принадлежат макропористым анионитам ALX220 и SX002 с третичными аминами в качестве функциональных групп.
Обработку изотерм сорбции рения анионитами Cybber проводили с использованием уравнения Ленгмюра (табл. 2). На основании полученных изотерм для дальнейшего изучения были отобраны 2 образца – ALX220
и SX002.
Таблица 2
Обработка изотерм сорбции рения на анионитах Cybber по уравнениям Ленгмюра
|
№ п/п |
Марка анионита |
Константа Ленгмюра, л/г |
Максимальная емкость, ммоль/л∙103 |
Коэффициент корреляции, R2 |
|
1 |
ALX220 |
(1,6 ± 0,1)∙10–2 |
118,25 |
0,9692 |
|
2 |
SX002 |
(2,8 ± 0,2)∙10–2 |
38,71 |
0,9994 |
|
3 |
EV011 |
(1,9 ± 0,1)∙10–3 |
20,70 |
0,9982 |
|
4 |
EV009 |
(1,7 ± 0,4)∙10–3 |
29,57 |
0,9891 |
|
5 |
ALX260 |
(1,4 ± 0,6)∙10–3 |
123,06 |
0,9995 |
В связи с тем, что основным фактором, влияющим на диссоциацию функциональных групп и набухание ионита, является кислотность среды, была изучена зависимость емкости отобранных образцов от содержания серной кислоты в растворе. Так как в технологическом растворе содержание кислоты не постоянно, а меняется в некоторых пределах, эксперименты по оценке влияния концентрации серной кислоты наемкость сорбентов проводились в широком интервале концентрации серной кислоты. Графические результаты экспериментов представлены на рис. 3.
Рис. 3. Зависимость емкости анионитов ALX220 и SX002 по рению от концентрации серной кислоты (диапазон концентраций 20–250 г/л)
Также была произведена оценка влияния на сорбционные характеристики сорбентов Cybber, присутствующих в технологическом растворе ионов селена и хрома. Результаты статической сорбции рения из хром- и селенсодержащих растворов с концентрацией рения 0,5 г/л и серной кислоты 200 г/л приведены в табл. 3.
Таблица 3
Влияние ионов хрома и селена на сорбцию рения анионитами SX002 и ALX220
|
№ п/п |
Примесный ион |
Концентрация иона, г/л |
Анионит SX002 |
Анионит ALX220 |
||||
|
Емкость ионита |
Извлечение |
Емкость ионита |
Извлечение |
|||||
|
мг/г |
ммоль/г∙103 |
мг/г |
ммоль/г∙103 |
|||||
|
1 |
Se6+ |
2,5 |
18,80 |
101,08 |
75,20 |
17,15 |
92,20 |
68,60 |
|
2 |
5,0 |
17,65 |
94,89 |
70,60 |
14,70 |
79,03 |
58,80 |
|
|
3 |
10,0 |
16,10 |
86,56 |
64,40 |
11,00 |
59,14 |
44,00 |
|
|
4 |
Cr6+ |
2,5 |
11,10 |
59,68 |
44,40 |
11,00 |
59,14 |
44,00 |
|
5 |
5,0 |
9,25 |
49,73 |
37,00 |
9,30 |
50,00 |
37,20 |
|
|
6 |
10,0 |
6,00 |
32,26 |
24,00 |
6,30 |
33,87 |
25,20 |
|
|
7 |
Cr3+ |
0,5 |
19,00 |
102,15 |
76,00 |
19,30 |
103,76 |
77,20 |
|
8 |
5,0 |
17,85 |
95,97 |
71,40 |
18,10 |
97,31 |
72,40 |
|
|
9 |
10,0 |
15,65 |
84,14 |
62,60 |
16,25 |
87,37 |
65,00 |
|
Ионы хрома и селена снижают емкость анионитов по отношению к рению. Наибольшее влияние оказывает анион шестивалентного хрома, который подавляет сорбцию, а также, как сильный окислитель, способен вызывать деструкцию ионитов. Следует отметить высокую чувствительность анионита ALX220 к присутствию анионов селена в растворе.
Интегральные кинетические кривые сорбции рения анионитами SX002 и ALX220 при 298 К представлены на рис. 4.
Аниониты характеризуются высокой скоростью сорбции, при этом более 70 % извлекаемого рения концентрируется на протяжении первых 30–35 минут сорбции.
Асимптотическое приближение зависимости F от t в начальный момент обмена при малых степенях заполнения определяется следующим выражением:
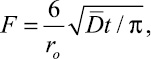 (2)
(2)
поэтому зависимость  при внутрисферном механизме кинетики линейна. При пленочной кинетике эта зависимость нелинейна.
при внутрисферном механизме кинетики линейна. При пленочной кинетике эта зависимость нелинейна.
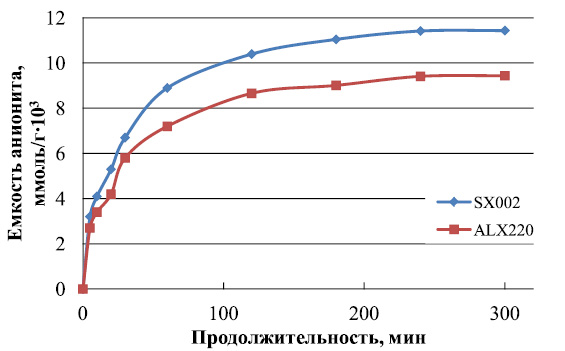
Рис. 4. Интегральные кинетические кривые сорбции рения анионитами SX002 и ALX220
при температуре 298 К
Принято считать, что в сильно разбавленных растворах скорость процесса лимитируется пленочной диффузией. В этом случае выполняется зависимость
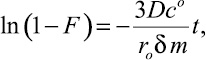 (3)
(3)
т.е. при пленочном механизме диффузии зависимость –ln(1 – F) = f(t) должна быть линейной [6].
Поэтому для определения лимитирующей стадии процесса кинетические данные были обработаны в функциональных координатах: –ln(1 – F) – τ и 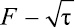 (рис. 5, 6).
(рис. 5, 6).
Рис. 5. Кинетические кривые сорбции рения в функциональных координатах 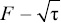
Рис. 6. Кинетические кривые сорбции рения в функциональных координатах –ln(1 – F) – τ
Полученные графические зависимости говорят о том, что определяющей скорость стадией сорбции на анионитах SX002 и ALX220 является внутренняя диффузия.
Расчет эффективных коэффициентов диффузии рения в анионите проводили с использованием уравнения, учитывающим время полуобмена.
Коэффициент диффузии рения рассчитывали по формуле [6]:
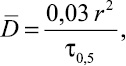 (4)
(4)
где 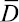 – эффективный коэффициент диффузии рения из ионита, м2∙с–1; r – радиус сорбента, м; τ0,5 – время полуобмена, с.
– эффективный коэффициент диффузии рения из ионита, м2∙с–1; r – радиус сорбента, м; τ0,5 – время полуобмена, с.
Радиус сорбента был рассчитан с учетом фракции (0,8–1,0 мм), используемой в кинетических экспериментах по следующей формуле:
r = 0,435(rmin + rmax). (5)
Полученные в результате расчета значения коэффициентов диффузии приведены в табл. 4.
Таблица 4
Эффективные коэффициенты диффузии рения в анионитах SX002 и ALX220
|
Анионит |
Температура, К |
Время |
Эффективный коэффициент диффузии, м2∙с–1 |
|
SX002 |
298 |
1320 |
1,39∙10–11 |
|
ALX220 |
1400 |
1,31∙10–11 |
Порядок (10–11) значений коэффициентов диффузии подтверждает диффузионный характер процесса сорбции.
При сорбции рения из технологического с концентрацией рения – 1,3 г/л, хрома (III) – 75 г/л, хрома (VI) – 7 г/л, селена – 4,5 г/л емкость анионита ALX220 составила 0,16 ммоль/г, а анионита SX002 – 0,14 ммоль/г.
Данные экспериментов по десорбции рения свидетельствуют о высокой элюирующей способности 8 % раствора аммиака. Более 70 % рения вымывается за один контакт. Повышение концентрации аммиачного раствора практически не влияет на извлечение. За один цикл сорбции-десорбции удалось повысить концентрацию в растворе в 8–10 раз.
Заключение
На основании полученных результатов можно отметить высокие относительно других образцов показатели сорбции рения макропористыми анионитами CybberALX220 и SX002. Процесс сорбции на данных анионитах протекает во внутридиффузионной области. Следует отметить возможность применения анионита SX002 при низких исходных концентрациях рения. При сорбции рения из модельных и технологических растворов с высоким ионным фоном аниониты ALX220 и SX002 показывают сопоставимые значения сорбционной емкости.
Рецензенты:
Бричкин В.Н., д.т.н., заведующий ка-
федрой металлургии, ФГБОУ ВПО «Национальный минерально-сырьевой университет «Горный», г. Санкт-Петербург;
Бажин В.Ю., д.т.н., декан химико-металлургического факультета, ФГБОУ ВПО «Национальный минерально-сырьевой университет «Горный», г. Санкт-Петербург.
Работа поступила в редакцию 02.12.2014.



