Эпилепсия как хроническое заболевание нервной системы требует постоянного контроля со стороны лечащего врача и правильного подбора противоэпилептической терапии с целью купирования приступов. В арсенале врача-невролога находится целый спектр противоэпилептических препаратов для достижения ремиссии. Однако индивидуальный выбор препарата не только важен для достижения устойчивой ремиссии и избавления пациента от приступов, но и необходим с точки зрения обеспечения качества жизни. Это связано с риском развития у пациентов отдельных побочных эффектов противоэпилептической терапии, а именно нарушений функций высшей нервной деятельности. В настоящее время большинством ученых признается мультифакторная природа развития когнитивных нарушений при эпилепсии [3].
Анализируя литературные источники, мы можем утверждать, что в настоящее время нет четкого однозначного объяснения влияния противоэпилептических препаратов на развитие когнитивных нарушений при эпилепсии. Выделяют несколько возможных патогенетических механизмов:
1. Прямое нейротоксическое воздействие препарата. Примером может служить «эра бромидов» в 19 веке, когда препараты бромида калия являлись единственным известным средством для лечения эпилепсии. Несмотря на то, что нейротоксический эффект от применения бромидов описан еще Huette в 1850 г., препарат долгое время использовался в лечении. В дальнейшем именно из-за выраженных когнитивных побочных эффектов от его применения отказались. Есть также научные подтверждения нейротоксическое воздействие фенитоина на созревающий мозг и мозг взрослых людей [7].
2. Сочетание лечебного и побочного эффектов действия препарата. Примером такого нарушения может быть влияние ряда препаратов на ГАМК-рецепторы. Так, например, у здоровых добровольцев даже однократный прием бензодиазепинов снижал когнитивные способности, а применение агонистов ГАМКА-рецепторов или блокаторов хлорных каналов вызывало улучшение запоминания.
3. Возможное опосредованное влияние при длительном применении противоэпилептической терапии. К таким состояниям относятся некоторые побочные эффекты терапии, например гипотиреоз или дефицит фолатов, которые потенциально способны воздействовать на когнитивные функции.
Один из выраженных отрицательных эффектов оказывает фенобарбитал, описаны дозозависимые эффекты на внимание, кратковременную память, интеллект и скорость реакции и, главное, на речевые навыки. Побочное действие карбамазепина, как предполагается, связано с его метаболитом – карбамазепин-эпоксидом. Существуют доказательства дозозависимости когнитивных нарушений при использовании карбамазепина, что частично подтверждается в работе Jokeit [9], где показана отрицательная зависимость активации височной области (по данным фМРТ) у пациентов с височной эпилепсией и уровнем карбамазепина в сыворотке крови.
Препараты вальпроевой кислоты по результатам части исследований не вызывают когнитивных нарушений [3], не отмечается значимых отклонений памяти, скорости реакции, и мышления. Еще одним препаратом с хорошим когнитивным профилем считается ламотриджин. При сравнительном плацебо-контролируемом исследовании [11] ламотриджин показал хорошие результаты концентрации внимания и умственной активности у пациентов с эпилепсией.
Выбор топирамата при лечении эпилепсии в некоторых случаях может быть ограничен ввиду его влияния на когнитивные функции. При исследовании эффектов топирамата при эпилепсии регистрировались замедление мышления, сонливость, утомляемость и снижение концентрации внимания [10]. Напротив, Холин с соавт. [6] отмечают, что встречаемость таких побочных эффектов топирамата, как регресс речевой продукции, ухудшение памяти, утрата моторных навыков, при длительном приеме топирамата встречаются не так часто и составляют не более 1 % от наблюдений.
Своевременное выявление когнитивных нарушений в мониторинге побочных эффектов противоэпилептической терапии – одна из важных задач, на которую стоит обратить внимание врачу-неврологу. В оценке когнитивных нарушений традиционно используют ряд нейропсихологических тестов на память, внимание, мышление, речь и другие сферы познавательной деятельности человека. Однако в условиях работы неврологической службы проведение всех нейропсихологических тестов не представляется возможным. Существует нейрофизиологический диагностический подход, который развился начиная с 60-х годов, с появлением количественной оценки электроэнцефалограммы и вызванных потенциалов. Метод когнитивных вызванных потенциалов Р300 является эффективным диагностическим тестом для диагностики корковых и подкорковых когнитивных нарушений [Гнездицкий с соавт.]. Р300 способен проводить диагностику субклинических нарушений высшей нервной деятельности при эпилепсии. Ранее нами были показаны особенности нейропсихологического и нейрофизиологического тестирования у пациентов с эпилепсией по сравнению с группой контроля [4].
Другим решением может быть использование когерентной электроэнцефалографии, при которой оценивается степень функциональной взаимосвязанности между различными зонами коры головного мозга. Наиболее перспективными в оценке когнитивных функций методом когерентности является изучение лобно-теменных взаимосвязей [8]. Лобно-теменная синхронизация, в частности в тета-диапазоне, задействована в реализации зрительной кратковременной памяти, формировании селективного зрительного внимания, в зрительно-моторной координации и даже интеллекте. Предыдущие работы показывают значимые отклонения нейропсихологических показателей памяти, внимания, скорости обработки информации в зависимости от рассчитанной фронто-париетальной когерентности при умеренных когнитивных расстройствах и болезни Альцгеймера. Поиск среди научных источников показал, что до настоящего времени не проводилось исследований подобного дизайна у пациентов с эпилепсией.
Целью нашего исследования стало проведение дополнительного анализа в группе больных с эпилепсией для уточнения характера комплексных изменений в зависимости от использовании разной противоэпилептической монотерапии.
Материалы и методы исследования
Мы исследовали 94 пациентов (мужчин – 37,2 %, женщин – 62,7 %) с подтвержденным диагнозом парциальной эпилепсии, либо генерализованной эпилепсии и с продолжительностью заболевания не менее двух лет. На этапе включения пациентам проведено тестирование по шкале Бека для исключения выраженной депрессивной симптоматики. В лечении у наших пациентов применялся только один препарат и длительность терапии превышала 2 года. 32,9 % пациентов принимали препараты вальпроевой кислоты, 39,3 % пациентов принимали карбамазепин, топамакс принимали 11,7 % испытуемых, и 12,7 % пациентов использовали в лечении ламотриджин. Пациенты не принимали иной терапии, которая могла бы повлиять на когнитивные способности, не использовали в лечении за месяц до тестирования бензодиазепины. Средний возраст – 32 года (интерквартильная широта – от 24 до 43 лет). В нейропсихологической оценке мы использовали компьютеризированный сертифицированный диагностический комплекс «НС-Психотест» (Нейрософт, Иваново), включающий в себя оценку кратковременной памяти (запоминание чисел), состояния внимания (концентрация и устойчивость внимания, скорость простой зрительно-моторной реакции), тест Струпа и оценку интеллектуального развития с помощью матриц Равена. В качестве группы сравнения было набрано 20 здоровых субъектов, сходных по полу и возрасту, которым были проведены те же нейропсихологические (за исключением матриц Равена) и нейрофизиологические тесты. Для нейрофизиологической оценки мы использовали запись ЭЭГ в расслабленном состоянии и выбирали для анализа безартефактный отрезок продолжительностью 20 секунд. Для когерентного анализа ЭЭГ мы создали монтаж, который включал в себя: F3-P3 (левая лобно-теменная пара), F4-P4 (правая лобно-теменная пара), F3-F4 (межполушарная лобная пара), P3-P4 (межполушарная теменная пара), F3-T3 (левая лобно-височная пара), F4-T-4 (правая лобно-височная пара), T3-T4 (межполушарная височная пара). Оценивалась когерентность мощности тета-ритма в выбранных нами электродных парах.
Полученные результаты обрабатывались статистически, для сопоставления нескольких признаков использовался критерий согласия Пирсона. Также применены непараметрические тесты: в случае сравнения двух групп по признаку критерий Манна – Уитни, для сравнения более двух групп терапии использовался критерий сравнения медиан Краскела – Уоллиса, уровень значимости различий в попарном сравнении таких групп вычислялся с поправкой Бонферрони.
Результаты исследования и их обсуждение
При сравнении нейропсихологического тестирования пациентов с эпилепсией и здоровых добровольцев были выявлены значимые различия. Пациенты с эпилепсией (среднее 6 чисел, 95 % ДИ от 3,8 до 6,7 чисел) отличались по количеству воспроизведенных чисел в тесте на кратковременную память по сравнению с группой здоровых испытуемых (среднее 8 чисел, 95 % ДИ от 7,3 до 9,5 чисел), группы имели статистически значимые различия (U = 1069, p = 0,002) по критерию Манна – Уитни (рис. 1).
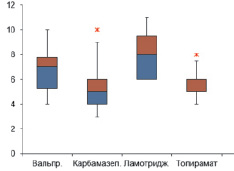
Рис. 1. Показатели объема кратковременной памяти (количество воспроизведенных цифр) в зависимости от группы противоэпилептической терапии
Скорость ПЗМР пациентов с эпилепсией (среднее 348,0 мс, 95 % ДИ от 340,5 до 355,1) и группы сравнения также достоверно различалась (p < 0.05). Частота встречаемости высокой концентрации внимания была достоверно выше в группе здоровых относительно больных с эпилепсией (χ² = 21,52, p = 0,0001), так же, как и высокой устойчивости внимания (χ² = 10,29, p = 0,0013). При прохождении теста Струпа пациентам с эпилепсией требовалось больше времени по сравнению с здоровыми, и эта разница была достоверно значима (p = 0,02). Также по результатам теста Струпа выяснилось, что в группе здоровых преобладали субъекты с низкой и средней интерферируемостью (что отражает высокую помехоустойчивость), в то время как пациенты с эпилепсией в большей степени имели среднюю и высокую интерферируемость (что отражает высокую помехоустойчивость).
Проанализировав действие противоэпилептической терапии, мы обнаружили достоверную разницу по результату теста на кратковременную память между всеми группами препаратов (H = 23,72, p = 0,0003); концентрации внимания (рис. 2) только в случае использования карбамазепина по сравнению с ламотриджином (p = 0,0002) и топираматом (p = 0,001); скорости простой зрительно-моторной реакции (H = 9,49, p = 0,03). При этом попарный анализ выявил различия в скорости простой зрительно-моторной реакции между группами вальпроатов и карбамазепина (р = 0,041); между группами вальпроатов и топирамата (р = 0,002) между группами ламотриджина и карбамазепина (р = 0,02). Не получено достоверных различий при анализе результатов теста Струпа и IQ.
В частности, при использовании карбамазепина отмечались худшие по сравнению с другими группами результаты в оценке кратковременной памяти и скорости простой зрительно-моторной реакции. Также при использовании карбамазепина отмечалось значимое снижение концентрации внимания. По сравнению с вальпроатами и ламотриджином, в группе топирамата наблюдалось значимое снижение скорости простой зрительно-моторной реакции. Таким образом, можно сделать вывод, что наиболее выраженный отрицательный эффект на когнитивную сферу в нашем исследовании принадлежит карбамазепину.
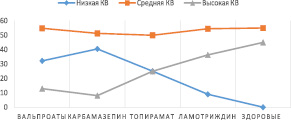
Рис. 2. Распределение концентрации внимания (КВ) в процентном соотношении в группах противоэпилептической терапии
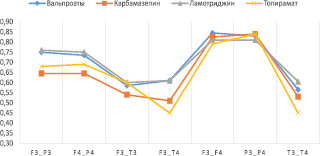
Рис. 3. Показатели фронто-париетальной когерентности в зависимости от группы противоэпилептической терапии
Данные когерентности в расслабленном состоянии достоверно различались у пациентов с эпилепсией в парах F3-P3 (U = 1025, p = 0,0013), в F4-P4 (U = 1004,5, p = 0,005), F3-F4 (U = 1039,1, p = 0,0013). В фронто-париетальных отведениях, а также в межполушарных фронтальных отведениях у пациентов с эпилепсией отмечалось снижение когерентности тета-ритма относительно здоровых испытуемых. По большинству параметров когерентности мужчины и женщины с эпилепсией не различались, кроме когерентности в лобно-височном отведении в левом полушарии (U = 686, p = 0,002), а также отмечалась межполушарная разница показателя когерентности в лобных отведениях (U = 709, p = 0,004).
При исследовании влияния терапии были найдены следующие различия (рис. 3). В левой фронтопариетальной (F3-P3) паре были найдены статистически значимые различия (H = 16,02 p = 0,0011) причем обнаружена статистически значимая разница между карбамазепином и ламотриджином (p = 0,026), а также между вальпроатами и карбамазепином (p = 0,011). В правой фронтопариетальной паре (F4-P4) найдены достоверные различия между группами противоэпилептической терапии (H = 12,67; p = 0,0045) а именно между карбамазепином и вальпроатами (p = 0,046), а также ламотриджином и карбамазепином (p = 0,032). При анализе коэффициента когерентности не найдено различий по парам отведений F3-T3 (p = 0,07) и F4-T4 (p = 0,4), а также межполушарным парам отведений F3-F4 (p = 0,1) и P3-P4 (p = 0,4).
Выводы
1. Полученные нами данные свидетельствуют о значительной гетерогенности нейропсихологических и нейрофизиологических характеристик в зависимости от выбранной противоэпилептической терапии. Использование терапии в первую очередь сказывается на характеристиках концентрации внимания, скорости переработки информации, объема кратковременной памяти. В то время как базовые показатели интеллектуального развития и когнитивного стиля обработки информации по данным Струп-теста остаются интактными и не зависят от применения выбранной терапии.
2. Наиболее выраженный отрицательный эффект на функции высшей нервной деятельности в монотерапии дает карбамазепин, в то время как наилучшим когнитивным профилем обладает ламотриджин.
3. Исследование электроэнцефалографии выявило наиболее значимые для диагностики когнитивных нарушений пары отведений – это левая и правая фронтопариетальные пары отведений. Снижение когерентности в этих парах сопряжено с развитием когнитивных нарушений, что может иметь дальнейшую практическую значимость.
Рецензенты:
Богданов Э.И., д.м.н., профессор, заведующий кафедрой неврологии и реабилитации КГМУ, г. Казань;
Боголепова А.Н., д.м.н., профессор кафедры неврологии, нейрохирургии и медицинской генетики, ГБОУ ВПО «РНИМУ имени Н.И. Пирогова» Минздрава России, г. Москва.
Работа поступила в редакцию 18.11.2014.



