В основе современных принципов лечения острого коронарного синдрома (ОКС) с подъемом сегмента ST лежит реканализация остро обтурированной коронарной артерии различными путями (тромболизис, коронароангиопластика). Эффективной реканализации всегда сопутствует реперфузионный синдром, часто проявляющийся тяжелой систолической дисфункцией левого желудочка [7], появлением фатальных аритмий, распространением зоны инфаркта миокарда и неблагоприятным прогнозом [10]. В основе данного синдрома лежит гибель определённой части клеток в процессе восстановления перфузии данной области левого желудочка. Происходит это в результате сложной цепочки патологических процессов, следствием которых является вхождение ионов Са++ и продуктов анаэробного гликолиза в ишемизированные клетки в связи с недостатком энергетических субстратов [3]. Этому процессу способствует также продукция свободных кислородных радикалов, активация нейтрофилов, отек эндотелия и миоцитов, потеря антиоксидантных энзимов и апоптоз кардиомиоцитов [11]. В данной связи целесообразным представляется исследование эффективности кардиопротекторов антиоксидантного типа действия при реперфузионном синдроме.
В наших исследованиях ранее была доказана кардиопротекторная активность 3-оксипиридина сукцината и 3-оксипиридина адипината при экспериментальной острой и хронической сердечной недостаточности у крыс [5, 6]. Поэтому перспективным представляется изучение эффективности этих соединений при реперфузионном повреждении миокарда.
Целью нашей работы явилось изучение влияния 3-оксипиридина адипината и 3-оксипиридина сукцината на морфологические изменения, возникающие при реперфузионном повреждении миокарда в эксперименте.
Материалы и методы исследования
Эксперименты проводились на 24 нелинейных белых крысах, содержащихся в стандартных условиях вивария. Предварительно наркотизированным уретаном (800 мг/кг внутрибрюшинно) животным проводилась трахеостомия и протезирование самостоятельного дыхания аппаратом искусственной вентиляции легких «Вита-1». После левосторонней торакотомии в четвертом межреберье слева рассекали перикард и обнажали сердце. Ориентируясь на медиальный край ушка левого предсердия слева и конус легочной артерии справа, определяли локализацию общего ствола левой коронарной артерии и отходящую от нее в сторону верхушки сердца – нисходящую ветвь левой коронарной артерии, под которую при помощи атравматической иглы подводили лигатуру. После этого свободные концы лигатуры проводили через окклюдер, который представлял собой полую полипропиленовую трубку длиной 3 см и внутренним диаметром 2 мм. Путем смещения трубки к сосуду добивались окклюзии нисходящей ветви левой коронарной артерии, а в противоположном направлении – реперфузии. С целью поддержания окклюзии в течение 10 мин на противоположный от сердца конец трубки накладывали эластичный фиксатор, в котором в натянутом состоянии фиксировались свободные концы лигатуры. По истечении 10-минутной окклюзии сосуда эластичный фиксатор снимался, окклюдер удалялся, тем самым добиваясь реперфузии миокарда. В эксперимент включали контрольную серию (группа № 1) с вышеописанной моделью окклюзии-реперфузии миокарда и 2 серии с коррекцией изменений. В группе № 2 за 30 мин до наложения окклюдера животным внутрибрюшинно вводился 3-оксипиридина сукцинат в дозе 50 мг/кг, что составляет 10 % от LD50 [4]. В группе № 3 за 30 мин до обратимой окклюзии сосуда внутрибрюшинно вводился 3-оксипиридина адипинат в дозе 80 мг/кг, что составляет 10 % от LD50 [2].
По окончанию эксперимента проводили оценку размеров анатомической зоны риска и повреждения с помощью методики «двойного окрашивания» синим Эванса и трифенилтетразолием хлоридом (ТТС). Подсчет площадей зоны риска и зоны инфаркта проводили на оцифрованных снимках поперечных срезов сердец, на персональном компьютере, с помощью программы ImageJ 1.45s. Для гистологического исследования кусочки миокарда фиксировали в 10 % растворе нейтрального формалина. Срезы окрашивали гематоксилином и эозином. На светооптическом уровне оценивали качественное состояние миокарда. Статистическая обработка материала осуществлялась с помощью пакета статистических программ «Excel» на персональном компьютере, расчеты достоверности различия средних арифметических велись с помощью t-критерия Стьюдента при 5 % уровне значимости.
Результаты исследования и их обсуждение
При микроскопическом исследовании миокарда в контрольной группе животных в области экспериментального повреждения отмечались изменения дисциркуляторного характера в виде неравномерного кровенаполнения сосудистых ветвей: полнокровие венозных сосудов и капилляров с их дистонией и периваскулярным отеком, на фоне малокровия артериол. Межмышечные и периваскулярные пространства выраженно расширены за счет явлений отека. Наблюдались обширные участки кровоизлияний и эритроцитарных экстравазатов. Поперечная исчерченность мышечных волокон нечеткая, с участками ее отсутствия. Наблюдались явления контрактурного повреждения кардиомиоцитов. В просвете кровеносных сосудов и в тканях миокарда, прилегающих к сосудистой сети, наблюдалась начинающаяся лейкоцитарная инфильтрация преимущественно нейтрофильного характера. Гистологические изменения в сердце у контрольных животных, выявленные нами, соответствуют данным литературных источников [1]. Все описанные изменения в морфологической картине миокарда при ишемии-реперфузии характеризуются восстановлением кровообращения в зоне ишемии, что ведет к ограничению зоны повреждения, а с другой стороны, к массивным кровоизлияниям в поврежденную ткань и воспалительной реакции.
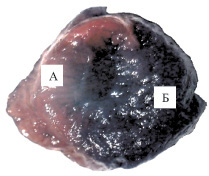
При верифицировании зоны риска суправитальной окраской синим Эванса у животных на фоне экспериментальной ишемии-реперфузии объем зоны ишемии составил 49,02 ± 3,25 % от общего объема сердца (рисунок, 1). При последующем окрашивании ТТС-негативные участки в пределах зоны риска не были обнаружены.
При ишемии-реперфузии на фоне введения 3-оксипиридина сукцината микроскопическая картина миокарда в области экспериментального повреждения была схожа с предыдущей группой животных. Сохранялись изменения дисциркуляторного характера, проявляющиеся полнокровием венозных сосудов и капилляров с их дистонией и периваскулярным отеком на фоне малокровия артериол. Поперечная исчерченность мышечных волокон нечеткая. Прослеживались участки контрактурного повреждения кардиомиоцитов. Интерстициальный отек зоны повреждения оставался выраженным. Сохранялись обширные участки кровоизлияний и эритроцитарных экстравазатов. Процессов лейкоцитарных инфильтраций отмечено не было.
При визуализации зоны риска суправитальной окраской синим Эванса у животных при экспериментальной ишемии-реперфузии на фоне введения 3-оксипиридина сукцината объем зоны ишемии составил 33,96 ± 3,58 % от общего объема сердца, что достоверно меньше на 30,72 % (рк < 0,005) аналогичных показателей контрольной группы животных (рисунок, 2). ТТС-негативные участки также не выявлялись, что говорит об отсутствии некроза в очаге ишемии.
 1
1 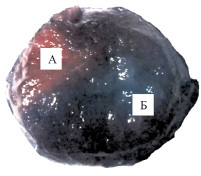 2
2
Зона ишемии миокарда при моделировании ишемии-реперфузии: А – зона ишемии; Б – неповрежденный миокард. Окраска синим Эванса; 1 – контроль; 2 – коррекция
На фоне введения 3-оксипиридина адипината морфологически, в области экспериментального повреждения миокарда, отмечался выраженный интерстициальный отек ткани сердца, проявляющийся расширением межмышечных и периваскулярных пространств. Отмечалось полнокровие венозных сосудов и капилляров с их дистонией и периваскулярным отеком и малокровие артериол. Поперечная исчерченность мышечных волокон нечеткая. Наблюдались участки контрактурного повреждения кардиомиоцитов. Сохранялись обширные участки кровоизлияний и эритроцитарных экстравазатов, выраженность которых приближается к аналогичной других групп исследуемых животных. Процессов лейкоцитарных инфильтраций отмечено не было.
При окрашивании зоны риска суправитальной окраской синим Эванса у животных при экспериментальной ишемии-реперфузии на фоне введения 3-оксипиридина адипината объем зоны ишемии составил 38,32 ± 0,38 % от общего объема сердца, что достоверно меньше на 21,82 % (рк < 0,005) аналогичных показателей контрольной группы животных.
Заключение
Таким образом, как 3-оксипиридина адипинат в дозе 80 мг/кг, так и 3-оксипиридина сукцинат в дозе 50 мг/кг уменьшают зону ишемии при моделировании окклюзии-реперфузии ветви левой коронарной артерии у крыс и уменьшают выраженность лейкоцитарной инфильтрации в очаге повреждения миокарда. В наших исследованиях выявлена большая эффективность 3-оксипиридина сукцината в дозе 50 мг/кг при коррекции реперфузионного синдрома в эксперименте. Такой результат связан с особенностями структуры данного соединения. Так, при остром повреждении миокарда на первый план выходит антигипоксантное и нейромедиаторное действие сукцината [8]. В отличие от большинства окисляющихся в митохондриях субстратов сукцинат поставляет свои восстановительные эквиваленты по более быстрому пути. Окисление сукцината идет с большей скоростью, благодаря чему мощность процесса ресинтеза АТФ выше, чем у других субстратов. Появление сукцината в кровотоке является для всех систем организма естественным сигналом дефицита кислорода. И этот сигнал запускает каскад адаптивных реакций как в районе собственно ишемического очага, так и на уровне нейроэндокринной системы целостного организма [9]. Тем самым сукцинат участвует в формировании срочных защитных механизмов от кислородной недостаточности [8]. В связи с этим перспективным представляется использование производных 3-оксипиридина, в первую очередь сукцинатсодержащих, для коррекции реперфузионного повреждения при реваскуляризации миокарда.
Рецензенты:
Блинов Д.С., д.м.н., профессор, заведующий кафедрой организации здравоохранения, ФГБОУ ВПО «Мордовский государственный университет им. Н.П. Огарева», г. Саранск;
Сипров А.В., д.м.н., профессор кафедры фармакологии и клинической фармакологии с курсом фармацевтической технологии, ФГБОУ ВПО «Мордовский государственный университет им. Н.П. Огарева», г. Саранск.
Работа поступила в редакцию 02.12.2014.



