Теллурорганические соединения зарекомендовали себя не только как модели для изучения теоретических вопросов органической химии, но и как важные в практическом отношении соединения [9–14]. Найдены соединения теллура, обладающие высокой биологической активностью и имеющие все предпосылки стать новыми медицинскими препаратами [9–13]. В ведущих международных журналах (в том числе известном журнале «Nature» [10]) опубликована серия работ по изучению свойств соединения четырехвалентного теллура, трихлор(диоксоэтилен-О,О’)теллурата аммония (препарат AS-101), обладающего мощной иммуномодулирующей активностью [10–12]. Установлено, что это соединение нетоксично и очень эффективно для профилактики и лечения многих заболеваний, в том числе для лечения рака и СПИДа. Перспективными полупродуктами и синтонами для органического синтеза являются ненасыщенные теллуроорганические соединения и особенно 2-галогенвинилтеллуриды [14], которые можно получать на основе реакций присоединения тетрагалогенидов теллура к алкинам.
Ряд реакций тетрахлорида теллура с алкинами описан в литературе [1, 4–8], однако присоединению тетрабромида теллура к тройной связи посвящены лишь единичные работы [2, 3]. На основе реакции тетрабромида теллура с ацетиленом разработан эффективный метод синтеза Е,Е-бис(2-бромвинил)теллурдибромида и Е-(2-бромвинил)теллуртрибромида [2, 3]. Присоединение тетрабромида теллура к фенилацетилену и гептину-1 в условиях кипячения в бензоле приводит к бис-аддуктам, бис(2-бром-2-фенилвинил)теллурдибромиду и бис(2-бромгептен-2-ил-1)теллурдибромиду, с выходами 89 и 70 % в виде смеси Z- и Е-изомеров с преимущественным образованием продуктов Z-строения (соотношение Z- и Е-изомеров в случае фенилацетилена 4.5:1) [13]. До наших исследований данные о возможности осуществления стереоселективного присоединения тетрабромида теллура к фенилацетилену в литературе отсутствовали.
Материалы и методы исследования
Спектры ЯМР 1Н и 13С регистрировали на приборе Bruker DPX-400 (рабочие частоты 400,13, и 100,61 МГц соответственно), внутренний стандарт – ГМДС. Элементный анализ выполнен на приборе Thermo Finigan EA 1112.
Типичная методика реакции присоединения тетрабромида теллура к алкинам. Смесь тетрабромида теллура (0,894 г, 2 ммоль), фенилацетилена (0,204 г, 2 ммоль), CCl4 (20 мл) и бензола (10 мл) нагревали до кипения с обратным холодильником при перемешивании в течение 12 часов. Растворители отогнали на роторном испарителе, остаток промыли холодным гексаном и сушили в вакууме. Получили 1,055 г (выход 96 %) Z-2-бром-2-фенилвинилтеллуртрибромида (1) в виде порошка желтоватого цвета, Тпл 159−162 °С (разл.). Спектр ЯМР 1Н, d, м.д.: 7,55 м (3Н, Ph), 7,74 м (2Н, Ph), 9,56 с (1Н, =СН). Спектр ЯМР 13С, d, м.д.: 125,95 (=СН, 1JСТe 219 Гц), 127,83 (Ph), 129,21 (Ph), 131,53 (Ph), 135,47 (Ph), 138,23 (BrC=). Найдено, %: C 17,00; H 1,03; Br 58,78; Te 23,00. С8Н6Br4Те. Вычислено, %: C 17,49; H 1,10; Br 58,18; Te 23,23.
Типичная методика реакции восстановления 2-бром-2-винилтеллуртрибромидов. К 0,549 г (1 ммоль) Z-2-бром-2-фенилвинилтеллуртрибромида (1) добавили раствор 3 г Na2S2O5 в 20 мл воды и 20 мл бензола. Смесь перемешивали 18 часов при комнатной температуре. Отделили органический слой, сушили CaCl2, растворитель отогнали на роторном испарителе, остаток сушили в вакууме. Получили Z,Z-бис(2-бром-2-фенилвинил)дителлурида (2) (0,279 г, выход 90 %) в виде темно-красного масла. Спектр ЯМР 1Н, d, м.д.: 7,23 м (3Н, Ph), 7,47 м (2Н, Ph), 8,21 с (1Н, =СН). Спектр ЯМР 13С, d, м.д.: 108,31 (=СН, 1JCTe 334 Гц), 127,09 (Ph), 127,98 (Ph), 128,39 (Ph), 133.34 (BrC=), 138,10 (Ph). Найдено, %: C 31,08; H 1,90; Br 25,42; Te 41,44. С16Н12Br2Те2. Вычислено, %: C 31,03; H 1,95; Br 25,81; Te 41.21.
Результаты исследования и их обсуждение
Нами изучены реакции тетрахлорида и тетрабромида теллура с фенилацетиленом и дифенилацетиленом. Дифенилацетилен является представителем дизамещенных алкинов, в то время как фенилацетилен – типичный монозамещенный ацетилен.
С целью стереоселективного синтеза Z-2-бром-2-фенилвинилтеллуртрибромида (1) нами исследована реакция тетрабромида теллура с фенилацетиленом при эквимольном соотношении реагентов. Установлено, что проведение реакции в смеси CC14/бензол позволяет остановить процесс на стадии образования моноаддукта 1 и увеличивает стереоселективность процесса. Так, проведение реакции при кипячении реагентов с обратным холодильником в смеси CC14/бензол 2:1 приводит к целевому продукту 1 с выходом 96 % и полной конверсией исходного TeBr4.
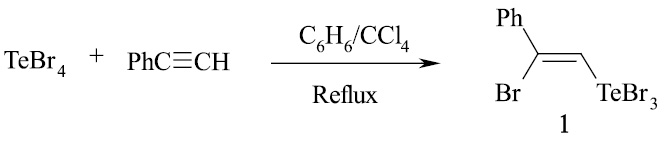
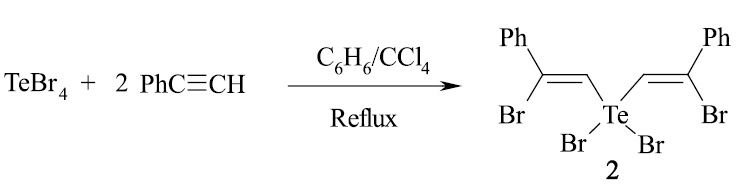
Установлено, что для стереоселективного синтеза бисаддукта 2 целесообразно проводить реакцию тетрабромида теллура с фенилацетиленом при эквимольном соотношении 1:2 при кипячении реагентов с обратным холодильником в смеси CC14/бензол 1:9. В данных условиях реакция протекает стереоселективно и приводит к целевому продукту 2 с выходом 95 % и полной конверсией исходного TeBr4.
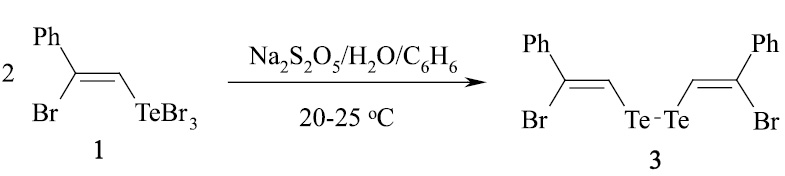
Восстановлением соединения 1 в системе Na2S2O5/H2O/C6H6 с выходом 90 % получен Z,Z-бис(2-бром-2-фенилвинил)дителлурид (3).
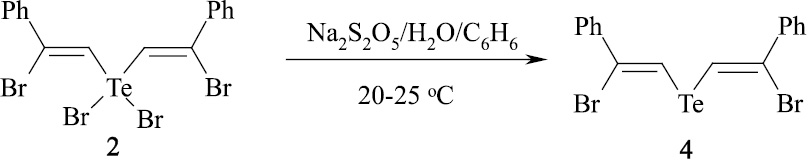
В аналогичных условиях соединение 2 восстанавливается в Z,Z-бис(2-бром-2-фенилвинил)теллурид (4) с вы ходом 96 %.
Установлено, что для того, чтобы реакция тетрахлорида теллура с фенилацетиленом протекала стереоселективно, необходимо использовать большее количество четыреххлористого углерода в смеси с бензолом. Так, проведение реакции при кипячении реагентов с обратным холодильником в смеси CC14/бензол 9:1 приводит к целевому продукту Z-2-хлор-2-фенилвинилтеллуртрихлориду (5) с выходом 95 % и высокой регио- и стереоселективностью.
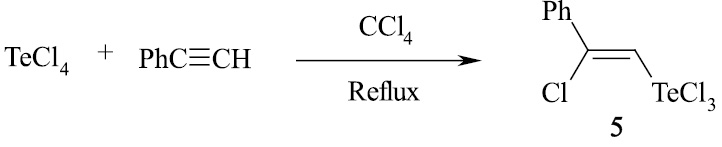
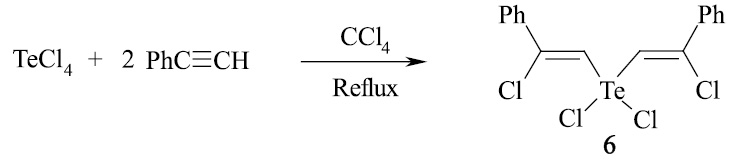
Образование бисаддукта 6 легко протекает при нагревании тетрахлорида теллура с двукратным мольным избытком фенилацетиленом в четыреххлористом углероде. Реакция протекает регио- и стереоселективно и приводит к целевому продукту 6 с выходом 96 % и полной конверсией исходного TeCl4.
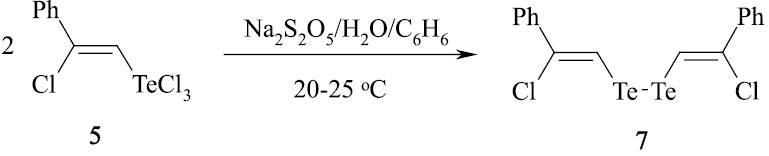
При восстановлении соединения 5 в системе Na2S2O5/H2O/C6H6 с выходом 91 % образуется Z,Z-бис(2-хлор-2-фенилвинил)дителлурид (7).
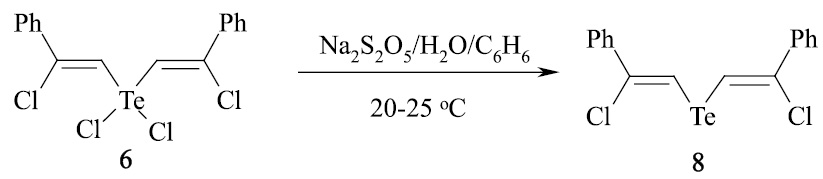
В аналогичных условиях соединение 6 превращается в Z,Z-бис(2-хлор-2-фенилвинил)теллурид (8) с вы ходом 95 %.
Присоединение тетрахлорида теллура к дифенилацетилену протекает при кипячении в бензоле как син-присоединение и приводит к Z-2-хлор-1,2-дифенилвинилтеллуртрихлориду (9) с выходом 92 % с высокой стереоселективностью.
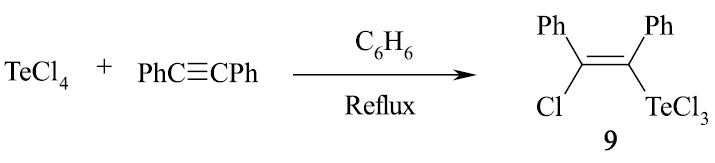
Получить бисаддукт тетрахлорида теллура с двукратным мольным избытком дифенилацетилена не удается. Также не удалось получить как бисаддукт, так и моноаддукт из дифенилацетилена и тетрабромида теллура. Одними из возможных причин этого являются стерический фактор и термодинамическая устойчивость дифенилацетилена.
Строение соединений 1–9 доказано методами ЯМР 1H, 13C и подтверждено данными элементного анализа. Значения констант спин-спинового взаимодействия атома теллура с атомом углерода, имеющим один протон, для соединений 1–8 составляет 219–334 Гц, что соответствует прямым константам спин-спинового взаимодействия (1JCТе). Это указывает на присоединение атома теллура к терминальному атому углерода тройной связи фенилацетилена. Стереоконфигурация продуктов 1–9 доказана методом NOESY.
Выводы
Разработаны эффективные регио- и стереоселективные способы получения соединений 1–9 – перспективных полупродуктов для органического синтеза и реагентов для микроэлектроники. Известно, что органилтеллуртригалогениды и диорганилдителлуриды являются важными исходными полупродуктами в синтезе разнообразных теллуроорганических соединений и реагентами для микроэлектроники [14]. Органилтеллуртригалогениды и диорганилдителлуриды легко восстанавливаются до органилтеллуролат-анионов, которые вступают в реакции нуклеофильного замещения и присоединения, давая несимметричные теллуриды [14]. Органилтеллуртригалогениды участвуют в реакциях электрофильного ароматического замещения и присоединения к соединениям, содержащим кратную связь, с образованием несимметричных теллуранов [14]. Таким образом, синтезированные соединения 1–9 являются перспективными исходными полупродуктами для синтеза ненасыщенных теллуроорганических соединений.
Рецензенты:Мартынов А.В., д.х.н., ведущий научный сотрудник ИрИХ СО РАН, г. Иркутск;
Артемьев А.В., д.х.н., ведущий научный сотрудник ИрИХ СО РАН, г. Иркутск.
Работа поступила в редакцию 18.11.2014.



