Среди всех природных стрессов на нашей планете холод является наиболее распространённым. Так, 90 % воды в Мировом океане имеет температуру от 5 °С и ниже, а в наземных экосистемах около 80 % составляют места обитания, где низкие температуры сохраняются длительный период: это Аляска (85 %), Россия и Канада (по 55 %), Китай (20 %) и большая часть Антарктиды. Ранее нами из наземных экосистем Западной Антарктики и прилегающих к ней островов Аргентинского архипелага выделены аэробные хемоорганотрофные микроорганизмы, в том числе чёрные и красные дрожжи [5, 7]. Впервые чёрные и красные дрожжи были найдены академиком Б.Л. Исаченко ещё 100 лет назад в Арктике, т.е. на другом полярном континенте [4]. Учитывая экстремальные условия Антарктики (низкую температуру, высокий уровень солнечной радиации и повышенную минерализацию в прибрежных экосистемах региона), мы предположили, что микроорганизмы данного региона должны быть резистентны к этим факторам, что и определило цель наших исследований, а также необходимость рассмотрения стратегии их выживания в экстремальных условиях.
Материал и методы исследования
Объектами исследования служили аэробные хемоорганотрофные микроорганизмы, изолированные ранее при 1–5 °С [5] и 30 °С [7] из различных экосистем Антарктики (почва, фитоценозы, биоплёнки обрастания) (табл. 1).
Таблица 1
Список исследованных в работе микроорганизмов, изолированных из наземных экосистем западной Антарктики
|
Номера штаммов |
Температура при изоляции штаммов из образцов |
Характеристика образцов*, откуда были изолированы штаммы |
|
O-1, O-3, S06, S10 |
30 °С |
Орнитогенная почва |
|
S33 |
30 °С |
Почва под мхом, остров Lippmann |
|
S36 |
30 °С |
Орнитогенная каменистая почва, остров Irizar |
|
S237 |
30 °С |
Почва глинистая, мыс Rassmussen (западная Антарктида) |
|
O-7, O-10, 181n3 |
30 °С |
Чёрный лишайник на южной стороне вертикальной скалы |
|
S182 |
30 °С |
Чёрный накипной лишайник на вертикальной скале |
|
40r5g |
5 °С |
Зелёный лишайник на камнях |
|
4r5, 5r5 |
5 °С |
Трава Deсshampcia antarctica на почве между камней |
|
S14 |
30 °С |
Мох на дне высохшего озера, остров Three little pig |
|
S11, S12 |
5 °С |
Тёмно-зелёный мох |
|
6r1g |
1 °С |
Зелёный мох, отобранный на моховом поле |
|
S48 |
30 °С |
Мох, отобранный на мысе Tuxen (западная Антарктида) |
|
28r5g |
5 °С |
Биоплёнка обрастания на вершине вертикальной скалы |
Примечание. * – штаммы изолированы из образцов, отобранных на острове Galindez, если не указано иначе.
Для культивирования бактерий использовали среду Nutrient Agar (HiMedia Laboratories Pvt. Ltd.) и глюкозо-картофельную агаризованную среду. Дрожжи выращивали на солодовом агаризованном сусле. Все микроорганизмы культивировали при 18–20 °С.
Выделение геномной ДНК проводили из клеточных суспензий микроорганизмов, зафиксированных 70 % этанолом. Нуклеиновые кислоты выделяли с помощью коммерческого набора ДНК-сорб по прилагаемым к наборам инструкциям производителя с небольшими модификациями (ФГУН ЦНИИ эпидемиологии Роспотребнадзора, Москва) [1].
Амплификацию препаратов ДНК изолированных культур бактерий проводили с коммерческим набором N-Taq (НТИ-Байкал, Иркутск) с консервативными бактериальными праймерами 27L (5´–3´: AGAGTTTGATCATGGCTCAG) и 1542R (5´–3´: CAKAAAGGAGGTGATCC) [2], дрожжей NS3 (5´–3´: GCAAGTCTGGTGCCAGCAGCC) и NS6 (5´–3´: GCATCACAGACCTGTTATTGCCTC) [8]. Использовали следующий режим реакции: в первом цикле денатурация при 95 °С – 5 мин, затем 30 циклов: денатурация 94 °С – 30 с, отжиг 52 °С – 30 с и элонгация 72 °С – 90 с, в последнем цикле время элонгации увеличивали до 7 мин. Амплификацию проводили в термоциклере Бис (БИС-Н, Россия). Дальнейший анализ ампликонов и подготовку к сиквенсной реакции вели по разработанным ранее методикам [2]. Нуклеотидные последовательности определяли на автоматическом секвенаторе ABI310A (ABI PRISM 310 Genetic Analyzer) в ЦКП «Геномика» СО РАН (г. Новосибирск). Очистка и секвенирование ПЦР продуктов рДНК штаммов O-1, O-3, O-7, O-10 были выполнены Macrogen Inc. (Южная Корея).
Филогенетический анализ. Полученные последовательности генов 16S рРНК бактериальных изолятов сравнивали с таковыми микроорганизмов, депонированных в базе данных GenBank, используя пакет программы BLAST. Филогенетическое положение определяли построением дендрограмм, показывающих положение изучаемого штамма среди близкородственных и типовых видов (пакеты программ ClustalX 2.1, Mega v. 6.00) с использованием метода ближайших соседей.
Аутэкологию, т.е. влияние экстремальных факторов на выживаемость микроорганизмов изучали у антарктических бактерий и дрожжей, изолированных из наземных экосистем (табл. 1). Устойчивость к ультрафиолетовому излучению определяли, как описано ранее [6]. Для количественной оценки данного показателя вычисляли летальные дозы УФ (ЛД90 и ЛД99,99). Психро- и галотолерантность микроорганизмов определяли стандартными методами в диапазонах 1–40 °C и 0,1–200 г NaCl/л соответственно.
Результаты исследования и их обсуждение
У изолятов из фитоценозов и орнитогенной почвы Антарктики изучены психро- и галотолерантность, а также УФ-резистентность. Для сопоставления особенностей аутэкологии и видового состава бактерий проведена молекулярно-генетическая идентификация чистых культур (табл. 2). Филогенетический анализ позволил определить преимущественно представителей грамположительных бактерий двух крупных фил Firmicutes и Actinobacteria: Micrococcus luteus, Microbacterium trichothecenolyticum, Sporosarcina aquimarina, Staphylococcus sp., Rhodococcus fascians, Frondihabitans spp. и Arthrobacter sp. Грамотрицательные бактерии представлены только Serratia sp., которая относится к классу Gammaproteobacteria. Дрожжи представлены 4 родами базидиомицетов (Rhodotorula spp., Tremella sp., Rhodosporidium sp. и Leucosporidium sp.) и 2 – аскомицетов (Chaetothyriales spp. и Debaryomyces sp.).
Таблица 2
Экофизиологические свойства исследованных микроорганизмов
|
Номера штамма |
Вид или род |
Летальные дозы УФ, Дж/м2 |
Диапазон роста |
||
|
ЛД90 |
ЛД99,99 |
NaCl, % |
T, °С |
||
|
Бактерии |
|||||
|
О-1 |
Micrococcus luteus |
70 |
220 |
0,1–10 |
5–30 |
|
О-3 |
Microbacterium trichothecenolyticum |
45 |
165 |
0,1–5 |
1–42 |
|
О-7 |
Sporosarcina aquimarina |
80 |
540 |
0,1–2 |
1–30 |
|
О-10 |
Staphylococcus sp. |
40 |
310 |
0,1–2 |
10–30 |
|
181n3 |
Rhodococcus fascians |
80 |
280 |
0,1–5 |
1–30 |
|
4r5 |
Frondihabitans sp. |
70 |
105 |
0,1–5 |
1–20 |
|
5r5 |
Frondihabitans sp. |
80 |
140 |
0,1–2 |
1–30 |
|
6r1g |
Serratia sp. |
40 |
75 |
0,1–5 |
1–30 |
|
28r5g |
Arthrobacter sp. |
75 |
240 |
0,1–5 |
1–30 |
|
40r5 |
Frondihabitans sp. |
65 |
120 |
0,1–2 |
1–30 |
|
Дрожжи |
|||||
|
S06 |
Tremella sp. |
350 |
1300 |
0,1–10 |
1–30 |
|
S10 |
Chaetothyriales sp. |
200 |
1600 |
0,1–15 |
5–30 |
|
S11 |
Leucosporidium sp. |
75 |
300 |
0,1–10 |
1–30 |
|
S12 |
Debaryomyces sp. |
75 |
230 |
0,1–10 |
1–30 |
|
S14 |
Rhodosporidium sp. |
200 |
1400 |
0,1–10 |
1–37 |
|
S33 |
Rhodotorula sp. |
280 |
1400 |
0,1–10 |
1–37 |
|
S36 |
Chaetothyriales sp. |
150 |
650 |
0,1–10 |
5–30 |
|
S48 |
Rhodotorula sp. |
250 |
800 |
0,1–10 |
1–37 |
|
S182 |
Rhodotorula sp. |
280 |
1150 |
0,1–15 |
1–37 |
|
S237 |
Chaetothyriales sp. |
120 |
650 |
0,1–15 |
5–30 |
Влияние УФ радиации. Разрушение озонового слоя над Антарктикой обуславливает высокий уровень солнечного излучения в регионе. Исследование устойчивости к УФ антарктических микроорганизмов выявило высокий уровень их резистентности (рис. 1, 2). Для большинства бактерий пороговая доза УФ, которая определяется размером «плеча» на дозовой кривой, составляла 40 Дж/м2. Этот показатель резистентности к УФ означает дозу облучения, до которой повреждения ДНК могут полностью репарироваться. Очевидно, что чем выше пороговая доза облучения, тем, соответственно, выше способность микроорганизмов к выживанию в экстремальных условиях повышенного УФ излучения.
Из числа исследованных бактерий наиболее устойчивы к УФ Sporosarcina aquimarina O-7 и Staphylococcus sp. O-10 (рис. 1), у которых ЛД99.99 составляла соответственно 540 и 310 Дж/м2 (табл. 2). Наиболее чувствителен штамм 6r1g, который близок роду Serratia (рис. 1). Пигментированные штаммы дрожжей были высоко резистентны к УФ (рис. 2). ЛД99,99 УФ для них варьировала в пределах 650–1600 Дж/м2 (табл. 2). Возможно, пигменты минимизировали клеточные повреждения у дрожжей при УФ облучении. Следует отметить, что уровень устойчивости микроорганизмов к УФ сохранился после пяти лет их хранения в лабораторных условиях (при периодических пересевах четыре раза в год), что свидетельствует о генетической стабильности данного признака.
Психро- и галотолерантность. Независимо от температуры (1–5 или 30 °С) при первичной изоляции штаммов из природных источников (табл. 1), все исследованные антарктические бактерии и дрожжи способны расти как при низкой (1–5 °С), так и умеренной (18–30 °С) температуре, т.е. они являются психротолерантными (табл. 2). Следовательно, антарктические штаммы способны расти в температурном диапазоне, характерном длительный период для Антарктики (1–5 °С), а также в короткий летний период, когда температура достигает 20°С и выше, особенно на южной стороне скал.
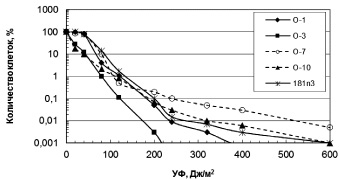
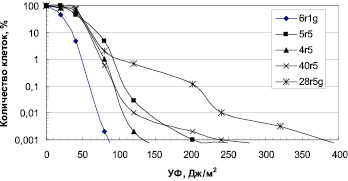
Рис. 1. Зависимость выживаемости антарктических бактерий от доз УФ облучения
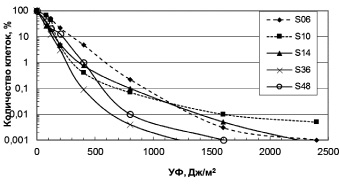
Рис. 2. Зависимость выживаемости антарктических дрожжей от доз УФ облучения. Обозначения на рисунках соответствуют номерам проанализированных штаммов
Проведенные нами эксперименты показали, что исследованные антарктические бактерии были умеренно галофильными (рост в среде, содержащей 2–5 % NaCl). Наиболее устойчивыми к NaCl были отдельные представители родов Micrococcus, Arthrobacter, Microbacterium, Rhodococcus, Frondihabitans и Serratia (рост при содержании 5 % NaCl в среде) (табл. 2). Все исследованные антарктические дрожжи росли в диапазоне NaCl в среде 0,1–10 % (табл. 2). Можно предположить, что формирование наземных микробиоценозов в Антарктике находится под влиянием Мирового океана, т.к. в прибрежной зоне континента и на островах во время регулярных штормов происходит постоянное орошение наземных ценозов морской водой с высокой минерализацией.
Стратегия выживания микроорганизмов в экстремальных условиях Антарктики, в частности при высоком уровне солнечного излучения, может обеспечиваться несколькими способами: как механизмами, которые минимизируют клеточные повреждения, так и системами репарации, которые устраняют повреждения ДНК. Минимизация повреждений у чёрных (Chaetothyriales spp.) и красных (Rhodotorula sp., Rhodosporidium sp.) дрожжей может происходить за счёт пигментов (соответственно, меланинов и каротиноидов). Непигментированные дрожжи (Leucosporidium sp. S11 и Debaryomyces sp. S12) были менее устойчивы к УФ радиации (табл. 2). При отсутствии пигментов микроорганизмы реализуют другие системы защиты. Так, для устранения повреждений ДНК, которые возникают при различных типах радиации, в том числе и при солнечном коротковолновом УФ излучении (независимо от наличия пигментов или их отсутствия), наиболее важным является функционирование у клеток эффективных систем репарации повреждений ДНК. Такое направление стратегии выживания используют экстремально радиорезистентные бактерии [9]. Как нами показано, антарктические микроорганизмы высоко устойчивы к УФ (рис. 1, 2), что, вероятно, обусловлено наличием активных систем репарации повреждений ДНК, о чём свидетельствуют высокие летальные дозы УФ радиации, которые являются мерой способности клеток к репарации повреждений ДНК.
Психрофилия микроорганизмов обеспечивается сложными метаболическими системами, в частности особенностями их ферментных белков и мембранных липидов. Увеличение у последних содержания ненасыщенных жирных кислот позволяет мембранам находиться в функционально активном жидкостно-кристаллическом состоянии при низких температурах. Способность к психрофилии определяется также синтезом в клетках значительного количества ключевых ферментов, что позволяет клетке активно функционировать даже при низкой температуре [3].
Маловероятно, что такие метаболически сложные механизмы, как УФ-резистентность и психротолерантность микроорганизмов, могли сформироваться как адаптивная реакция на действие абиотических стрессовых факторов, характерных для Антарктики. Особенно если принять во внимание аэрозольный, орнитогенный и антропогенный трансконтинентальный перенос микрофлоры в экосистемы Антарктики. Видимо, в условиях низких температур и высокого уровня УФ радиации преимущество для выживания в Антарктике получили микроорганизмы, которые изначально были способны расти при низкой температуре (1–5 °С) и которые имели эффективные механизмы репарации клеточных повреждений (в частности, повреждений ДНК), и/или пигменты (каротиноиды и меланины).
Заключение
Стратегия выживания микробных сообществ в Антарктике направлена на естественную селекцию психро- и галотолерантных, а также УФ-резистентных микроорганизмов, что является их природной реакцией на экстремальные условия Антарктики: низкую температуру, высокий уровень солнечной радиации и повышенную минерализацию в прибрежных зонах. Представленные данные позволяют предположить, что первопричиной формирования и эволюции микробных сообществ в Антарктике послужили низкая температура, высокий уровень УФ, а также географическая изоляция островов.
Работа выполнена при финансовой поддержке РФФИ № 14-04-90416-а-Укр и НАН Украины, договор № 02-04-14 (У).
Рецензенты:
Беликов С.И., д.б.н., профессор, зав. лабораторией аналитической биоорганической химии, ФГБУН «Лимнологический институт» Сибирского отделения РАН, г. Иркутск;
Иутинская Г.А., д.б.н., профессор, зав. отделом общей и почвенной микробиологии Института микробиологии и вирусологии НАН Украины, г. Киев.
Работа поступила в редакцию 18.11.2014



