Асептический некроз головки бедренной кости (АНГБК), аваскулярный некроз (МКБ-10) является серьезной патологией тазобедренного сустава (ТБС) с его разнообразными причинами, поздней диагностикой и плохо изученным патогенезом. Заболевание обычно развивается на фоне применения кортикостероидов, травмы сустава, злоупотребления алкоголем, панкреатита, серповидноклеточной анемии, ионизирующей радиации и др. [15].
Эпидемиология заболевания в России изучена мало: на долю АНГБК, по данным различных авторов, приходится от 1,2 до 4,7 % среди различных форм дегенеративно-дистрофических поражений тазобедренного сустава (ТБС) [6, 7]. Но в связи с тем, что этим заболеванием страдают в основном люди наиболее трудоспособного возраста (20–50 лет), причем мужчины болеют чаще женщин в 5–6 раз и преимущественно в возрасте 30–45 лет [6], оно занимает особое социальное место.
Выбор пациента в лечении АНГБК продолжает оставаться дилеммой, несмотря на улучшение как консервативных, так и хирургических подходов лечения этого заболевания. Поскольку наиболее часто диагноз АНГБК выставляется пациентам на основании рентгенологических исследований на поздних стадиях развития патологии, больным предлагается оперативное лечение. Безоперационное лечение АНГБК включает, как правило, следующие этапы: соблюдение оптимального ортопедического режима и лечебной гимнастики; медикаментозная терапия, в том числе внутрисуставная инъекционная терапия; коррекция ходьбы, в том числе с применением многоканальной электромиостимуляции; физиотерапия (лазеротерапия, магнитотерапия). По мнению большинства специалистов, консервативное лечение АНГБК считается малоэффективным, практически не замедляет деструктивные процессы в ТБС, и это, на наш взгляд, связано как с поздней диагностикой АНГБК, так и с малой эффективностью используемых препаратов, применяемых без учета механизма развития патологии.
Анализ медицинской литературы, посвящённой АНГБК, свидетельствует о том, что одной из основных версий механизма развития этого дегенеративного процесса в крупных суставах считается расстройство кровообращения (табл. 1), которое приводит к ишемии и последующим изменениям в структуре кости [13]. С учетом рассмотренной схемы патогенетического механизма развития АНГБК целью нашего исследования была разработка консервативного метода лечения АНГБК с привлечением новых противоишемических препаратов.
Таблица 1
Механизм развития АНГБК

Наше внимание привлек препарат перфторан (производитель ОАО «НП Перфторан», Россия) – плазмозамещающее средство на основе перфторорганических соединений. Наш подход к использованию перфторана (ПФ) при лечении АНГБК имеет следующее обоснование. ПФ зарегистрирован и официально применяется в клинике с 1996 года. ПФ или так называемая «голубая кровь» – кровезаменитель с газотранспортной функцией – обладает многофункциональным действием, которое изучено в эксперименте и клинике [3].
Основные аспекты действия препарата ПФ, которые нас заинтересовали, следующие.
1. Улучшение доставки кислорода из альвеол к эритроцитам и от эритроцитов к тканям.
2. Улучшение метаболизма и газообмена на уровне тканей.
3. Восстановление центральной гемодинамики.
4. Улучшение кровотока вплоть до периферической микроциркуляции.
5. Мембраностабилизирующий эффект.
6. Сорбционные и диуретические свойства.
7. Иммуномодулирующее действие.
В литературе имеется ряд данных по использованию ПФ для восстановления регионального кровотока при заболеваниях сосудов нижних конечностей, показано, что препарат оказался эффективен при ишемии конечностей практически независимо от этиологии ангиопатии: при сахарном диабете, атеросклерозе, эндартериите, посттравматическом и послеоперационном отеке тканей [2, 8].
Показано, что внутривенное введение ПФ больным с окклюзионными заболеваниями магистральных артерий нижних конечностей значительно улучшает кровоток уже через час после инфузии. После трехкратного введения ПФ заметный позитивный эффект сохраняется более 3 месяцев, несмотря на то, что уже через сутки содержание препарата в кровотоке ничтожно мало [5]. Возможно, что длительное сохранение эффекта действия ПФ связано с его влиянием на реологические свойства крови и улучшение структурно-функционального состояния мембран эритроцитов [1, 4].
Уникальные свойства перфторуглеродных соединений обусловлены особенностями их молекулярного строения. Низкая энергия межмолекулярных взаимодействий во фторуглеродных жидкостях обуславливает их способность растворять большие объемы газов, в том числе О2 и СО2. Растворимость кислорода в эмульсии ПФ значительно превышает растворимость в плазме. При этом молекулы газов не связываются с перфторуглеродами и свободно выделяются при снижении парциального давления. Таким образом, ПФ обладает ярко выраженной способностью осуществлять эффективный газообмен в ишемизированных тканях и, удаляя накопившиеся токсические недоокисленные продукты, оказывает выраженный противовоспалительный и мембраностабилизирующий эффект [9].
Данные по введению ПФ в ТБС для лечения АНГБК до наших исследований в научной медицинской литературе отсутствовали. Хотя именно в этом случае можно было ожидать дополнительной оксигенации, а следовательно, снижения степени гипоксии в тканях. Улучшение кровообращения в ишемизированном суставе, как следствие, должно приводить к нормализации кровообращения в субхондральной ткани и стимулировать процессы регенерации в очагах АНГБК. Целевая доставка ПФ непосредственно в область некроза под контролем УЗИ снижает медикаментозную нагрузку на организм пациента, а потому разработанный метод лечения АНГБК эффективен и безопасен для больного.
Цель нашей работы – обосновать клинико-патогенетически и исследовать эффективность внутрисуставных инъекций перфторана (ПФ) в тазобедренный сустав под контролем УЗИ для лечения АНГБК.
Материал и методы исследования
В клиническом исследовании участвовали 102 пациента (табл. 2). Все больные до обращения в наш Центр испытывали боли периодически или постоянно, несмотря на проводимое консервативное лечение, у 33 (63,5 %) больных с II стадией АНГБК хромота проявлялась в значительной степени. Критерием включения в исследование было наличие I A-С и II A-С стадии АНГБК в соответствии с классификацией ARCO (Association Research Circulation Osseous) [12]; стадия некроза II C, с поражением головки бедренной кости ≥ 30 %, наблюдалась только у 12 (11,8 %) пациентов, все они ожидали плановую операцию эндопротезирования.
Критериями исключения были беременность, острая инфекция и хроническая инфекция в стадии обострения, онкологические заболевания, наличие тяжелой сопутствующей соматической патологии в стадии декомпенсации. Исследование одобрено Локальным этическим комитетом Института химической биологии и фундаментальной медицины СО РАН (протокол № 16 от 14.04.2009). Все лица подписали информированное согласие на участие в исследовании.
Все пациенты в течение 3 лет проходили раз в полгода курс внутрисуставных инъекций ПФ под контролем УЗИ, как описано ранее [10, 11]: каждая инъекция содержит 2–4 мл ПФ, инъекции осуществляют в ТБС под контролем УЗИ 2–5 раз в неделю, в течение 1,5–2-х месяцев. Клинико-функциональное состояние ТБС оценивалось по шкале Харриса (Harris Hip Score) [14] до лечения, через 6, 12, 24, 36 месяцев. Объективизация морфологических изменений ТБС до и после лечения проводилась по данным МРТ пораженного сустава. Количественные данные обрабатывали методами параметрической статистики с использованием пакета программ «Microsoft Excel». Различия считали достоверными при p < 0,05.
Таблица 2
Исходные характеристики больных АНГБК (n = 102)
|
Показатель |
Значение |
|
Пол м/ж, n (%) |
50/52 (49,0/51,0) |
|
Средний возраст, годы, M ± σ |
44,5 ± 7,5 |
|
Локализация АНГБК двухсторонняя/односторонняя, n (%) |
48/54 (47,1/52,9) |
|
Стадии АНГБК I A-C/II A-C, n (%) |
44/58 (43,1/56,9) |
|
Факторы риска |
|
|
Ревматологическая патология, использование кортикостероидов, n (%) |
36 (35,3) |
|
Злоупотребление алкоголем, n (%) |
32 (31,4) |
|
Перенесенная инфекция, n (%) |
8 (7,8) |
|
Идиопатический, n (%) |
26 (25,5) |
|
Ожирение, n (%) |
63 (62,1 %) |
|
Гипертоническая болезнь, n (%) |
52 (51,0 %) |
Результаты исследования и их обсуждение
Инъекции ПФ в ТБС под контролем УЗИ в течение всего периода наблюдений хорошо переносились всеми пациентами. Через 12 месяцев от начала терапии только у 5 (8,6 %) больных из 58 со II стадией АНГБК процесс продолжал прогрессировать. Динамика показателей шкалы Харриса в процессе лечения пациентов с АНГБК перфтораном отражена на рисунке.
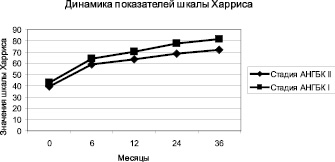
Динамика показателей шкалы Харриса в процессе лечения АНГБК перфтораном
Незначительная динамика показателей шкалы Харриса у всех пациентов в течение первых 6 месяцев лечения связана с сохранением умеренного болевого синдрома у большинства больных. В процессе лечения в течение 36 месяцев боль в ТБС достоверно уменьшалась; отмечалось увеличение числа больных, не испытывающих боли совсем или испытывающих слабую боль в суставе с 4,9 до 64,7 % (р < 0,05) через 12 месяцев от начала лечения и до 85,4 % (р < 0,05) больных через 24 месяца. Число больных, испытывающих сильную боль в ТБС, через 12 месяцев от начала лечения уменьшилось с 34,3 до 7,8 % (р < 0,05). К 36 месяцу наблюдения отсутствовали больные с сильной болью в ТБС. Положительные результаты через 36 месяцев от начала лечения ПФ по клинико-функциональной шкале Харриса были получены у 91 (89,2 %) пациента, деструктивные процессы в суставе были остановлены; у 46 (45,1 %) пациентов по МРТ отмечается АНГБК в стадии восстановления. Следует отметить, что в группе пациентов с I стадией АНГБК в сроки наблюдения 3 года показатели шкалы Харриса выросли в среднем на 38,8 единиц, что может быть оценено как хороший результат лечения.
Выводы
Показано, что патогенетически обоснованное лечение пациентов с ранними стадиями АНГБК, направленное на устранение ишемии в ТБС, с использованием внутрисуставных инъекций ПФ под контролем УЗИ, значительно улучшает функциональный статус больных. Анализ показателей по клинико-функциональной шкале Харриса показал, что лечение существенно улучшает возможности ходьбы, в том числе и по лестнице, способствует увеличению амплитуды движений в суставах, уменьшению болевого синдрома и позволяет отсрочить или избежать проведения операции тотального эндопротезирования ТБС.
Рецензенты:
Лифшиц Г.И., д.м.н., профессор, зав. лабораторией персонализированной медицины ЦНМТ Института химической биологии и фундаментальной медицины СО РАН, г. Новосибирск;
Овсянникова Т.В., д.м.н., зав. лабораторией проблем репродукции ЦНМТ Института химической биологии и фундаментальной медицины СО РАН, г. Новосибирск.
Работа поступила в редакцию 09.10.2014.



