Интерес к иммуномодулирующей терапии резко возрос в последние годы ввиду снижения иммунологической реактивности населения в целом и, как следствие, повышения инфекционной, аутоиммунной, онкологической, аллергической заболеваемости. Известно большое количество различных иммуностимулирующих препаратов, однако минимальное внимание в их ряду уделяется макро- и микроэлементам. Исследования в данной области позволят по-новому подойти к селективной модуляции отдельных звеньев иммунитета с помощью таких препаратов [1, 4].
По мнению большинства исследователей влияние кальция на организм, в частности на иммунокомпетентные клетки, остается малоизученным [4, 5]. Избирательные методы регуляции иммунных процессов могут быть глубже исследованы тогда, когда станут ясны механизмы иммунологической реактивности. Следовательно, выявление свойств и концентрации специфических маркеров антиген-презентирующих клеток лимфоидных органов и в частности селезенки после длительного воздействия препаратов кальция можно определить как попытку установления материальных основ афферентного звена модуляции иммунитета с помощью макро- и микроэлементов.
В многочисленных исследованиях, посвященных воздействию иммунотропных препаратов на организм, в основном использованы функциональные, клинические и иммунологические методы исследования [3, 4]. В научной литературе практически отсутствуют работы, в которых бы изучали структурную организацию и иммунокомпетентные клетки органов иммунной системы и, в частности, селезенки при поступлении кальция в организм. Кроме того, в условиях клиники органы иммунной системы недоступны для морфологического изучения после иммунокорригирующих лечебных мероприятий.
Iba-1 – кальций-связывающий пептид, который является специфическим маркером всех макрофагов (дентритных, интердигитирующих). Данный белок расположен в цитоплазме и ядрах изученных клеток [3]. Белок Iba-1 кодируется геном AIF-1, который располагается в области главного комплекса гистосовместимости (класс III) [7]. Этот белок участвует в регуляции процесса фагоцитоза у макрофагов и микроглиоцитов [9]. В последние годы иммуноцитохимическую реакцию на белок Iba-1 успешно применяют для маркировки активированной микроглии в ЦНС [3, 9]. До настоящего момента изучение данного пептида было ограничено только в пределах нервной системы. Наличие данных клеток в центральных и периферических органах иммунной системы сих пор не было доказано. Настоящее исследование направлено на определение Iba-1-позитивных клеток органов иммунной системы, в частности селезенки.
Цель исследования – идентификация, морфологическое описание и исследование количества, размеров и оптической плотности Iba-1-позитивных клеточных структур селезенки крыс в норме и на фоне длительного употребления соли кальция с питьевой водой.
Материал и методы исследования
Экспериментальное исследование выполнено в гистологической лаборатории ФГБОУ ВПО «Чувашский государственный университет имени И.Н. Ульянова», является частью комплексной программы «Гистохимия биогенных аминов в морфофункциональном состоянии органов и тканей в норме и в эксперименте» и входит в Координационный план РАМН (Российская Академия медицинских наук) (№ госрегистрации 0120.085.1887 от 10.09.2008 г.).
Объектом исследования служили 64 селезенки белых нелинейных лабораторных крысов-самцов одного возраста и одной массы (150–200 г). Исследуемые животные разделены на 2 группы:
Первая группа – контрольные животные (n = 32), получавшие ad libitum питьевую воду, соответствующую требованиям ГОСТ Р 52109-2003, СанПиН 2.1.4.1116-02.
Вторая группа – подопытные животные (n = 32), получавшие ad libitum питьевую воду, соответствующую требованиям ГОСТ Р 52109-2003, СанПиН 2.1.4.1116-02, с добавлением хлорида кальция в концентрации 235 мг/л в пересчете на кальций.
Ежедневно в течение двух месяцев опытные животные получали с питьевой водой в среднем 8,1–10,2 мг/кг кальция. Выбор хлорида кальция для изменения концентрации кальция в питьевой воде был обусловлен его растворимостью и опытом использования другими исследователями [1, 2].
Все действия, предусматривающие контакты с экспериментальными животными, проводились согласно «Правилам проведения работ с использованием экспериментальных животных» (приказ № 742 от 13.11.84 г. МЗ СССР), требованиям «Европейской конвенции о защите позвоночных животных, которые используются для экспериментальных и других научных целей» (Страсбург, 1986) и принципов Хельсинской декларации о гуманном отношении к животным. Выведение животных из эксперимента проводилось путем декапитации. Селезенку животных фиксировали 10 % нейтральным формалином, обезвоживали и заливали в парафин по стандартной методике.
Иммуногистохимический метод непрямого иммуноферментного анализа с антителами к кальций-связывающим адапторным молекулам (Iba-1) был использован для выявления Iba-1-позитивных клеток, имеющих моноцитарно-макрофагальное происхождение [10]. Срезы обрабатывались по стандартному протоколу: эндогенная пероксидазная активность подавлялась путем инкубации срезов в 3 % растворе перекиси водорода в течение 30 минут с последующей трехкратной промывкой 0,1 М фосфатным буфером; блок неспецифического связывания проводился при инкубировании срезов в течение 1 часа при комнатной температуре в 10 %-ной козьей сыворотке. В качестве первичных антител для выявления кальций связывающих адапторных молекул (Iba-1) были применены антитела против белка Iba-1 (1:500; Rabbit, Wako, Japan). Инкубация с первичными антителами проводилась в течение 18 часов при температуре 4 °С. В качестве вторичных антител использовались биотилинированные антитела (1:250; goat anti-rat IgG; Vector Laboratories). Для выявления биотиновой метки срезы обрабатывались авидин-пероксидазным комплексом (ABC, Vector Laboratories). Инкубация с 3,3-диаминобензидин тетрахлоридом (Sigma-Aldrich) придавала специфическое коричневое окрашивание структурам, содержащим белок Iba-1.
Морфометрический анализ включал измерение размеров Iba-1-позитивных клеточных структур (при увеличении объектива 10, 40, 100 и окуляра 18) под световым микроскопом МИКМЕД-5 с винтовым окулярным микрометром МОВ-1. Расчет площадей клеток проводился с использованием компьютерной программы «Sigma Scan Pro 5.0». О количественном распределении клеток судили по подсчету их в 12 полях зрения при увеличении объективов 40 и окуляра 18.
Замер оптической плотности вещества в клетках проводился с помощью программы «Sigma Scan Pro 5.0» в у.е. по сравнению с контрастом – плотность предметного стекла. Изучалась оптическая плотность мембранного белка Iba-1 в клеточных элементах селезенки. Исследованию подвергались 5 полей зрения микроскопа МИКМЕД-5, при увеличении в 720 раз (об. 40, ок. 18).
Статистическая обработка полученных цифровых данных проводилась с помощью программы Мicrosort Office Excel с оценкой достоверности различия средних величин по t-критерию Стьюдента и непараметрическим критериям Вилкоксона – Мана – Уитни. В работе приведены три уровня достоверности с вероятностью погрешности р < 0,0002, р < 0,38 и р < 0,04 даны для различий изучаемых показателей у крыс в сравнении с идентичными в контрольной группе [6].
Результаты исследования и их обсуждение
В данном исследовании пептид Iba-1 был впервые обнаружен в клетках красной пульпы, реактивной, мантийной и маргинальной зон лимфоидных узелков селезенки крыс в норме и после длительного поступления кальция.
В контрольной группе животных просматривается темно-коричневый фон срезов (красная пульпа селезенки), в котором хорошо контурируются лимфоидные узелки более светлого цвета. Последние имеют округлую форму, но различную величину. Внутри просматриваются центральные артериолы, расположенные эксцентрично. При увеличении микроскопа об. 40, ок. 18 определяются Iba-1-позитивные клеточные структуры однородного, интенсивно коричневого цвета, звездчатой формы, с множественными тонкими ветвящимися отростками. Они располагаются в узких межклеточных пространствах селезенки и форменных элементов крови (рис. 1, 2). Максимальная концентрация Iba-1-позитивных клеток обнаружена около периартериальной макрофагальной муфты.

Рис. 1. Селезенка крысы. Интактная группа. Иммуногистохимическая реакция с антителами к Iba-1. Микроскоп Микмед-5. Об. 10, ок. 18

Рис. 2. Лимфоидный узелок селезенки крысы. Интактная группа. Иммуногистохимическая реакция с антителами к Iba-1. Микроскоп Микмед-5. Об. 40, ок. 18
Общее абсолютное число идентифицированных как Iba-1-позитивных клеток в опытной группе равно 209, в контроле – 202 клетки (в 5 полях зрения микроскопа, об. 40, ок. 18).
После длительного поступления кальция в срезах селезенки внимание акцентируется на значительно укрупненных лимфоидных узелках за счет объединения и слияния нескольких соседних. В результате этого лимфоидные узелки приобретают полиморфную форму (рис. 3). Отличительной характеристикой микроструктур селезенки опытной группы также является четко выраженная маргинальная зона, отграничивающая лимфоидные узелки от красной пульпы за счет сконцентрированных Iba-1-позитивных макрофагов. Данная группа клеток наиболее представлена в белой пульпе, выявляясь, как правило, около центральных артериол.
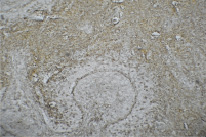
Рис. 3. Селезенка крысы. После поступления кальция с питьевой водой в течение 60 суток. Иммуногистохимическая реакция с антителами к Iba-1. Микроскоп Микмед-5. Об. 10, ок. 18
После двухмесячного поступления с питьевой водой кальция в гистологических срезах селезенки наблюдается тенденция к стабилизации размеров Iba-1-позитивных клеток, а значительные численные отличия не обнаруживаются между разными популяциями клеток в сравниваемых группах (табл. 1). В обеих группах обнаруживается преобладание крупных размеров клеток (вероятно, за счет длинных ветвящихся отростков). Однако абсолютное число очень крупных клеток в опытной группе превосходит на 40,7 %, что может свидетельствовать о склонности к укрупнению позитивных макрофагов.
Результат морфометрии свидетельствуют о том, что объем тех же клеточных структур обнаруживается преобладание малых популяций в обеих группах (табл. 2). После воздействия кальция происходит снижение числа клеток большого объема и рост числа средних размеров, что в общей картине дает представление о незначительном уменьшении объема исследуемых клеток.
Таблица 1
Морфометрические показатели площади Iba-1-позитивных клеток селезенки интактных крыс и после длительного употребления кальция
|
Популяции Iba-1-позитивных клеток селезенки крыс |
Площадь клеток, мкм 2 |
Количество Iba-1-позитивных клеток в контрольной группе, ед. (%) |
Количество Iba-1-позитивных клеток в опытной группе, ед. (%) |
Степень и направленность изменений |
|
Малые |
13–95,9 |
32 (15,8 %) |
18 (8,6 %)* |
–7,2 % |
|
Средние |
96–197,9 |
62 (30,6 %) |
78 (37,3 %)* |
+6,7 % |
|
Крупные |
198–388,9 |
89 (44,0 %) |
81 (38,7 %)* |
–5,3 % |
|
Очень крупные |
> 389 |
19 (9,6 %) |
32 (15,4 %)* |
+5,8 % |
|
Количество Iba-1-позитивных клеток в пяти полях зрения микроскопа |
202 |
209 |
+3,4 % |
Примечание. * – достоверность (р < 0,05) по сравнению с контрольными данными.
Таблица 2
Морфометрические показатели объема Iba-1-позитивных клеток селезенки интактных крыс и после длительного употребления кальция
|
Популяции Iba-1-позитивных клеток селезенки крыс |
Объем клеток, мкм 3 |
Количество Iba-1-позитивных клеток в контрольной группе, ед. (%) |
Количество Iba-1-позитивных клеток в опытной группе, ед. (%) |
Степень и направленность изменений |
|
Малые |
33–629,9 |
103 (50,9 %) |
111 (53,1 %)* |
+2,2 % |
|
Средние |
630–1944,9 |
61 (30,1 %) |
80 (38,2 %)* |
+8,1 % |
|
Крупные |
1945–4141,9 |
33 (16,3 %) |
16 (7,6 %)* |
–8,7 % |
|
Очень крупные |
> 4142 |
5 (2,7 %) |
2 (1,1 %)* |
–1,6 % |
|
Количество Iba-1-позитивных клеток в пяти полях зрения микроскопа |
202 |
209 |
+3,4 % |
Примечание. * – достоверность (р < 0,05) по сравнению с контрольными данными.
В контрольной группе оптическая плотность кальций-связывающего белка (Iba-1) равна 0,78 у.е. (при стандартном отклонении 0,04). В опытной группе крыс, употреблявших питьевую воду с кальцием, наблюдается достоверное увеличение плотности этого мембранного белка до 0,91 (при стандартном отклонении 0,1). Расчет критерия Стьюдента, который равен 0,009, показал высокую достоверность результатов.
Заключение
В нашем исследовании пептид Iba-1 был впервые обнаружен в клетках белой и красной пульпы селезенки крыс в норме и после длительного поступления кальция. Максимальная концентрация Iba-1-позитивных клеток обнаружена около периартериальных макрофагальных муфт с клетками, обладающими фагоцитарной активностью. Сравнение полученных данных с результатами других исследований позволяет предположить, что не все используемые в настоящее время антитела к белку Iba-1/AIF-1 выявляют один и тот же продукт [3, 7, 9].
Iba-1-позитивные клетки в большом количестве представлены в белой пульпе, выявляясь, как правило, около центральных артериол (Т-зависимая зона). Это дает нам повод предположить преобладание интердигитирующих макрофагов в данной зоне. В обеих группах обнаруживается преобладание малых размеров клеток.
Структурная организация большинства выявленных Iba-1-позитивных клеток белой и красной пульпы селезенки крыс позволяет идентифицировать эти клетки как макрофаги. Они имеют характерные локализацию и форму, своеобразное ветвление отростков, что соответствует многочисленным описаниям и изображениям в литературе [3, 8, 9].
Как показывают литературные источники, к макрофагам относят моноциты крови, гистиоциты соединительной ткани, эндотелиальные клетки капилляров селезенки. Типичные макрофаги селезенки располагаются внутри и снаружи синусов, среди адвентициальных или паренхиматозных клеток. Они имеют неровную поверхность с многочисленными гребнями [8, 9]. В лимфоидных узелках селезенки, богатых В-лимфоцитами, преобладают дендритные ретикулярные клетки. Эти клетки, по данным Wen L. (2005), не фагоцитируют, имеют тонкий ободок цитоплазмы и соединены друг с другом десмосомами. В областях, богатых Т-лимфоцитами (периартериальные лимфатические муфты селезенки), клетки стромы имеют полиморфное ядро и отростки особой формы, напоминающие переплетающиеся пальцы. Это интердигетирующие макрофаги – крупные клетки, в цитоплазму которых глубоко выпячивается либо часть лимфоцита, либо весь лимфоцит. В то же время Wen L. расценивает их вместе с дендритными как ретикулярные клетки [11]. McCuskey L. (2000) установил, что Т-лимфоциты вновь возвращаются к указанным макрофагам и располагаются в тесном контакте с ними [8]. Интердигетирующие макрофаги, по-видимому, влияют на дифференцировку Т-лимфоцитов.
Данное исследование показывает, что применение антител к белку Iba-1 позволяет маркировать фагоцитирующие клетки не только в органах центральной нервной системы, но и в селезенке.
Экспериментальные исследования поддержаны научными грантами Фонда содействия развитию малых форм предприятий в научно-технической сфере «Исследование морфофункциональных изменений биоаминсодержащих структур селезенки при водном воздействии кальция» (государственный контракт № 6975р/9584 от 04.09.2009); «Разработка оптимального состава хлеба, обогащенного кальцием, и исследование влияния продукта на показатели состояния здоровья обследуемых групп населения» (государственный контракт № 11306р/20545 от 14.01.2013).
Рецензенты:
Воронов Л.Н., д.б.н., профессор кафедры биологии и основ медицинских знаний, ФГБОУ ВПО «Чувашский государственный педагогический университет им. И.Я. Яковлева», г. Чебоксары;
Кириллов Н.А., д.б.н., профессор кафедры биотехнологии и переработки сельскохозяйственной продукции, ФГБОУ ВПО «Чувашская государственная сельскохозяйственная академия», г. Чебоксары.
Работа поступила в редакцию 01.10.2014.



