Система комплемента является одним из основных механизмов реализации как врождённого, так и приобретённого иммунитета. И несмотря на то, что все активационные и регуляторные механизмы до сих пор не определены, исследования в этой области демонстрируют важность системы комплемента при тяжёлых состояниях [7]. Имеется возможность активации каскада комплемента через три пути: классическому, лектиновому и альтернативному, которые сходятся в конечной точке реализации общих эффекторных функций [4]. Каскад комплемента протекает через управляемый, ограниченный протеолиз и конформационные изменения белков. Активация комплемента сопровождается усилением фагоцитоза и цитотоксических эффектов, оказывает инициирующее влияние на все виды иммунокомпетентных клеток и усиливает их хемотаксис к очагу поражения. Появление в результате активации и протеолитического превращения белков системы комплемента цитокиноподобной субъединицы С5а сопровождается усилением воспалительной реакции и цитотоксическими эффектами [1]. В настоящее время основной объём публикаций направлен на исследование эффектов системы комплемента, связанных с противоинфекционной [11, 15] и противовирусной [13] иммунной защитой. Однако, некоторые авторы описывают связь между нарушениями в системе комплемента с тяжёлым течением сепсиса [3, 9] и формированием органных дисфункций [12]. Однако, некоторые авторы указывают на то, что до сих пор остаются недостаточно изученными некоторые механизмы активации и функционирования системы комплемента [2]. Все вышеизложенное свидетельствует о несомненном вкладе компонентов системы комплемента в патогенез системного воспаления. Однако изучение значения активации каскада этой системы по одному из известных путей применительно к патогенезу системного воспалительного ответа в послеоперационном периоде пациентов с инфекционным эндокардитом находится на начальных этапах.
Цель: изучить значение изменения активности классического, лектинового и альтернативного путей активации комплемента, а также динамику С5а субъединицы комплемента в формировании системного воспалительного ответа в послеоперационном периоде протезирования клапанов сердца пациентов с инфекционным эндокардитом.
Материалы и методы исследования
В качестве методологической основы принято ретроспективное когортное исследование в модели случай ˗ контроль. В исследование включено 110 пациентов с верифицированным диагнозом инфекционный эндокардит, подвергшихся хирургическому лечению в объёме полостной операции по протезированию клапанов сердца в условиях искусственного кровообращения на базе ФГБУ «НИИ КПССЗ» СО РАМН, г. Кемерово. Сбор материала осуществлялся с 2010 по 2013 гг.
Критерии включения: установленный клинически и инструментально диагноз инфекционного эндокардита, возраст не менее 20 и не более 70 лет, подписанное информированное согласие на участие в исследовании. Критерии исключения: смена диагноза по результатам морфологического исследования удалённых тканей, сочетанные операции, наличие в анамнезе злокачественных новообразований, отказ от участия в исследовании, развитие в госпитальном периоде после операции (до момента выписки) осложнений инфекционного генеза (сепсис и другие похожие состояния).
Диагноз инфекционного эндокардита установлен на основании анамнестических данных, клинической картины, клинико-лабораторных методов исследования (трёхкратные бактериологические исследования посевов крови, данные ЭХО-кардиографии, результаты гистологического исследования удалённых клапанов сердца).
Все пациенты прошли предоперационную подготовку (в том числе курс антибиотикотерапии), находились в «холодном периоде» основного заболевания (степень активности инфекционного эндокардита на момент операции минимальна), были компенсированы по степени хронической сердечной недостаточности (не более IIБ стадии по Василенко-Стражеско).
Наличие и выраженность системного воспалительного ответа (СВО) в послеоперационном периоде оценивали по критериям R. Bone (Bone R.C. 1992), степень тяжести состояния пациента – по шкале APACHE II (Acute Physiology And Chronic Helth Evalution) (Knaus W.A., 1985), степень полиорганной недостаточности (ПОН) по шкале SOFA (Sepsis-Related Organ Failure Assessment) (J-L. Vincent et al., 1996). По клиническому течению послеоперационного периода все пациенты были разделены на три группы: 1-я группа (без осложнений) – 36 пациентов, имеющих в послеоперационном периоде не более 2-х признаков СВО по R.Bone, APACHE II 0–1 балл, SOFA- 0–1 балл; 2-я группа (осложненный СВО) – 49 пациентов имеющих 3 и более критерия по R. Bone, APACHE II 2–3 балла SOFA – 1–2 балла в 1-е сутки. И 25 человек составили 3-ю группу (СВО с ПОН) – 3 и более признака СВО по R. Bone, APACHE II 3–4 балла и более 3 баллов по шкале SOFA.
Средний возраст пациентов в исследовании составил 50 (36; 58) лет, при этом 71 человек (64,55 %) – мужчин и 39 человек (35,45 %) – женщин.
Кровь забирали из центральной локтевой вены в вакуумные коммерческие пробирки с активатором свёртывания. Cыворотку аликвотировали, хранили при -700 C. Скрининг активации комплемента по одному из путей проводили с использованием коммерческих наборов «Wieslab®Complement system Scrinkit» (Euro Diagnostica Headquarters, Швеция). Количественное определение С5а компонента комплемента с использованием коммерческого набора «HUMAN C5a EISA TEST KIT» (Hycult Biotech, Нидерланды). Исследования проводились по протоколам производителя в следующие сроки: до операции, в 1-е и на 7-е сутки после операции. Статистический анализ проводили непараметрическими методами с использованием Statistica 6.0. Результаты выражали в виде медианы (МЕ) и 25 % и 75 % межквартильных отклонений. Различия считали значимыми при уровне р < 0,01.
Результаты исследования и их обсуждение
Определили, что до операции у всех обследованных пациентов активность комплемента, независимо от пути инициализации (рис. 1), находилась на одном уровне (р ˃ 0,01).
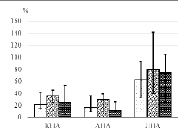
До операции
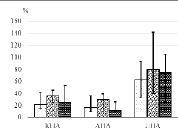
1-е сутки после операции
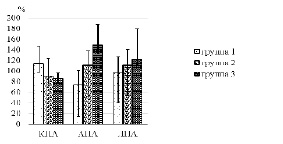
7 – сутки после операции
Рис. 1. Динамика инициализации комплемента в периоперационном периоде пациентов с инфекционным эндокардитом, КПА – классический путь активации, АПА – альтернативный путь активации, ЛПА – лектиновый путь активации
Однако активность лектинового пути в это время была выше (р < 0,01), чем у двух других путей инициализации комплемента (таблица), несмотря на значительные межиндивидуальные различия у пациентов одной группы. Учитывая известные данные о непосредственной связи этого пути комплемента с противоинфекционной защитой [10], можно заключить, что его активность до операции напрямую связана с профилем активности врождённого иммунного ответа, сформированным в результате течения инфекционного эндокардита.
Активность комплемента до операции у пациентов с инфекционным эндокардитом, в %
|
Группа |
Путь активации комплемента |
Р = |
||
|
Классический |
Альтернативный |
Лектиновый |
||
|
Без осложнений (n = 26) |
20, 00 (14,00; 42,00) |
16,97 (9,53; 35,37) |
62,34 (32,39; 93,17) |
р 1 ,3 < 0,01 р 2,3 < 0,01 |
|
Осложнённого СВО (n = 22) |
35,30 (25,00; 45,00) |
30,28 (10,51; 38,76) |
79,67 (39,43; 141,33) |
р 1 ,3 < 0,01 р 2,3 < 0,01 |
|
СВО с ПОН (n = 20) |
25,00 (5,00; 53,00) |
11,10 (10,01; 25,61) |
74,21 (25,61; 104,98) |
р 1 ,3 < 0,01 р 2,3 < 0,01 |
В раннем послеоперационном периоде межгрупповых различий по активности лектинового пути активации комплемента также не было (Н = 5,53, р = 0,06), а его активность в целом не претерпевала значительных (р ˃ 0,01) изменений (рис. 1). Так, у пациентов 1-й группы его активность была на уровне 77,38 (34,05; 143,03) %, у пациентов 2-й группы -77,02 (56,76; 111,57) % и 3-ей – 105,08 (96,93; 143,85) %. Это косвенно подтверждает неинфекционный генез системного воспалительного ответа у пациентов в этот момент послеоперационного периода.
В это время основным инициирующим путём активации комплемента являлся классический. Так, в 1-е сутки после операции его активность усилилась у пациентов всех анализируемых групп. По сравнению с дооперационным его активность значительно усилилась как у пациентов 1-й группы (60,53 (38,05; 95,96) %, р = 0,0001), так и у пациентов 2-й (104,42 (85,09; 130,05) %, р < 0,0001) и 3-ей (156,73 (100,38; 251,62) %, р < 0,0001). При этом наибольшая активность определена в группе СВО с ПОН (р < 0,0001). Высокая активность классического пути комплемента в это время может быть связана с необходимостью противостоять постишемической транслокации микрофлоры из кишечника, а также инициирована механическим повреждением тканей и проведением искусственного кровообращения [6]. В то же время, в одном из исследований [8], была показана прямая корреляционная связь чрезмерной активации каскада комплемента и фатальным исходом реперфузионных повреждений миокарда после нелетальной остановки сердца, что отражалось в динамике активации комплемента по данному пути. И если в 1-е сутки лидировала активность классического пути у пациентов группы СВО с ПОН, то в позднем послеоперационном периоде уровень активности в разных группах не имел значимых отличий (Н = 0,77, р = 0,68). Это произошло как за счёт очередного значимого подъёма активности у пациентов группы без осложнений (113,85 (66,86; 156,19) %, р = 0,01), так и за счёт снижения у пациентов с СВО с ПОН (86,03 (78,75; 97,119), р = 0,032). Обращает внимание, что у пациентов с осложнённым СВО активность осталась в диапазоне значений, регистрируемых в раннем послеоперационном периоде (90,56 (75,14; 123,62) %, р = 0,68). Высокая активность классического пути связывается с нарастанием в сыворотке крови титра антител, как эндогенной, так и микробной природы. Благодаря адекватному реагированию врождённой иммунной системы транзиторная постишемическая транслокация микрофлоры не имела фатального значения, а презентация антигена клеткам адаптивного иммунного ответа позволила к 7-м суткам переключить иммунную защиту на следующий уровень, с синтезом специфических антител.
Одновременно в 1-е сутки после операции регистрировалось усиление активности альтернативного пути комплемента (р < 0,01) у пациентов всех групп. Для пациентов группы без осложнений уровень активности соответствовал 40,58 (28,74; 83,95) %, группы осложнённого СВО – 73,21 (22,81; 100,70) %, а при СВО с ПОН поднимался до 96,93 (86,47; 111,03) %. Однако межгрупповых различий в это время определено не было (Н = 5,73, р = 0,057). Затем, в позднем послеоперационном периоде, инициализация комплемента по альтернативному пути у всех пациентов продолжалась (р < 0,01). Наибольшая его активность на 7-е сутки наблюдалась у пациентов с СВО с ПОН (149,40 (136,39; 187;71) %), а наименьшая у пациентов без осложнений (73,65 (57,33; 84,05) %). Активность альтернативного пути комплемента у пациентов с осложнённым течением СВО в это время была на промежуточном уровне между двумя вышеописанными группами (110,94 (51,97; 138,34) %). Таким образом, в случае развития системного ответа по варианту СВО с ПОН отмечается потеря контроля регуляции активности этого пути. Схожая динамика, но меньшей степени выраженности, отмечается у пациентов группы осложнённого СВО. Однако регистрируемые уровни активности ниже, что обеспечивает более низкую степень тканевых повреждений и абортивность органной дисфункции.
Следует отметить, что на протяжении всего периоперационного периода динамика активации лектинового пути комплемента также имела свои особенности в зависимости от варианта течения СВО. Для варианта СВО с ПОН было характерно значительное усиление его активности к концу наблюдения (122,00 (111,19; 179,12) %, р = 0,01), такая же тенденция прослеживалась и при неосложнённом СВО (97,07 (60,28; 137,98), р = 0,006). В то же время, у пациентов группы осложнённого СВО значимых отличий активности от уровня до операции (111,15 (54,52; 140,64), р = 0,22) не определено.
Высокая активность комплемента сопровождается возрастанием числа мембраноатакующих комплексов и опосредует клиническую манифестацию в виде органных дисфункций (в первую очередь сердечной и почечной недостаточности). Реализация эффекторных цитолитических механизмов зависит от образования субъединиц C5a и последующего каскада C5B -9 компонентов комплемента [5], что приводит к образованию терминального комплекса нарушениям клеточной стенки.
Нами было определено, что у пациентов группы СВО с ПОН, имеющих на всем протяжении периоперационного периода высокую активность комплемента, уровни С5а субъединицы были самыми высокими (рис. 2).
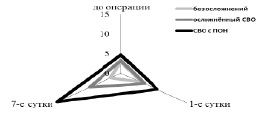
Рис. 2. Диаграмма динамики С5а субъединицы компонента комплемента в периоперационном периоде пациентов с инфекционным эндокардитом
Несмотря на отсутствие разницы в уровнях активности путей комплемента, ещё до операции сывороточные концентрации С5а субъединицы компонента комплемента у пациентов группы СВО с ПОН (4,46 (3,78; 6,02) пг/мл) были выше (0,004), чем таковые пациентов группы без осложнений (2,93 (2,43;4,35) пг/мл), но не отличались от уровней пациентов группы осложнённого СВО (3,23 (1,77; 5,84) пг/мл), что свидетельствует о большей степени активности комплемента у пациентов группы СВО с ПОН в период начала основного заболевания, до момента проведения консервативной терапии по стабилизации инфекционного процесса. В последующем, параллельно с инициализацией комплемента, происходит увеличение количества и С5а субъединицы в сыворотке крови. Наиболее выраженное увеличение его концентраций определено у пациентов группы СВО с ПОН. В 1-е сутки количество С5а у этих пациентов увеличилось до 8,23 (6,04; 9,56) пг/мл, р = 0,001). На на 7-е сутки у пациентов этой группы отмечается потеря контроля над регуляцией активности комплемента, что отражается в значимом (р = 0,001) дополнительном увеличении сывороточного уровня С5а субъединицы (14,56 (12,03; 17,97) пг/мл). Так как высокие концентрации С5а субъединицы комплемента связаны с повреждением клеточных стенок различных тканей, то и подтверждается его участие в формировании органной недостаточности в результате ишемического и реперфузионного повреждения после операций в условиях искусственного кровообращения. Похожая динамика описана для критических состояний [14], но связана с сепсисом.
Аналогичная предыдущей динамика С5а субъединицы комплемента у пациентов группы с осложнённым СВО связана с увеличением концентраций в послеоперационном периоде (рис. 2). Однако его уровни на всем протяжении наблюдения ниже (5,26 (3,1; 7,08) пг/мл, р = 0,007 в 1-е сутки и 7,24 (4,79; 8,77) пг/мл, р < 0,001), чем у пациентов группы СВО с ПОН. Менее выраженная интенсивность клеточных повреждений, связанных с анафилатоксическим действием С5а субъединицы комплемента, может отражаться в обратимости тканевых деструктивных процессов и абортивности органной недостаточности.
В противовес имеющимся у пациентов с осложнениями СВО увеличениям количества сывороточных С5а субъединиц комплемента, у пациентов без осложнений СВО в послеоперационном периоде наблюдается иная динамика (рис. 2). В соответствии с усилением активности комплемента в 1-е сутки у пациентов этой группы увеличивается и количество сывороточного С5а (4,56 (3,73; 5,87) пг/мл, р = 0,003), но его концентрации ниже чем у пациентов группы СВО с ПОН (р = 0,001). На 7-е сутки концентрации С5а субъединицы возвращаются к исходным (2,35 (1,56; 3,39) пг/мл, р = 0,07), и его количество в это время ниже чем у пациентов как группы с осложнённым СВО (р < 0,001), так и группы СВО с ПОН (р < 0,001). Как и умеренная активация комплемента, динамика С5а субъединицы комплемента у пациентов группы без осложнений СВО свидетельствует о регулируемом системном воспалении, направленном в послеоперационном периоде на восстановление гомеостаза и элиминации экзо- и аутотоксинов.
Выводы
Наибольшее значение в формировании системного воспалительного ответа после протезирования клапанов сердца у пациентов с инфекционным эндокардитом в раннем послеоперационном периоде имеет активность классического пути комплемента. Альтернативный путь имеет значение при развитии осложнений в позднем послеоперационном периоде. Параллельно, в развитии осложнений системного воспалительного ответа вносит С5а субъединица комплемента. Его высокие дооперационные концентрации связаны с увеличением риска развития полиорганной недостаточности.
Рецензенты:
Лисаченко Г.В., д.м.н., профессор, заведующий кафедрой патологической физиологии, ГОУ ВПО «Кемеровская государственная медицинская академия» Минздрава Российской Федерации, г. Кемерово;
Будаев А.В., д.м.н., профессор кафедрой патологической физиологии, ГОУ ВПО «Кемеровская государственная медицинская академия» Минздрава Российской Федерации, г. Кемерово.
Работа поступила в редакцию 05.08.2014.



