Поиск новых подходов к лечению черепно-мозговой травмы является одной из насущных задач современной нейрохирургии. В этом аспекте большой интерес представляют клеточные технологии, среди которых наибольшие перспективы связывают с использованием мезенхимальных стромальных клеток (МСК). В ряде работ была продемонстрирована способность данного типа клеток улучшать неврологическое восстановление в моделях черепно-мозговой травмы у экспериментальных животных [4, 5, 6, 7]. Позитивный эффект МСК связывают с продукцией широкого спектра ростовых и трофических факторов, способных активировать нейрональные предшественники и ангиогенез, стимулировать процессы нейропластичности и ускорять проведение нервных импульсов через синапсы, а также подавлять воспаление и апоптоз нервных клеток в очаге повреждения [2, 8, 9,]. Кроме того, не исключается возможность миграции МСК в ткани поврежденного головного мозга с последующей дифференцировкой в нейрональном направлении [2, 10].
Традиционно в качестве источника МСК используется костный мозг, однако в последнее время большой интерес представляют МСК, полученные из жировой ткани. Сравнительный анализ МСК различного тканевого происхождения свидетельствует о существовании определенных различий в свойствах МСК, выделенных из разных тканей [3]. Подобные данные имеют не только фундаментальное значение, но также важны при выборе оптимального источника МСК для клинического использования. Однако в доступной литературе практически не освещен вопрос о сравнительной эффективности костномозговых МСК и МСК, выделенных из жировой ткани. Проведенные нами ранее исследования показали, что КМ-МСК и ЖТ-МСК оказывали схожий стимулирующий эффект на неврологическое восстановление в модели очагового повреждения головного мозга [4]. При этом оставалось неясным, насколько выявленное улучшение моторных функций связано с нормализацией функциональной (электрофизиологической) активности головного мозга и одинаков ли эффект КМ-МСК и ЖТ-МСК в этом аспекте.
Цель исследования: оценка динамики показателей ССВП в модели очагового повреждения головного мозга на фоне спонтанного восстановления и трансплантации КМ-МСК и ЖТ-МСК.
Материалы и методы исследования
Исследования проводились на крысах линии Вистар (обоего пола; средняя масса 250–270 г.), с соблюдением этических норм, регламентированных приказом МЗ РФ №266 от 19.03.2003 г. Операции по моделированию очаговых повреждений головного мозга проводили в соответствии с патентом [5]. Животные в пред- и послеоперационном периоде содержались в условиях вивария Новосибирского НИИ травматологии и ортопедии. МСК костного мозга и жировой ткани получали согласно описанной ранее методике [3].
В ходе исследования были сформированы 6 групп животных, включая две контрольные и четыре опытные группы. Контрольные группы: 1-я – животные с трепанацией, но без нанесения травмы (n = 3), 2-я – «хирургический контроль» (с нанесением травмы, но без введения клеток; n = 6). Животным опытных групп после формирования очагового повреждения вводили клетки (1x106 на животное; через хвостовую вену): 3-я группа – введение КМ-МСК на 1-е сутки (n = 8), 4-я – введение ЖТ-МСК на 1-е сутки (n = 8), 5-я - введение КМ-МСК на 7-е сутки (n = 8), 6-я - введение ЖТ-МСК на 7-е сутки (n = 8). Для объективной инструментальной оценки функционального состояния мозга при травме одного из полушарий и оценки динамики состояния в ходе лечения с применением каждого из видов клеточной терапии регистрировались корковые соматосенсорные вызванные потенциалы (ССВП) на стимуляцию нервов передних конечностей с помощью электромиографа «Нейропак-2» (NIHON KOHDEN Corp., Япония) [1, 9]. Оценка нейрофизиологических показателей включала измерение амплитуды пиков (в мкВ) и латентность (в мс) компонентов ССВП.
Статистическую обработку данных проводили с использованием пакета программ Statistica 6.0 (StatSoft). Для оценки достоверности различий использовали критерий Манна-Уитни (для сравнения непрерывных переменных). Различия считали достоверными при уровне значимости p < 0,05.
Результаты исследования и их обсуждение
Регистрация ССВП интактного головного мозга крыс (до проведения трепанации) показала, что величина амплитуды ССВП составляла в среднем 13,5 ± 0,81 мкВ, задержка основного негативного компонента – 8,7 ± 0,14 мс. При этом межполушарные различия амплитуд и показателей латентности компонентов ССВП не превышали 10 %.
У животных контрольной группы 1 (с трепанацией) значения амплитуд и латентности компонентов ССВП во все сроки наблюдения не отличались от таковых у интактных животных, как на интактной стороне, так и на стороне трепанации. Эти данные указывают на то, что процедура трепанации не вызывает нарушений электрофизиологической активности головного мозга, по данным ССВП. У животных контрольной группы 2 в первые сутки после травмы регистрировалось снижение величины амплитуды ССВП на стороне повреждения в 2–5 раз. Восстановление данного показателя в динамике было крайне незначительным, и к 21 суткам величина амплитуды составляла лишь 30 % от исходного уровня. Наряду с этим в этой группе отмечалось статистически значимое возрастание латентности компонентов ССВП, которое регистрировалось на всех сроках наблюдения. Выявленные изменения показателей ССВП регистрировались только на стороне повреждения и отсутствовали в интактном полушарии, поэтому в последующих таблицах (начиная с табл. 2) опущены результаты измерения параметров ССВП для интактной стороны и представлены данные только для стороны повреждения.
Анализ влияния клеточной терапии на показатели ССВП у животных с очаговым повреждением головного мозга показал, что введение МСК в первые сутки после травмы сопровождалось достоверным увеличением амплитуды ССВП на всех сроках наблюдения (7-ые, 14-ые и 21-ые сутки). При этом значения амплитуды в каждой точке наблюдения двукратно превышали таковые в контрольной группе 2. Значения другого регистрируемого показателя ССВП – латентности – в первые две недели после введения МСК не отличались от контроля. Однако при регистрации ССВП на 21-ые сутки величина латентного периода у животных, получивших клетки, была значимо более низкой. Сравнительный анализ результатов введения МСК, полученных из костного мозга и жировой ткани, показал, что эффекты КМ- и Ж-МСК, вводимых в первые сутки после травмы, достоверно не различались. Таким образом, введение клеток в раннем посттравматическом периоде сопровождается более быстрым восстановлением электрофизиологических показателей, при этом амплитуда ССВП восстанавливается на 56%, латентность – на 66 % от исходного уровня. Однако полного восстановления электрофизиологической активности головного мозга к 21-ым суткам не происходит.
Таблица 1
Значения амплитуд ССВП (мкВ) и латентности ССВП (мс) в контрольных группах
|
Группы животных |
Сторона регистрации |
Латентность (мс) |
|||
|
1 сутки |
7 сутки |
14 сутки |
21 сутки |
||
|
Группа 1 (трепанация) |
Интактная |
9,1 ± 0,4 |
8,9 ± 0,2 |
9,0 ± 0,2 |
9,1 ± 0,2 |
|
Сторона трепанации |
9,0 ± 0,3 |
8,8 ± 0,4 |
7,9 ± 0,6 |
8,0 ± 0,8 |
|
|
Группа 2 (травма) |
Интактная |
9,0 ± 0,2 |
8,9 ± 0,3 |
8,0 ± 0,5 |
8,0 ± 0,6 |
|
Сторона повреждения |
11,7±0,3*# |
10,9 ± 0,4*# |
9,8 ± 0,9*# |
10,9 ± 0,3*# |
|
|
Амплитуда (мкВ) |
|||||
|
Группа 1 (трепанация) |
Интактная |
15,4 ± 0,6 |
15,4 ± 0,6 |
15,3 ± 0,6 |
15,4 ± 0,6 |
|
Сторона трепанации |
15,3 ± 0,3 |
15,2 ± 0,2 |
15,3 ± 0,3 |
15,3 ± 0,3 |
|
|
Группа 2 (травма) |
Интактная |
15,2 ± 0,2 |
15,1 ± 0,2 |
15,2 ± 0,2 |
15,3 ± 0,3 |
|
Сторона повреждения |
2,9 ± 0,1*# |
3,8 ± 0,3*# |
3,7 ± 0,4*# |
4,9 ± 0,9*# |
|
Примечание:
* – достоверность различий с интактными животными, # – достоверность различий с интактной стороной (p < 0,01).
Таблица 2
Значения амплитуд (мкВ) и латентности (мс) ССВП на стороне повреждения после введения клеток на 1-ые сутки после травмы
|
Группы животных |
Показатели ССВП |
7 сутки |
14 сутки |
21 сутки |
|
Группа 2 (без введения клеток) |
Амплитуда |
3,8 ± 0,3 |
3,7 ± 0,4 |
4,9 ± 0,9 |
|
Латентность |
10,9 ± 0,4 |
9,8 ± 0,9 |
10,9 ± 0,3 |
|
|
Введение клеток (группы 3 и 4) |
Амплитуда |
5,65 ± 0,5* |
6,8 ± 0,7** |
8,6 ± 0,8** |
|
Латентность |
10,3 ± 0,4 |
10,4 ± 0,60,1 |
10,1 ± 0,6* |
|
|
Группа 3 (КМ-МСК) |
Амплитуда |
5,9 ± 1,0* |
7,4 ± 1,4* |
9,8 ± 1,3** |
|
Латентность |
10,8 ± 0,8 |
10,8 ± 1,1 |
10,5 ± 1,2* |
|
|
Группа 4 (ЖТ-МСК) |
Амплитуда |
5,3 ± 0,4* |
6,2 ± 0,5** |
7,3 ± 0,6* |
|
Латентность |
9,8 ± 0,4* |
9,8 ± 0,7 |
9,7 ± 0,3* |
Примечание:
*, ** – достоверность различий по сравнению с контролем (группа 2) (p < 0,05 и p < 0,01 соответственно).
У животных 5-ой и 6-ой групп, которым клетки вводили на седьмой день после травмы, наблюдалось постепенное увеличение амплитуды ССВП - более чем в 1,5 раза, достигающее статистической значимости на 21-ые сутки. Кроме того, к этим же суткам регистрируется достоверное уменьшение латентности компонентов ССВП. И хотя эффекты КМ- и ЖТ-МСК, вводимых на седьмые сутки после травмы, достоверно не различались, использование ЖТ-МСК оказывало более выраженный позитивный эффект на величину амплитуды ССВП. Следует отметить, что, как и при раннем введении, введение клеток на седьмые сутки после травмы, оказывая несомненный позитивный эффект на восстановление электрофизиологической активности мозга, тем не менее не приводит к ее полной нормализации.
Таблица 3
Значения амплитуд ССВП (мкВ) и латентности ССВП (мс) на стороне повреждения после введения клеток на 7-ые сутки
|
Группы животных |
Показатели ССВП |
14 сутки |
21 сутки |
|
Группа 2 (без введения клеток) |
Амплитуда |
3,7 ± 0,4 |
4,9 ± 0,9 |
|
Латентность |
9,8 ± 0,9 |
10,9 ± 0,3 |
|
|
Введение клеток (группы 5 и 6) |
Амплитуда |
6,7 ± 0,9 |
7,7 ± 0,7* |
|
Латентность |
10,9 ± 0,4 |
10,1 ± 0,3 |
|
|
Группа 5 (КМ-МСК) |
Амплитуда |
5,1 ± 0,9 |
6,4 ± 1,0 |
|
Латентность |
10,6 ± 0,5 |
10,0 ± 0,5 |
|
|
Группа 6 (ЖТ-МСК) |
Амплитуда |
5,9 ± 1,2 |
8,3 ± 1,3* |
|
Латентность |
11,2 ± 0,6 |
10,3 ± 0,2 |
Примечание: * – достоверные различия по сравнению с контролем (группа 2) (p < 0,05).
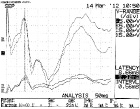
В качестве примера на рисунке представлены данные регистрации ССВП в динамике при спонтанном восстановлении (у животных контрольной группы 2) и после введения КМ-МСК в первые сутки после травмы (у животных группы 3).
 А
А  Б
Б  В
В
 А
А  Б
Б 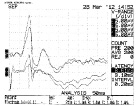 В
В
Динамика изменений ССВП в разные сроки после травмы у животных контрольной группы 2 (верхний ряд) и опытной группы 3 (нижний ряд). Верхний ряд: А – 1-ые сутки после травмы; Б – 7-ые сутки; В – 21-ые сутки. Нижний ряд: А – 7-ые сутки после травмы; Б – 14-ые сутки; В – 21-ые сутки
Суммируя представленные данные, можно заключить, что использование МСК в терапии очаговых повреждений головного мозга с целью улучшения неврологического восстановления оказывает позитивный эффект на электрофизиологическую активность головного мозга лабораторного животного. Характерно, что при раннем введении клеток стимулирующий эффект КМ-МСК и ЖТ-МСК был сходным, тогда как при позднем введении ЖТ-МСК оказали более выраженный эффект. И хотя трансплантация МСК не обеспечивает полной коррекции электрофизиологических показателей, восстановление ССВП на фоне введения МСК протекает более эффективно по сравнению со спонтанным восстановлением.
Заключение
Моделирование очагового повреждения головного мозга, обусловленного черепно-мозговой травмой, сопряжено с изменением электрофизиологической активности головного мозга у экспериментальных животных. Применение клеточной терапии оказывает позитивное влияние на динамику восстановления функционального состояния коры головного мозга в данной модели. Использование ССВП является информативным и объективным способом оценки эффективности клеточной терапии.
Рецензенты:
Труфакин С.В. д.м.н., заведующий Отделением лучевой диагностики клиники иммунопатологии, ФГБУ «НИИ клинической иммунологии» СО РАМН г. Новосибирск;
Повещенко А.Ф., д.м.н., заведующий Лабораторией физиологии протективной системы, ФГБУ «Научно-исследовательский институт клинической и эксперименталь-ной лимфологии» СО РАМН, г. Новосибирск.
Работа поступила в редакцию 07.08.2014.



