Являясь основной частью клеточной популяции крови млекопитающих, эритроциты и тромбоциты в значительной степени определяют ее реологические свойства [4]. Весьма велика в этом плане роль их агрегации и поверхностной геометрии, и в этой связи остаются весьма востребованными методические подходы к изучению микрореологических эритроцитов и тромбоцитов у людей и животных, что позволит своевременно и адекватно проводить у них их оценку и при необходимости контролируемую, предотвращая дисциркуляторные нарушения в жизненно важных органах [3, 5].
Не вызывает сомнений, что микрореологические дисфункции эритроцитов и тромбоцитов являются также и важным патогенетическим фактором развития многих заболеваний. В условиях патологии ухудшение их реологических свойств может стать первоосновой нарушения функций внутренних органов, что во многом способно определить тяжесть состояния человека или животного и дальнейший прогноз. Все это подчеркивает диагностическую ценность лабораторной оценки агрегации и цитоархитектоники эритроцитов и тромбоцитов.
Имеющие место в кровотоке межэритроцитарные поверхностные взаимодействия определяются пространственной плотностью и качественным составом мембраны (фосфатные, аминные, карбоксильные и др. химические группы) [8]. Понижение плотности поверхностного отрицательного заряда эритроцитов приводит к дестабилизации их суспензии, возможно, за счет сорбции на поверхности мембраны эритроцита макромолекул (чаще всего фибриноген) [10].
Наблюдаемая физиологическая агрегация эритроцитов имеет характер линейных цепочек в виде монетных столбиков, состоящих из 5–6 клеток, с возможностью полной гидродинамической дезагрегации эритроцитов в сосудистом русле. При очень низких скоростях сдвига эритроциты даже в норме почти полностью объединены в монетные столбики. При повышении скорости сдвига монетные столбики полностью разрушаются и кровь течет по сосудам, состоя из отдельных клеток [11].
Наиболее важным признаком патологической агрегации эритроцитов является глыбчатая их агрегация с увеличением прочности сцепления между эритроцитами, сохраняющаяся даже при 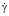 = 250 с-1. Такие агрегаты циркулируют по крови благодаря наличию в организме системы шунтов, минуя капиллярное русло, обеспечивая тем самым не только непрерывность кровотока, но и его централизацию с недостаточностью тканевой перфузии [10, 11].
= 250 с-1. Такие агрегаты циркулируют по крови благодаря наличию в организме системы шунтов, минуя капиллярное русло, обеспечивая тем самым не только непрерывность кровотока, но и его централизацию с недостаточностью тканевой перфузии [10, 11].
Изменения формы эритроцитов от дискоидной до сферической приводит к невозможности свободной упаковки эритроцитов, что ведет к увеличению площади соприкосновения (следовательно, к патологической агрегации). При этом, эхиноцитарная трансформация существенно увеличивает прочность агрегатов.
Колебания соотношения альбумина и фибриногена в плазме является дополнительным показателем суспензионной стабильности крови. Альбумин – наиболее эффективный дезагрегант и естественный антагонист фибриногена [1, 10]. При уменьшении соотношения между концентрацией альбумина и крупномолекулярными белками (глобулины, фибриногеном и продуктами деградации фибрина) ослабляет суспензионную стабильность крови.
Для оценки агрегации эритроцитов кровь из вены забирают в утренние часы после 14-часового голодания из вены через толстую иглу самотеком в пробирку с цитратом натрия в соотношении 9:1 и центрифугируют 10 мин. при 3 000 об./мин. В 96 луночной планшетке заполняют 2 лунки 0,2 мл плазмы обследуемого. Из пробирки удаляется вся плазма и слой лейкоцитов. Эритроциты ресуспепдируются стандартным фосфатным буфером в соотношении 1:4 с последующим центрифугированием в течение 10 мин. при 3 000 об./мин., что позволяет отмыть их от остатков плазмы при удалении надосадочной жидкости. После этого берется 0,02 мл эритроцитов и ресуспендируется в первой заполненной аутологичной плазмой лунке 96 луночной планшетки, что позволяет получить 10 % гематокрит. Затем из этой лунки забирают чистой сухой пипеткой 0,02 мл содержимого и помещают во вторую заполненную лунку, что позволяет получить 1 % гематокрит. После этого 1 сетку в камере Горяева заполняют полученной суспензией эритроцитов, выдерживают 3 мин. для возникновения спонтанной агрегации и проводят подсчет свободных эритроцитов (в т.ч. 2 эритроцита вместе) и агрегатов, начиная с 3 эритроцитов, соединенных в виде «монетных столбиков») в 2-х больших квадратах камеры (объектив х 40, окуляр х 10). Считаются количество «монетных столбиков» и количество эритроцитов, вовлеченных в них.
Агрегационную активность эритроцитов можно регистрировать с помощью светового микроскопа путем подсчета в камере Горяева количества агрегатов эритроцитов, агрегированных и неагрегированных эритроцитов во взвеси отмытых эритроцитов в плазме крови с вычислением среднего размера агрегата (СРА) [5]:
СРА = СЭА / КА,
где СЭА – сумма всех эритроцитов в агрегате;
КА – количество агрегатов.
Показатель агрегации (ПА) рассчитывается по следующей формуле:
ПА = (СРА х КА + КСЭ) / (КА + КСЭ),
где КСЭ – количество свободных эритроцитов.
Процент неагрегированных эритроцитов (ПНА) определяется:
ПНА = (КСЭ х 100) / (СРА х КА + КСЭ).
Оценка цитоархитектоники эритроцитов ведется с применением световой фазовоконтрастной микроскопии. Для исследования поверхностной геометрии эритроцитов кровь фиксируется в 1 % растворе глутарового альдегида («Fluka», Switzerland) на среде 199 (рН 7,4) при температуре 4 ºС в течение одних суток, после чего готовится препарат «раздавленная капля». Подсчет клеток производится в процентах на 200 эритроцитов. Регистрируемые эритроциты типируются согласно классификации, предложенной Г.И. Козинцем с соавт. [2], подразделяющей эритроциты на десять классов: дискоциты; дискоциты с одним выростом; дискоциты с гребнем; дискоциты с множественными выростами; эритроциты в виде тутовой ягоды; куполообразные эритроциты (стоматоциты); сфероциты с гладкой поверхностью; сфероциты с шипиками на поверхности; эритроциты в виде «спущенного мяча»; дегенеративные формы эритроцитов.
Первые пять классов эритроцитов (дискоциты, в т.ч. с признаками эхиноцитарной трансформации) считаются обратимо деформированными в виду их способности спонтанно восстанавливать форму. Остальные классы эритроцитов относят к группе необратимо деформированных или предгемолитических форм.
Современная оценка микрореологических свойств крови немыслима без определения агрегации тромбоцитов, осуществляющейся визуальным способом [7], хорошо показавшим себя на практике [6]. С этой целью кровь забирают с цитратом натрия 3,8 % в соотношении 9:1, центрифугируют 5 мин. при 1000 об/мин. для получения богатой тромбоцитами плазмы (БТП). Часть плазмы отбирают, а оставшуюся центрифугируют при 3000 об/мин. в течение 20 мин., получают бедную тромбоцитами плазму (БеТП). БТП стандартизируют по числу тромбоцитов (до 200·109/л.).
Из получившегося объема стандартизированной плазмы отбирают из расчета по 0,02 мл плазмы на каждый исследуемый индуктор и их комбинацию. Оставшийся объем плазмы можно использовать для других гематологических и биохимических исследований. Из отобранного объема стандартизированной плазмы на предметное стекло наносят 0,02 мл плазмы и разными пипетками по 0,02 мл раствора индуктора. В качестве агонистов возможно применение, в т.ч. АДФ (0,5×10-4 М), коллагена (разведение 1:2 основной суспензии), тромбина (0,125 ед/мл), адреналина (5,0×10-6 М), ристомицина (0,8 мг/мл), перекиси водорода (7,3×10-3 м). Стеклянной палочкой смешивают плазму с индукторами и включают секундомер. Смесь перемешивают так, чтобы жидкость занимала окружность диаметром около 2 см. Покачивая стекло круговыми движениями в проходящем свете осветителя, на черном фоне следят через лупу за возникновением агрегатов. При появлении отчетливых агрегатов, просветлении раствора и прилипании части агрегатов к стеклу секундомер отключают и фиксируют время агрегации тромбоцитов. Реакцию повторяют 2–3 раза с каждым индуктором и находят среднее арифметическое из полученных результатов.
Оптимальными значениями агрегации тромбоцитов при концентрации тромбоцитов 200·109/л составляет для АДФ – 37–50 с, коллаген – 27–36 с, ристомицин – 38–50 с, тромбин – 48–59 с, адреналин – 81–106 с, перекись водорода – 40–60 с.
Регистрация внутрисосудистой активности тромбоцитов возможна по методу [9], когда из локтевой вены берут 2 мл в силиконированную центрифужную пробирку с 8 мл раствора 0,125 % глутаральдегида и сразу центрифугируют 6 мин при 1000 об/мин. Супернатант разводят раствором глутаральдегида в четыре раза (0,1 мл + 0,3 мл раствора), перемешивают пипеткой 5 раз и заполняют камеру Горяева, которую помещают на 20 мин. в увлажненную чашку Петри.
При помощи фазовоконтрастного микроскопа определяют процентное распределение описанных выше форм тромбоцитов на 200 клеток. Первым видимым проявлением активации кровяных пластинок является изменение их формы, которое может служить для адекватной оценки этого процесса как индуцируемого in vitro, так и развивающегося в организме. В сосудистом русле при отсутствии патологических активирующих влияний подавляющее большинство интактных тромбоцитов, называемых дискоцитами, имеет характерную дискоидную форму или форму чечевицы и практически гладкую поверхность. Интактное состояние тромбоцитов, сопряженное с формой дискоцита, – один из важнейших факторов, препятствующих неоправданному развитию внутрисосудистого тромбоза. Механизмы его обеспечения достаточно сложны. Это отчасти связано с тем, что интактное состояние этих клеток сочетается с потенциальной возможностью быстрых и специфичных преобразований при появлении в кровотоке активирующих стимулов. Характерное изменение формы при индуцировании гемостатических реакций кровяных пластинок отражает определенные процессы их внутренней ультраструктурной и биохимической перестройки [12]. При этом развивается типичная последовательность изменений: от формы интактного тромбоцита – дискоцита к активированным клеткам – дискоэхиноциту, т.е. дискоциту, у которого на поверхности появляются отростки, и далее к сфероциту или сфероэхиноциту. У последнего не только форма становится все более сферичной, но и возрастает число отростков.
Оценка степени агрегации осуществляется также по относительному числу всех тромбоцитов, вовлеченных в агрегационную реакцию. Последнее может быть выявлено по процентному отношению числа агрегировавших тромбоцитов к общему их числу в препарате (т.е. к сумме свободно лежащих клеток и вовлеченных в агрегацию) по формуле:
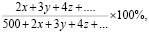
где x, y, z и т.д. – число агрегатов соответствующего размера на 500 свободных тромбоцитов.
Оценка состояния основных микрореологических свойств эритроцитов и тромбоцитов не требует дорогостоящего оборудования, дает полную информацию об их динамике. При применении данных морфофункциональных методов установлено, что и у здорового человека и животных в циркулирующей крови лишь у небольшой части эритроцитов и тромбоцитов изменена форма. Однако в патологических условиях изменения этих показателей могут быть намного более выражены вследствие внутрисосудистой альтерации эритроцитов и кровяных пластинок. Это обуславливает то, что при патологических состояниях микроциркуляция может значительно ухудшаться, т.к. появляется значительное количество эритроцитов и тромбоцитов с измененной формой и их внутрисосудистых агрегатов.
Таким образом, оценка агрегации и цитоархитектоники – это важный элемент диагностики состояния животных и человека, позволяющий при необходимости своевременно определять сроки начала корректирующего вмешательства.
Рецензенты:
Громнацкий Н.И., д.м.н., профессор, профессор кафедры терапии № 2 Курского государственного медицинского университета, г. Курск;
Жукова Л.А., д.м.н., профессор, заведующий кафедрой эндокринологии и диабетологии Курского государственного медицинского университета, г. Курск.
Работа поступила в редакцию 29.07.2014.



