Хронический гепатит С (ХГС) является одним из наиболее распространенных инфекционных заболеваний человека [6]. Применение современной комбинированной противовирусной терапии (КПТ) ХГС позволяет добиться у многих пациентов полной элиминации возбудителя [3, 4, 5], однако, актуальной проблемой при этом остается развитие нежелательных явлений (НЯ), среди которых особое место занимают гематологические осложнения [1, 7]. Одним из наиболее серьезных гематологических синдромов у больных ХГС является КПТ-ассоциированная тромбоцитопения, развитие которой значительно увеличивает риск возникновения состояний, угрожающих жизни пациентов [1, 2]. К сожалению, многие стороны патогенеза данного НЯ этиотропного лечения хронической HCV-инфекции остаются практически не изученными.
Цель исследования – детально изучить патогенез и клинические проявления КПТ-ассоциированной тромбоцитопении у больных ХГС.
Материалы и методы исследования
В исследование было включено 228 больных ХГС, имевших показания к КПТ. Генотип HCV 1a встречался у 3,5 %, 1b – 51,3 %, 3а – 28,9 % и 2а – 16,2 % человек. Уровень вирусной нагрузки (ВН) у 30,3 % пациентов составил < 3×105 МЕ/мл, у 46,1 % – 3×105 – 6×105 МЕ/мл и у 23,7 % > 6×105 МЕ/мл. Всем испытуемым была назначена КПТ согласно современным международным стандартам. 51,3 % пациентов получали рибавирин в сочетании с пегилированными α-интерферонами (пег-ИНФ-α), 48,7 % – в сочетании с «короткими». В ходе работы наблюдаемым лицам был выполнен ряд высокоспециализированных исследований. Определение показателей гемограммы проводилось методом автоматического гематологического анализа («Advia 2120i» (Siemens)) непосредственно перед началом КПТ, через 4, 8, 12, 24 и 48 (лица, инфицированные 1-м генотипом HCV) недель КПТ. Внутриклеточная ультраструктура тромбоцитов ПК изучалась с помощью трансмиссионной электронной микроскопии на просвечивающем электронном микроскопе «Tecnai G2 Spirit BioTWIN» (Philips, Нидерланды). Уровень человеческого тромбопоэтина (THPO) исследовали методом твердофазного ИФА с использованием набора реактивов Human Thrombopoietin Quantikine ELISA Kit (R&D Systems, США) на спектрофотометре xMark (Bio-Rad, США). Определение антител к поверхностным антигенам (GP IIa-IIIb) базальной мембраны тромбоцитов в сыворотке крови осуществляли путем постановки реакции непрямой иммунофлюоресценции. При этом использовались диагностические наборы «Thrombocytes IIFT» (EUROIMMUN AG, Германия) с меченными ФИТЦ вторичными антителами к антитромбоцитарным IgG человека. Характер флуоресцентного свечения оценивался на микроскопе Olympus СХ41 (Япония). Результат реакции выражался в титрах. Перечисленные выше методы исследования проводились дважды: перед началом и сразу после завершения или вынужденного прекращения КПТ. Помимо этого у испытуемых лиц методом «ПЦР в реальном времени» было выполнено изучение однонуклеотидных ДНК-полиморфизмов (SNP) гена рецептора тромбопоэтина MPL, в частности частота точковых мутаций W515L/K (rs121913615/121913616). Для генотипирования SNP использовали аллель-специфичные зонды наборов реагентов «SNP-Скрин» (Синтол, РФ). Заключительным этапом явился тщательный статистический анализ полученных результатов, который был выполнен после полного завершения клинико-лабораторно-инструментального мониторинга всех пациентов.
Результаты исследования и их обсуждение
В результате проведенного лечения УВО в общей сложности был достигнут у 155 (68,0 %) пациентов, из них 64 (41,3 %) были инфицированы 1-м; 34 (21,9 %) – 2-м и 57 (36,8 %) – 3-м генотипами HCV. Среди получавших пег-ИФН-α-2а (n = 117) частота УВО составила 54,7 % (n = 64); получавших «короткие» ИФН-α (n = 111) – 82,0 % (n = 91). У больных, инфицированных 1-м генотипом HCV (n = 125), УВО отмечался в 51,2 % (n = 64) случаев; у инфицированных 2-м (n = 37) и 3-м (n = 66) генотипами HCV – в 91,9 % (n = 34) и 86,4 % (n = 57) случаев соответственно. Проведение КПТ прекращалось при отсутствии через 12 недель лечения РВО и/или развитии у пациентов тяжелых НЯ противовирусной терапии. В итоге, из 228 больных ХГС полностью закончили курс КПТ 163 человека (71,5 %). У 8 пациентов (3,5 %) терапия была отменена уже через 8 недель лечения исключительно по причине развития тяжелых гематологических осложнений КПТ. У 57 больных ХГС (25,0 %) было зафиксировано отсутствие РВО, причем у 9 из них (3,9 %) параллельно наблюдалось развитие к 12-й неделе КПТ тяжелых осложнений со стороны системы крови, также требовавших отмены терапии.
При изучении степени тяжести КПТ-ассоциированной тромбоцитопении нами была использована классификация Всемирной организации здравоохранения, согласно которой выделяют легкую (Тр 150–75×109/л), умеренную (Тр 74–50×109/л) и тяжелую (Тр < 50×109/л) степени тромбоцитопении. В результате было установлено, что на разных этапах КПТ тромбоцитопения в общей сложности развилась у 30,3 % пациентов, при этом легкая степень отмечалась у 16,2 %; умеренная – у 10,5 % и тяжелая – у 3,5 % больных ХГС.
Объективные изменения в виде геморрагий в местах инъекций, появления петехиальной сыпи на нижних конечностях, частых носовых кровотечений, гематурии были выявлены исключительно у лиц с умеренной и тяжелой степенью тромбоцитопении. У 21,4 % пациентов, начиная с 20 недели КПТ, было зафиксировано развитие спленомегалии.
Легкая степень тромбоцитопении через 4 недели КПТ была зафиксирована у 8,3 %, через 8 недель – у 11,8 %, через 12 – у 15,0 %, через 24 – у 29,4 % и через 48 (пациенты с 1-м генотипом HCV) – у 34,8 % больных ХГС. Умеренная степень тромбоцитопении через 12 недель КПТ отмечалась у 1,4 % больных ХГС, через 24 недели – у 8,0 % и через 48 недель – у 11,1 % пациентов. Развитие тромбоцитопении тяжелой степени было выявлено у 3,6 % больных ХГС через 12 недель лечения, совпав при этом с отсутствием РВО у данной категории лиц (табл. 1).
Все участники исследования в зависимости от минимального количества тромбоцитов, зафиксированного у каждого пациента за весь период КПТ (Трmin), были разделены на три группы. В 1-ю группу (n = 159) вошли лица, у которых Трmin на протяжении КПТ оставался в пределах допустимой нормы, т.е. > 150×109/л. 2-я группа (n = 37) включала больных ХГС с легкой степенью КПТ-ассоциированной тромбоцитопении: Трmin в пределах 75–150×109/л. 3-ю группу (n = 32) составили лица с умеренной и тяжелой степенью тромбоцитопении: Трmin < 75×109/л. Средний показатель Трmin в 1-й группе оказался равен 176,03 ± 2,77; во 2-й – 127,89 ± 3,45 и в 3-й – 64,69 ± 2,03×109/л.
Проведенный корреляционный анализ позволил установить наличие умеренной обратной ассоциативной связи между Трmin и такими исходными показателями пациентов как возраст, индекс массы тела (ИМТ), величина ВН и индекс фиброза (ИФ), что же касается количества Тр перед началом КПТ, то в данном случае была получена сильная прямая ассоциативная связь (табл. 2).
Таблица 1
Характер распределения больных ХГС в зависимости от количества тромбоцитов перед началом КПТ, через 4, 8, 12, 24, 48 недель от начала КПТ и через 24 недели после окончания КПТ
|
Тр. (×109/л) |
Абсолютное (n) и относительное (%) число больных ХГС |
||||||
|
перед КПТ (n = 228) |
4 недели КПТ (n = 228) |
8 недель КПТ (n = 228) |
12 недель КПТ (n = 220) |
24 недели КПТ (n = 163) |
48 недель КПТ (n = 72) |
24 недели после КПТ (n = 221) |
|
|
> 150 |
225 (98,7 %) |
209 (91,7 %) |
201 (88,2 %) |
176 (80,0 %) |
102 (62,6 %) |
39 (54,1 %) |
209 (94,6 %) |
|
150–75 |
3 (1,3 %) |
19 (8,3 %) |
27 (11,8 %) |
33 (15,0 %) |
48 (29,4 %) |
25 (34,8 %) |
12 (5,4 %) |
|
75–50 |
0 |
0 |
0 |
3 (1,4 %) |
13 (8,0 %) |
8 (11,1 %) |
0 |
|
< 50 |
0 |
0 |
0 |
8 (3,6 %) |
0 |
0 |
0 |
Таблица 2
Характер корреляционных связей Трmin с возрастом, ИМТ, количеством Тр, величиной ВН и ИФ перед КПТ у наблюдаемых нами больных ХГС
|
Исследуемый показатель |
Возраст пациентов |
ИМТ перед КПТ |
Количество Тр перед КПТ |
ВН перед КПТ |
ИФ перед КПТ |
|||||
|
r |
p |
r |
p |
r |
p |
r |
p |
r |
р |
|
|
Трmin |
-0,28 |
< 0,01 |
-0,31 |
< 0,01 |
0,65 |
< 0,01 |
-0,35 |
< 0,01 |
-0,27 |
< 0,01 |
На старте КПТ среди пациентов 3-й группы в сравнении с 1-й и 2-й преобладали лица старше 40 лет, имеющие ИМТ > 25 и ИФ F2-3 (р < 0,05). Перед началом КПТ средний показатель количества Тр в 1-й группе больных ХГС составил 260,83 ± 3,96; во 2-й – 218,46 ± 5,73 и в 3-й – 180,78 ± 3,76 ×109/л (во всех случаях р > 0,05). Уже через 4 недели терапии отмечалось достоверное снижение среднего показателя количества Тр у пациентов всех групп (р > 0,05), минимальные же значения данного показателя были зафиксированы в период с 24-й по 48-ю недели КПТ. В целом же, наиболее выраженные изменения на всех этапах лечения отмечались в 3-й группе больных ХГС (р < 0,05). Что касается среднего объема Тр, то в процессе КПТ отмечалось статистически значимое (р < 0,05) повышение среднего показателя MPV, наиболее выраженного опять-таки у пациентов 3-й группы.
В ходе исследования во всех сравниваемых группах были выявлены пациенты с разнообразными структурными дефектами как цитоплазматической мембраны тромбоцитов (участки локального разрыхления, патологические выпячивания, микро- и макровезикулобразование), так и их стромы (образование полостей и эндовезикул, гипертрофия грануломера, отек и набухание митохондрий) (рис. 1, 2).
Как показал сравнительный анализ, на старте лечения в 3-й группе пациентов гораздо чаще встречались лица с вышеуказанными дефектами. После завершения КПТ удельный вес больных ХГС с выявленными структурными изменениями тромбоцитов либо имел тенденцию к снижению, либо достоверно снижался во всех группах (р < 0,05), оставаясь, тем не менее, наиболее высоким в 3-й группе.
Что касается уровня антитромбоцитарных антител, то в 1-й и 2-й группе пациентов перед началом КПТ были обнаружены лица с отсутствием, а также с низким и умеренным уровнем IgG к поверхностным антигенам GP IIa-IIIb, при этом существенных отличий их удельного веса между данными группами зафиксировано не было. В 3-й же группе больных ХГС статистически более высоким оказалось относительное количество пациентов с низким и умеренным уровнем антитромбоцитарных IgG. После КПТ в 1-й группе удельный вес пациентов с выявленным уровнем антитромбоцитарных IgG существенно не изменился, во 2-й – достоверно повысился удельный вес больных с умеренным, а в 3-й – с высоким уровнем антитромбоцитарных IgG, кроме того, в 3-й группе отмечалось появление пациентов с крайне высоким уровнем антитромбоцитарных IgG.
Средний показатель уровня THPO перед началом КПТ в 1-й группе наблюдаемых нами лиц составил 24,43 ± 1,1 пг/мл, во 2-й – 25,77 ± 0,97 пг/мл, в 3-й же группе данный показатель оказался достоверно выше – 29,08 ± 1,01 пг/мл (р < 0,05). После окончания КПТ средний уровень THPO статистически значимо повысился лишь в 1-й и 2-й группах, тем самым достоверно превысив таковой у пациентов 3-й группы.
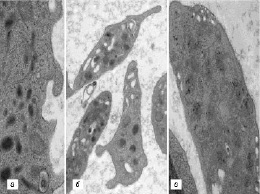
Рис. 1. Признаки деструкции плазмолеммы тромбоцитов, выявленные у наблюдаемых пациентов. Трансмиссионная электронная микроскопия: а – локальные участки истончения и разрыхления (×58 000); б – патологические выпячивания плазмолеммы (×22 000); в – образование микро- и макровезикул (×36 000)
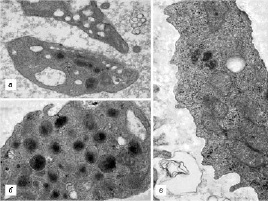
Рис. 2. Признаки деструкции цитоплазмы тромбоцитов, выявленные у наблюдаемых пациентов. Трансмиссионная электронная микроскопия: а – тромбоциты с множественными эндовезикулами (×22 000); б – гипертрофия грануломера (×44 000); в – отек и набухание митохондрий (×38 000)
Частота встречаемости точковой мутации W515L (rs121913615) гена MPL в 1-й группе больных ХГС составила 27,8 ± 7,5 % пациентов, во 2-й группе – 22,6 ± 7,5 % и наконец в 3-й – 71,9 ± 7,9 % человек, что оказалось значительно выше нежели у пациентов первых двух групп (р < 0,001). Совсем иная ситуация складывалась с мутацией W515K (rs121913616), в данном случае «мутантный» генотип был зафиксирован в 1-й и во 2-й группах больных ХГС в 16,7 ± 6,2 %, и 16,1 ± 6,6 % случаев соответственно (р > 0,05), в 3-й же группе данная мутация выявлена не была.
Выводы
- Степень выраженности КПТ-ассоциированной тромбоцитопении у больных ХГС определена целым рядом факторов, среди которых можно выделить как непосредственное действие HCV, так и индивидуальные характеристики самого пациента.
- Перед началом противовирусного лечения у больных ХГС имеются разнообразные ультраструктурные дефекты мембраны и стромы эритроцитов, которые, вполне возможно, могут играть важную роль в развитии КПТ-ассоциированной тромбоцитопении.
- В патогенезе КПТ-ассоциированной тромбоцитопении существенное место занимает повышение уровня антитромбоцитарных аутоантител к поверхностным антигенам GP IIa-IIIb.
- В процессе антивирусной терапии у лиц с отсутствием или же легкой степенью КПТ-ассоциированной тромбоцитопении происходит компенсаторное увеличение выработки эндогенного THPO, что вполне обеспечивает адекватный уровень тромбоцитопоэза у данной категории лиц.
- Развитие у больных ХГС средней и тяжелой степени КПТ-ассоциированной тромбоцитопении ассоциируется с высокой частотой точковой мутации W515L (rs121913615), происходящей в структуре гена MPL, ответственного, как известно, за синтез R эндогенного THPO.
Рецензенты:
Николаев Б.Ф., д.м.н., МЛПУЗ «ГБ № 1 им. Н.А. Семашко», г. Ростов-на-Дону;
Яговкин Э.А., д.м.н., Ростовский научно-исследовательский институт микробиологии и паразитологии министерства здравоохранения РФ, г. Ростов-на-Дону.
Работа поступила в редакцию 07.08.2014.



