В течение последних десятилетий способ импрессионной цитологии получил распространение в офтальмологии для диагностики различных заболеваний глазной поверхности и контроля эффективности терапии [1, 2]. Это объясняется его простотой и нетравматичностью, в отличие от инцизионной биопсии или brush-биопсии (соскабливание эпителия скальпелем), что позволяет многократно повторять исследования с помощью импрессионной цитологии на этапах лечения [7]. Забор клеточного материала в ходе импрессионной цитологии проводят путём удаления нескольких слоёв эпителия за счёт прижатия к поверхности глаза различных материалов: стекла, стерилизованного ластика, полоски целлюлозно-ацетатной фильтровальной бумаги. «Классическая» техника забора клеточного материала для проведения имперссионного цитологического исследования включает прижатие целлюлозно-ацетатного фильтра к поверхности эпителиальной выстилки конъюнктивы или роговицы, при этом на поверхности фильтра остаётся 1–2 слоя эпителия.
В существующих аналогах прижатие фильтровальной бумаги к поверхности конъюнктивы или роговицы осуществляют стеклянной палочкой или головкой тонометра Гольдмана, при этом оказываемое на ткани давление различно [5, 6, 8].
Недостатком указанной техники является отсутствие дозированного усилия компрессии. Указанное обстоятельство снижает воспроизводимость результатов забора (от усилия компрессии зависит количество клеток в отпечатке эпителия) и затрудняет трактовку полученных результатов. Существующие аналоги предусматривают последовательное трёхэтапное использование двух инструментов (размещение фильтра на поверхности глаза пинцетом, прижатие фильтра стеклянной палочкой, извлечение прижатого фильтра пинцетом), что не исключает ятрогенное повреждение тканей.
На кафедре глазных болезней КубГМУ был разработан инструмент для дозированного взятия клеточного материала [3], который позволяет проводить дозированный забор клеточного материала конъюнктивы путём обеспечения стандартизации усилия компрессии (15 граммов), что снижает вариабельность результатов забора (количество клеток в единичном отпечатке конъюнктивального эпителия), повышает воспроизводимость результатов исследования в 7–8 раз [3].
Применение инструмента в клинической практике обнаружило следующие особенности, которые потребовали технического усовершенствования:
- инструмент недостаточно эргономичен, поскольку в ходе его применения быстро развивается утомление мышц кисти врача, что снижает безопасность процедуры забора клеточного материала, указанный недостаток обусловлен отсутствием надёжной системы фиксации инструмента в момент взятия пробы;
- инструмент не предназначен для использования в педиатрической практике, так как не учтен меньший размер глазного яблока у детей, усилие прижатия фильтра к глазному яблоку свыше 10 граммов может быть причиной чрезмерного субъективного дискомфорта у ребёнка;
- инструмент не предусматривает дифференциацию усилия прижатия фильтра при различных вариантах забора клеточного материала (прижатие фильтра непосредственно к конъюнктиве; прижатие фильтра к конъюнктиве через толщу века);
- рабочая головка инструмента выполнена из стали и имеет резьбу, в процессе работы требуется стерилизация рабочей головки, что усложняет, удорожает её изготовление и применение.
Указанные обстоятельства послужили основанием для проведения работ, направленных на оптимизацию указанного инструмента, что определило актуальность и цель настоящего исследования.
Цель исследования
Модифицировать инструмент для создания оптимальных условий забора клеточного материала и тестировать его в условиях клиники.
Материалы и методы исследования
Нами был модифицирован ранее разработанный на кафедре глазных болезней КубГМУ инструмент для дозированного забора клеточного материала конъюнктивы [3]. Для тестирования инструмента в условиях клиники были обследованы 15 человек (30 глаз) в возрасте от 11 до 75 лет с различной патологией поверхности глаза. Структура патологии по нозоологии представлена следующим образом: фармакологическая форма синдрома «сухого глаза» (ССГ), развившегося на фоне первичной открытоугольной глаукомы, стабилизированной бета-блокаторами c консервантом – 14 глаз, нейродепривативная форма ССГ на фоне миопического астигматизма (пациенты использовали мягкие контактные линзы как средство оптической коррекции в течение 3–5 лет) – 10 глаз, танталическая форма ССГ на фоне эндокринной офтальмопатии – 6 глаз. Пациентам проводили полное офтальмологическое обследование и морфологическое исследование эпителиальной выстилки глазной поверхности с помощью модифицированного метода импрессионной цитологии, забор пробы клеточного материала проводили модифицированным инструментом.
Результаты исследования и их обсуждение
В 2012–2013 гг. на кафедре КубГМУ была проведена работа по модернизации инструмента[4]: разработана подвижная шарнирная система фиксации инструмента, позволяющая легко перемещать его в горизонтальной, фронтальной и сагиттальной плоскостях; разработаны одноразовые пластиковые рабочие головки различного диаметра (8 и 10 мм) на дистальном конце рабочей головки инструмента имеется целлюлозно-ацетатный фильтр с размером пор 0,22 мкм; инструмент был модифицирован для дозированного взятия клеточного материала путём дифференциации усилия прижатия фильтра к конъюнктиве или веку в 10, 15, 20, 30 граммов.
В зависимости от усилия компрессии целлюлозно-ацетатного фильтра (10, 15, 20, 30 граммов) инструмент применялся у детей, а также у лиц молодого, зрелого и пожилого возраста.
В педиатрической практике использовали одноразовые пластиковые рабочие головки диаметром 8 мм и целлюлозно-ацетатным фильтром с размером пор 0,22 мкм. Инструментом производили прижатие с различным усилием: с силой 10 граммов непосредственно к конъюнктиве; прижатие фильтра к конъюнктиве через толщу нижнего века с силой 20 граммов. Такая методика не вызывала субъективного дискомфорта у детей в ходе процедуры.
У лиц молодого, зрелого и пожилого возраста использовали одноразовые пластиковые рабочие головки диаметром 10 мм и целлюлозно-ацетатным фильтром с размером пор 0,22 мкм. Прижатие фильтра инструментом производили непосредственно к конъюнктиве с силой 15 граммов, а через нижнее веко с силой 30 граммов.
Для лучшего понимания модифицированный инструмент для дозированного взятия клеточного материала конъюнктивы схематично изображен на рис.1. Общий вид инструмента в разрезе по оси, где 1 – корпус; 3 – пружина; 4 – упорная втулка; 5 – фиксатор пружины; 6 – торец; 10 – шток инструмента со шкалой усилия прижатия в граммах (10–30 г) на рабочем конце; 11 – разовая пластиковая рабочая головка инструмента; 12 – целлюлозно-ацетатный фильтр с размером пор 0,22 мкм.
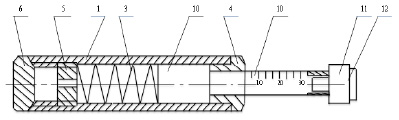
Рис. 1. Инструмент для дозированного взятия клеточного материала конъюнктивы
Инструмент для дозированного взятия клеточного материала использовали следующим образом. С помощью подвижной шарнирной системы фиксации прикрепляли инструмент к щелевой лампе.
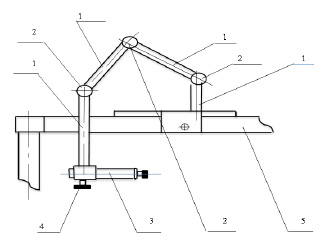
Рис. 2. Инструмент в общем виде в рабочем состоянии, где 1 – штанга; 2 – шарнир; 3 – инструмент для забора пробы клеточного материала конъюнктивы; 4 – фиксационный винт; 5 – устройство для фиксации головы пациента при офтальмобиомикроскопии
Клинический пример 1. Пациент – В., 63 года, диагноз – фармакологическая форма синдрома «сухого глаза» средней степени тяжести обоих глаз. Для морфологического подтверждения диагноза проводили цитологическое исследование бульбарной конъюнктивы методом модифицированной импрессионной цитологии.
Предварительно подготавливали систему для взятия пробы с конъюнктивы глазной поверхности. На столике, на котором установлена щелевая лампа, при помощи винтов и гаек, закрепляли инструмент. Рабочий конец устройства с одноразовой пластиковой рабочей головкой диаметром 10 мм и с целлюлозно-ацетатным фильтром подводили к глазу пациента и с заданным усилием (15 г) прижимали к назальному сектору конъюнктивы в пределах экспонируемой глазной щели в течение 5 секунд (после однократной инстилляции в конъюнктивальную полость 0,4 % раствора оксибупрокаина). Во время проведения процедуры веки исследуемого глаза фиксировали пальцами левой руки, корпус инструмента удерживали тремя пальцами правой руки (большим, указательным и средним); безымянный палец и мизинец правой руки был расположен на окологлазничной области пациента.
После пятисекундной дозированной компрессии целлюлозно-ацетатный фильтр извлекали с поверхности конъюнктивы вместе с инструментом.
После этого клетки конъюнктивы переносили с целлюлозно-ацетатного фильтра на обезжиренное предметное стекло. Для этого целлюлозно-ацетатный фильтр прижимали к поверхности предметного стекла. Необходимое время контакта фильтровальной бумаги и предметного стекла – 5 секунд. Затем клетки конъюнктивы, перенесенные на предметное стекло, подсушивали на воздухе 30 – 40 минут и проводили фиксацию, окрашивание, цитологическое исследование. Забор пробы занимает 3–5 минут, манипуляция простая, удобная и быстро выполнимая.
Клинический пример 2. Пациент – И., 12 лет, диагноз – сложный миопический астигматизм, использовал мягкие контактные линзы как средство оптической коррекции в течение 3 лет. Для оценки степени морфологических нарушений эпителиальной выстилки конъюнктивы глазной поверхности проводили цитологическое исследование бульбарной конъюнктивы методом модифицированной импрессионной цитологии.
Предварительно подготавливали систему для взятия пробы с конъюнктивы глазной поверхности. В конъюнктивальную полость помещали целлюлозно-ацетатный фильтр с диаметром пор 0,22 мкм к назальному сектору конъюнктивы в пределах экспонируемой глазной щели и предлагали пациенту закрыть глаза. Рабочий конец устройства с одноразовой пластиковой рабочей головкой диаметром 8 мм подводили к глазу и с заданным усилием (20 г) прижимали через закрытые веки к назальному сектору конъюнктивы в течение 5 секунд. Во время проведения процедуры корпус инструмента удерживали тремя пальцами правой руки (большим, указательным и средним); безымянный палец и мизинец правой руки были расположены на окологлазничной области пациента. После пятисекундной дозированной компрессии целлюлозно-ацетатный фильтр извлекали с поверхности конъюнктивы. Время выполнения пробы 2–3 минуты, манипуляция простая, комфортна как для врача, так и для пациента. После этого клетки конъюнктивы переносили с целлюлозно-ацетатного фильтра на обезжиренное предметное стекло, фиксировали, окрашивали и проводили цитологическое исследование.
Заключение
Модернизация инструмента для дозированного взятия пробы клеточного материала конъюнктивы сократила время проведения процедуры, снизила риск ятрогенного повреждения органа зрения при проведении манипуляции, обеспечила дозирование забора клеточного материала конъюнктивы, а также обеспечила возможность проведения пробы как контактным, так и бесконтактным способом.
Модифицированные одноразовые рабочие головки выполнены из пластмассы, лишены резьбы, что уменьшает стоимость инструмента; поставляются в стерильных упаковках, поэтому исключена процедура стерилизации, для обеспечения высокой инфекционной безопасности. Возможно использовать инструмент при отсутствии достаточного количества сменных разовых рабочих головок, например, при скрининговых осмотрах.
Благодаря дифференциации усилия компрессии, специальному размеру одноразовых пластиковых рабочих головок инструмент можно использовать в педиатрической практике.
Рецензенты:
Алиев А.-Г.Д., д.м.н., профессор, заведующий кафедрой глазных болезней с курсом усовершенствования врачей Дагестанской Государственной Медицинской Академии, директор ГБУ НКО «Дагестанский Центр Микрохирургии глаза», г. Каспийск;
Кашников В.В., д.м.н., главный врач офтальмологической клиники «ЭКСИМЕР», академик РАЕН и РАМТН, г. Новосибирск.
Работа поступила в редакцию 20.08.2014.



