В последнее время интенсивно исследуются сесквитерпеновые лактоны растений семейства сложноцветных (Asteraceae) и механизмы их противоопухолевого действия [7]. Противоопухолевая активность сесквитерпеновых лактонов реализуется в основном через индукцию апоптоза. Немаловажную роль в этом процессе играют влияние лактонов на клеточный редокс-статус, образование активных форм кислорода (АФК) и, как следствие, окислительные повреждения в клетке и запуск митохондриально-зависимого пути апоптоза [10]. Было показано, что сесквитерпеновые лактоны, выделенные из известного в народной медицине многих стран растения девясил высокий (Inula helenium L.), обладают выраженным антипролиферативным действием в отношении ряда культур опухолевых клеток [6]. Изоалантолактон (основной сесквитерпеновый лактон I. helenium) индуцирует апоптоз в различных опухолевых клеточных линиях. Данный эффект обеспечивается за счет регуляции белков семейства Bcl, активации ростовых факторов и каспазы-3, причем все эти процессы тесно связаны с образованием АФК [9]. В настоящем исследовании мы оценили влияние минорного сесквитерпенового лактона I. helenium – эпоксиалантолактона – и его производных на рост клеток аденокарциномы молочной железы человека и способность этих соединений индуцировать или предотвращать окислительные повреждения липидов мембран клеток.
Материалы и методы исследования
Исследуемые соединения
Эпоксиалантолактон выделяли из корней растения девясил высокий (Inula helenium L., сем. Asteraceae) по стандартной методике, препаративные количества эпоксиалантолактона получали эпоксидированием алантолактона [1]. Производные эпоксиалантолактона 1 и 2 получали реакцией нуклеофильного присоединения аминов по активированной экзометиленовой связи лактонного цикла (реакция Михаэля) (рис. 1) [2].
Реакция эпоксиалантолактона с аминами (общая методика). Смесь эпоксиалантолактона и соответствующего амина (10 %-й избыток) растворяли при перемешивании в метаноле и оставляли при комнатной температуре на ночь. По завершении реакции происходило образование продукта в виде осадка. При использовании в качестве нуклеофилов вторичных аминов были получены аминопроизводные эпоксиалантолактона 1 (15 соединений).
При проведении реакции с рядом первичных аминов, которые содержали дополнительный n- или π-донорный фрагмент, отделенный от аминогруппы углеводородным мостиком, нами были получены производные нового структурного типа – гидрированные бензо[g]фуро[4,3,2-cd]индолоны 2 [3]. Таким способом было получено 10 производных.
Строение всех полученных соединений было установлено с помощью спектральных методов и в ряде случаев подтверждено методом РСА.
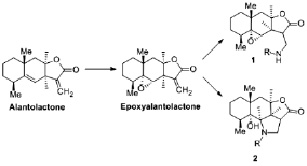
Рис. 1. Получение эпоксиалантолактона и его производных
Культуры клеток
Культуру клеток человека MCF7 (ATCC® HTB22™) (аденокарцинома молочной железы) выращивали в среде EMEM (НПП ПанЭко) с добавлением 10 % эмбриональной телячьей сыворотки (HyClone®, Thermo Scientific), 2мM L-глутамина (НПП ПанЭко) и 1 % гентамицина (ОАО Биохимик) в качестве антибиотика и инкубировали при 37 °C в атмосфере CO2 (5 %).
Цитотоксичность
Цитотоксичность синтезированных соединений была определена по МТТ-тесту [8]. Клетки MCF7 сеяли в 96-луночный планшет (CELLTREAT™) в количестве 1∙104 клеток/200 мкл и культивировали при 37 °C в атмосфере CO2 (5 %). После 24 часов инкубации к культурам клеток были добавлены различные концентрации тестируемых соединений (100; 50; 25; 12,5; 6,25; 3,12 и 1,56 мкМ), и далее клетки культивировали в тех же условиях 48 часов. Для каждой концентрации эксперименты были выполнены в трех повторностях. Все вещества растворяли в ДМСО (PANREAC QUÍMICA S.L.U), конечная концентрация ДМСО в лунке не превышала 1 % и не была токсична для клеток. В контрольные лунки добавляли растворитель в количестве 1 %. После инкубации в каждую лунку было добавлено 20 мкл MTT (бромида 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия) (5 мг/мл) (Sigma-Aldrich) и планшеты дополнительно инкубировали в течение 2 часов. Далее из планшетов удаляли среду и в каждую лунку добавляли по 100 мкл ДМСО для растворения образовавшихся кристаллов формазана. С помощью планшетного анализатора (Victor3, PerkinElmer) определяли оптическую плотность при 530 нм, за вычетом измеренного фонового поглощения при 620 нм. Значение концентрации, вызывающее 50 % ингибирование роста популяции клеток (IC50), было определено на основе дозозависимых кривых с помощью программного обеспечения OriginPro 9.0.
Определение интенсивности перекисного окисления липидов
Перекисное окисление липидов гомогената мозга крыс определяли по модифицированному ТБК-тесту [4]. В качестве инициатора ПОЛ гомогената мозга крыс выступали ионы трехвалентного железа (FeNH4(SO4)2·12H2O). Оптическую плотность регистрировали на планшетном анализаторе при длине волны 540 нм. В качестве контроля использовали гомогенат мозга крыс в отсутствие соединений, но с добавлением равного объёма растворителя.
Определение восстановительной активности соединений
Восстановительную активность исследуемых веществ устанавливали на основании их активности в реакции переноса электрона с использованием CUPRAC-теста [5]. В качестве вещества-стандарта использовали известный антиоксидант – тролокс. Значение тролокс-эквивалента определяли графически по величине оптической плотности с использованием калибровочного графика – концентрационной зависимости количества восстановленной меди от содержания тролокса.
Предобработка N-ацетилцистеином
Для определения роли окислительного стресса в процессе ингибирования роста клеточной линии аденокарциномы молочной железы при действии эпоксиалантолактона и его производных исследовали их цитотоксичность в присутствии N-ацетилцистеина – специфичного АФК-акцептора. Для этого в лунки с культивированными клетками MCF7 (кроме контроля) добавляли 3 мкл N-ацетилцистеина (5 мМ) (Sigma-Aldrich) в EMEM и инкубировали в течение 4 часов, после этого вносили исследуемые соединения (100 мкМ) и определяли значение IC50 согласно процедуре, приведенной выше.
Результаты исследования и их обсуждение
Установлено, что исходный эпоксиалантолактон не проявляет антиоксидантной активности в широком диапазоне концентраций, в то время как остальные синтезированные вещества эффективно ингибируют Fe3+ -индуцированное ПОЛ (табл. 1).
Для ряда соединений антиоксидантная активность в значительной степени может быть связана с восстановительной активностью, определяемой в CUPRAC-тесте. Это прежде всего относится к производным L05-0003, L05-5488n и L05-5488, более активным, чем тролокс, и производным L05-5272n, L05-5272st, близким по активности к тролоксу, которые оказывают и наиболее сильное ингибирование ПОЛ.
Таблица 1
Антиоксидантная активность соединений
|
№ п/п |
Соединение |
Ингибирование ПОЛ, % от контроля |
CUPRAC-тест, ТЭ* |
|
1. |
Эпоксиалантолактон |
― ** |
― |
|
2. |
L05-0123 |
76,28 ± 2,84 |
― |
|
3. |
L05-0003 |
77,69 ± 0,33 |
1,14 ± 0,12 |
|
4. |
L05-5488n |
87,39 ± 2,57 |
1,20 ± 0,06 |
|
5. |
L05-5488 |
85,73 ± 1,83 |
1,20 ± 0,10 |
|
6. |
L05-0181 |
82,36 ± 1,29 |
― |
|
7. |
L05-8019 |
72,95 ± 2,74 |
― |
|
8. |
L05-8031 |
79,99 ± 3,81 |
― |
|
9. |
L05-0020 |
― |
― |
|
10. |
L05-5272n |
71,78 ± 3,81 |
0,65 ± 0,04 |
|
11. |
L05-5272st |
73,57 ± 3,56 |
0,77 ± 0,07 |
|
12. |
L05-0165n |
77,34 ± 6,09 |
― |
|
13. |
L05-0165v |
80,99 ± 3,69 |
0,30 ± 0,09 |
|
14. |
L05-3008 |
64,76 ± 8,28 |
0,23 ± 0,04 |
|
15. |
L05-0073 |
73,42 ± 11,05 |
0,22 ± 0,06 |
Примечания:
* тролокс-эквивалент;
** нет влияния.
Практически все исследованные соединения обладают выраженной цитотоксической активностью. Как показали проведенные эксперименты, воздействие эпоксиалантолактоном и его производными в течение 48 часов ингибирует рост культуры клеточной линии MCF7 (табл. 2) в дозозависимом виде. Следует отметить, что цитотоксическая активность ряда аддуктов эпоксиалантолактона (соединения L05-0003, L05-6640, L05-0218, L05-6605, L05-6747) превышает активность исходного соединения в несколько раз.
Предварительная обработка N-ацетилцистеином снижает токсический эффект исследуемых соединений в разной степени (рис. 2) вплоть до практически полного подавления цитотоксического эффекта соединения L05-5272n. В случае изоалантолактона в работе [4] было показано, что предварительная обработка различных опухолевых клеточных линий N-ацетилцистеином сохраняет жизнеспособность клеток, указывая, что цитотоксическое действие на клетки осуществляется в основном через генерацию АФК.
Таким образом, можно предположить, что в основе цитотоксической активности производных эпоксиалантолактона лежат механизмы, связанные не только с продукцией свободных радикалов и влиянием на окислительные повреждения липидов. В большинстве случаев антиоксидантный потенциал этих соединений не препятствует проявлению их цитотоксичности по отношению к клеточной линии MCF7. В то же время для соединений L05-5272n и L05-5702 (структурный тип 1) участие АФК-зависимых механизмов в гибели клеток MCF7 более выражено и цитотоксический эффект этих соединений в большей степени может быть предотвращён добавлением N-ацетилцистеина.
Таблица 2
Цитотоксичность соединений в отношении культуры опухолевых клеток MCF7
|
№ п/п |
Соединение |
IC50, мкM |
|
1. |
Эпоксиалантолактон |
47,79 ± 1,65 |
|
2. |
L05-0020 |
> 250,00 |
|
3. |
L05-0073 |
176,76 ± 11,59 |
|
4. |
L05-0165v |
154,69 ± 11,45 |
|
5. |
L05-0165n |
169,89 ± 2,77 |
|
6. |
L05-0181 |
184,65 ± 35,82 |
|
7. |
L05-5272st |
137,38 ± 0,24 |
|
8. |
L05-5272n |
64,46 ± 4,90 |
|
9. |
L05-5488 |
138,85 ± 6,61 |
|
10. |
L05-5488n |
210,18 ± 3,61 |
|
11. |
L05-8019 |
> 250,00 |
|
12. |
L05-8031 |
176,76 ± 13,92 |
|
13. |
L05-3008 |
119,40 ± 0,09 |
|
14. |
L05-0123 |
243,62 ± 8,34 |
|
15. |
L05-0003 |
23,73 ± 3,34 |
|
16. |
L05-0619 |
77,06 ± 11,29 |
|
17. |
L05-6616 |
151,48 ± 12,56 |
|
18. |
L05-6640 |
18,37 ± 0,60 |
|
19. |
L05-0218 |
23,55 ± 0,74 |
|
20. |
L05-5702 |
40,47 ± 2,83 |
|
21. |
L05-1073 |
91,73 ± 2,12 |
|
22. |
L05-6605 |
19,30 ± 0,01 |
|
23. |
L05-0140 |
40,47 ± 0,98 |
|
24. |
L05-6747 |
11,21 ± 0,55 |
|
25. |
L05-5418 |
24,31 ± 1,39 |
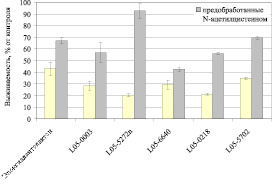
Рис. 2. Выживаемость клеток MCF7, предобработанных N-ацетилцистеином, под действием исследуемых соединений
Исследование действия эпоксиалантолактона и его производных на трансмембранный потенциал митохондриий, высвобождение проапоптотических факторов из митохондрий и влияние на клеточный цикл поможет уточнить предполагаемый механизм действия полученных соединений. Вместе с тем наличие активных соединений с разными механизмами действия среди синтезированной серии аддуктов позволяет рассматривать их как основу для разработки агентов с высоким противоопухолевым потенциалом.
Работа выполнена при поддержке Программы Президиума Российской академии наук «Фундаментальные науки – медицине».
Рецензенты:
Григорьев В.В., д.б.н., заведующий лабораторией нейрорецепции, ФГБУН «Институт физиологически активных веществ» Российской академии наук, ведомственная принадлежность Федеральное агентство научных организаций (ФАНО), г. Черноголовка;
Кинзирский А.С., д.м.н., профессор, заведующий лабораторией фармакологии, ФГБУН «Институт физиологически активных веществ» Российской академии наук, ведомственная принадлежность Федеральное агентство научных организаций (ФАНО), г. Черноголовка.
Работа поступила в редакцию 26.08.2014.



