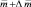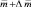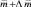В связи с усилением антропогенной нагрузки увеличиваются объемы воздействия токсичных химических контаминантов на живые организмы, что становится причиной разрушения целостности природного комплекса. Подобные загрязнения разрушают естественно сложившиеся фитоценозы, вызывают угрозу деструкции ассимиляционного потенциала фитомассы, приводят к нарушению нормальных процессов оргагенеза [2]. Среди большого количества химических веществ, поглощаемых дикорастущими растениями, согласно ОФС 42–0059–07, особое внимание уделяют определению тяжелых металлов: свинца, кадмия, сурьмы, ртути. Содержание сурьмы в надземной части растений, произрастающих на незагрязненных почвах, оценивается в 0,06 мг/кг сухой массы [5]. Классическая йодометрия, рекомендованная для определения сурьмы и ее соединений в биологических жидкостях и лекарственных средствах, характеризуется низкой чувствительностью и селективностью определения. Применение нейтронно-активационного [2] и атомно-абсорбционного методов [5] ограничивается сложностью аппаратурного оформления.
Цель настоящей работы – апробация способа определения сурьмы в фитопрепаратах, основанного на восстановлении его соединений до стибина с последующим отгоном в раствор фотогенерированного йода.
Экспериментальная часть
Получение и отгон гидридов проводили в приборе собственной конструкции (рис. 1) [6].
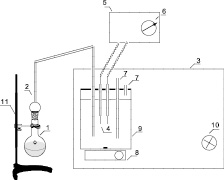
Рис. 1. Установка для определения микроколичеств сурьмы фотогенерированным йодом: 1 – круглодонная колба; 2 – газоотводная трубка; 3 – светонепроницаемый кожух; 4 – платиновые электроды; 5 – амперометрическая установка; 6 – гальванометр; 7 – трубка для подвода воздуха; 8 – магнитная мешалка; 9 – амперометрическая ячейка; 10 – источник света; 11 – штатив
Для устранения влияния мешающих компонентов в газоотводную трубку (2) помещали вату, пропитанную гидроксидом калия. Полученный в реакционной колбе (1) стибин пропускали через поглотительную ячейку (9), содержащую 40 мл 0,5 М раствора йодида калия, 20 мл ацетатного буферного раствора, 10 мл раствора смеси сенсибилизаторов, в которую погружали два платиновых микроэлектрода (4), присоединенных к амперометрической установке (5). На электроды налагали напряжение 30 мВ. Эту ячейку помещали в светонепроницаемый кожух (3) со стабилизированным источником света (10) мощностью 30 Вт. Источник света находился на расстоянии 30 см от поглотительной ячейки.
Методика количественного определения сурьмы в фитопрепаратах
При определении микропримеси сурьмы анализируемую пробу массой 10 г, взятую на аналитических весах, подвергали предварительной пробоподготовке [3], полученный остаток дополнительно обрабатывали смесью НСl (ρ = 1,19 г/мл) и Н2SО4 (ρ = 1,84 г/мл) кислот, взятых в объемном отношение 2:1, досуха выпаривали на электроплитке и прокаливали при температуре 600–700 °С в течение 2 часов. Сухой остаток, полученный в результате проведенных операций, растворяли в 5 мл 4 М раствора НСl и количественно переносили в реакционную колбу для отгона емкостью 25 мл (1), в которую предварительно помещали 1,5 мл 40 %-го раствора йодида калия, 1 мл 10 %-го раствора аскорбиновой кислоты и 5–10 мл 4 М НСl. Через 15 мин в колбу вводили 4 г цинка и соединяли ее с помощью газоотводной трубки (2) с поглотительной ячейкой (9). Перед отгоном поглотительный раствор в ячейке (9), содержащий 40 мл 0,5 М раствора йодида калия, 20 мл ацетатного буферного раствора, 10 мл раствора смеси сенсибилизаторов эозина, аурамина и флуоресцеина в молярном соотношении 1:1:1, продували в течение 1–2 мин воздухом и облучали видимым светом. Йод генерировали со скоростью 3,2·10–5 ммоль/мин до содержания его в ячейке 4·10–5 ммоль (1 дел соответствует 4,5 нА). О концентрации титранта судили по изменению тока в цепи амперометрической установки. После генерации йода отключали источник света и проводили отгон стибина до прекращения уменьшения силы тока. В зависимости от количества сурьмы в пробе время отгона варьировалось от 20 до 25 мин. После отгона стибина поглотительный раствор вновь продували воздухом в течение 1–2 мин, облучали и измеряли время генерации, пошедшее на восполнение убыли йода. Поглотительный раствор в ячейке заменяли после выполнения 20–30 анализов. Для учета примесей сурьмы в реактивах ставили контрольный опыт. Содержание сурьмы определяли методом градуировочного графика, полученного при анализе модельных растворов (рис. 2, 3). Для подтверждения достоверности полученных результатов использовали метод добавок, фотометрический [4] и ААС [1, 5].
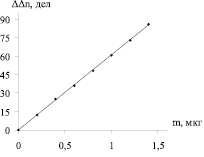
Рис. 2. График зависимости изменения силы тока от количества отгоняемой сурьмы (∆Δn = 60,964 m; R2 = 0,9997)
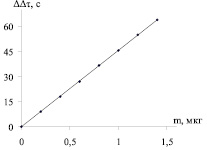
Рис. 3. График зависимости времени генерации йода от количества отгоняемой сурьмы (∆Δτ = 45,625·m; R2 = 0,9999)
В условиях получения стибина может наблюдаться образование арсина, который также будет взаимодействовать с раствором титранта. Обработка озоленного образца НСl (ρ = 1,19 г/мл) позволяет устранить влияние мышьяка на результаты определения сурьмы за счет образования летучего хлорида. Установлено, что добавление до 12 мг мышьяка к анализируемой пробе не приводит к изменениям результатов определения сурьмы (табл. 1).
Таблица 1
Результаты определения сурьмы в присутствии мышьяка
|
Введено, мкг |
Найдено Sb, мкг |
||||||
|
Фотохимическим методом |
методом ААС [1, 5] |
||||||
|
по изменению силы тока |
по времени генерации |
|
Sr, % |
||||
|
m(As) |
m(Sb) |
|
Sr, % |
|
Sr, % |
||
|
0,00 0,00 6,00 6,00 12,0 12,0 |
0,00 2,00 2,00 0,00 2,00 0,00 |
– 1,98 ± 0,07 1,92 ± 0,07 – 1,95 ± 0,07 – |
– 3,5 3,6 – 3,6 – |
– 1,97 ± 0,07 1,94 ± 0,07 – 1,96 ± 0,07 – |
– 3,5 3,6 – 3,6 – |
– 1,92 ± 0,07 1,90 ± 0,07 – 1,95 ± 0,07 – |
– 3,6 3,7 – 3,6 – |
Примечание. n = 5, p = 95 %.
Результаты фотохимического определения сурьмы в листьях крапивы («Крапивы листья (Urticae folia)», ЗАО «Фирма «Здоровье»), цветках ромашки (Ромашки цветки (Chamomillae flores)», ОАО «Красногорсклексредства») и грудном сборе № 4 (ООО «Фитофарм») представлены в табл. 2, 3.
Максимально высокое содержание сурьмы в грудном сборе № 4 определяется наличием побегов багульника и обуславливается средой его произрастания. Количество сурьмы, найденное в образцах листьев крапивы, цветов ромашки, варьируется от 0,4 до 0,5 мг/кг и определяется наличием активного поглощения экотоксиканта. Содержание сурьмы в фитопрепаратах не превышает допустимого уровня, который составляет 0,06 мг/кг [5]. Результаты определения сурьмы, найденные фотохимическим методом по изменению силы тока (табл. 2) и времени генерации титранта (табл. 3), согласуются между собой, а также с результатами, полученными фотометрическим [3] и ААС [1, 5] методами. Нижний предел определения сурьмы составляет 0,016 мкг по силе тока и 0,011 мкг по времени генерации йода в поглотительной ячейке.
Таблица 2
Результаты определения сурьмы в фитопрепаратах, найденные по изменению силы тока
|
Наименование ЛРС |
Введено Sb, мкг |
ΔΔn, дел |
Найдено, мкг |
Sr, % |
Найдено в мг/кг сухого вещества |
|||||
|
фотохимический метод |
Sr, % |
метод ААС |
Sr, % |
фотометрический метод |
Sr, % |
|||||
|
Крапивы листья (Urticae folia) |
0,00 0,40 0,80 |
9,9 19,7 29,5 |
0,40 ± 0,01 0,80 ± 0,02 1,20 ± 0,02 |
2,5 2,5 1,7 |
0,040 ± 0,001 0,040 ± 0,001 0,040 ± 0,001 |
2,5 2,5 2,5 |
0,040 ± 0,001 |
2,5 |
0,040 ± 0,001 0,040 ± 0,001 0,040 ± 0,001 |
2,5 2,5 2,5 |
|
Ромашки цветки (Chamomillae flores) |
0,00 0,40 0,80 |
12,2 22,0 31,5 |
0,49 ± 0,01 0,89 ± 0,02 1,28 ± 0,02 |
2,0 2,2 1,6 |
0,049 ± 0,001 0,049 ± 0,001 0,048 ± 0,001 |
3,3 3,3 3,3 |
0,050 ± 0,001 |
2,0 |
0,049 ± 0,001 0,049 ± 0,001 0,048 ± 0,001 |
3,3 3,3 3,3 |
|
Грудной сбор № 4 |
0,00 0,40 0,80 |
14,4 24,3 34,0 |
0,59 ± 0,02 0,99 ± 0,02 1,38 ± 0,02 |
3,3 2,0 1,4 |
0,059 ± 0,002 0,059 ± 0,002 0,058 ± 0,002 |
2,0 2,0 2,1 |
0,060 ± 0,002 |
2,0 |
0,059 ± 0,002 0,059 ± 0,002 0,058 ± 0,002 |
2,0 2,0 2,1 |
Примечание. n = 5, p = 95 %.
Таблица 3
Результаты определения сурьмы в фитопрепаратах, найденные по времени генерации
|
Наименование ЛРС |
Введено Sb, мкг |
ΔΔτ, с |
Найдено, мкг |
Sr, % |
Найдено в мг/кг сухого вещества |
|||||
|
фотохимический метод |
Sr, % |
метод ААС |
Sr, % |
фотометрический метод |
Sr, % |
|||||
|
Крапивы листья (Urticae folia) |
0,00 0,40 0,80 |
7,5 14,8 22,1 |
0,41 ± 0,01 0,80 ± 0,02 1,20 ± 0,02 |
2,5 2,5 1,7 |
0,041 ± 0,001 0,040 ± 0,001 0,040 ± 0,001 |
2,5 2,5 2,5 |
0,040 ± 0,001 |
2,5 |
0,040 ± 0,001 0,040 ± 0,001 0,040 ± 0,001 |
2,5 2,5 2,5 |
|
Ромашки цветки (Chamomillae flores) |
0,00 0,40 0,80 |
9,1 16,4 23,8 |
0,49 ± 0,01 0,89 ± 0,02 1,29 ± 0,02 |
2,0 2,2 1,6 |
0,049 ± 0,001 0,049 ± 0,001 0,049 ± 0,001 |
2,0 2,0 2,0 |
0,050 ± 0,001 |
2,0 |
0,049 ± 0,001 0,049 ± 0,001 0,048 ± 0,001 |
3,3 3,3 3,3 |
|
Грудной сбор № 4 |
0,00 0,40 0,80 |
11,0 18,4 25,8 |
0,60 ± 0,01 1,00 ± 0,02 1,40 ± 0,02 |
1,7 2,0 1,4 |
0,060 ± 0,001 0,060 ± 0,001 0,060 ± 0,001 |
1,7 1,7 1,7 |
0,060 ± 0,002 |
2,0 |
0,059 ± 0,002 0,059 ± 0,002 0,058 ± 0,002 |
2,0 2,0 2,1 |
Примечание. n = 5, p = 95 %.
Фотохимический метод определения сурьмы в фитопрепаратах отличается простотой проведения эксперимента, высокой чувствительностью, селективностью, экспрессностью, не требует дорогостоящего оборудования, что позволяет использовать его в условиях обычной контрольно-аналитической лаборатории.
Выводы
1. Разработана методика количественного определения микропримеси сурьмы в фитопрепаратах, заключающаяся в титровании стибина фотогенерированным йодом (Sr составляет 1,4–3,3 %). Экспериментально подтверждено, что для устранения влияния мышьяка и его соединений на результаты определения сурьмы необходима предварительная обработка аналита концентрированной соляной кислотой.
Рецензенты:
Шевердов В.П., д.фарм.н., профессор, ФГБОУ ВПО «Чувашский государственный университет имени И.Н. Ульянова», г. Чебоксары;
Павлова С.И., д.м.н., доцент, ФГБОУ ВПО «Чувашский государственный университет имени И.Н. Ульянова», г. Чебоксары.
Работа поступила в редакцию 23.07.2014.