Установлено, что в процессе злокачественного роста происходит изменение параметров редоксзависимых процессов в организме-опухоленосителе [12,3]. Образование активных форм кислорода (АФК) в тканях в норме определяет нормально протекающие метаболические процессы, выполняя роль сигнальных молекул [2,7]. При усилении генерации АФК без адекватного изменения емкости антиоксидантной защиты возникает оксидативный стресс, который выступает как одно из патогенетических звеньев онкозаболевания [4,8]. Пролиферативная способность опухолевых клеток определяется работой систем вне- и внутриклеточной сигнализации. При пониженной чувствительности к антипролиферативным сигналам трансформированные клетки (они менее чувствительны к рост-ингибирующим цитокинам) внешние сигналы дифференцировки и апоптоза могут воспринимать как митогенные сигналы.
В последнее время значимую роль в канцерогенезе отводят изменениям метаболизма кислорода [13], что является развитием концепции О. Варбурга (1956). Было показано, что переключение метаболизма с окислительного фосфорилирования на гликолиз связано с усилением образования АФК [9]. При этом усиливается перенос электронов через пентозофосфатный путь на НАДФН и gSH. В итоге в неоплазме изменяется редокс-гомеостаз [10]. Существует точка зрения, согласно которой высокая пролиферативная активность, лекарственная резистентность, снижение апоптоза, иммортализация опухолевых клеток могут быть опосредованы изменением метаболизма [5]. Ключевым сигналом такого изменения может выступать повышение уровня АФК, приводящее к изменению экспрессии генов.
Окислительная модификация белков (ОМБ) считается одним из ранних и надежных индикаторов нарушения редокс-гомеостаза [7]. При этом одним из проявлений ОМБ является повышение карбонильных производных белков. Продукты ОМБ имеют длительный период полураспада; их количество возрастает не только в результате посттрансляционной окислительной модификации, но и в результате протеолитической деструкции.
Рак яичников (РЯ) во многих странах занимает 5-ое ранговое место среди злокачественных заболеваний и встречается во всех возрастных группах, начиная с младенчества. Стандартизированные показатели заболеваемости РЯ в России увеличились на 20,4 % (с 9,3 на 100 000 в 1989 году до 11,2 на 100 000 в 2010 г.) [11]. Основным ограничением для успешного лечения РЯ является развитие лекарственной устойчивости к комбинированной химиотерапии [1]. При этом также важно, чтобы длительная адъювантная химиотерапия не привела к развитию вторичных опухолей. Для комбинированной химиотерапии обычно подбирают противоопухолевые препараты, различающиеся по механизму действия. Схема САР предполагает использование двух препаратов – цисплатина и циклофосфамида – из группы соединений алкилирующего действия. Препараты этой группы вызывают нарушения репликации ДНК, приводящие к мутациям и гибели клеток. Соответственно, они обладают не только противоопухолевым, но и мутагенным действием. Третий препарат, используемый по схеме САР, – доксорубицин. Это противоопухолевый антибиотик. Он вызывает интеркаляцию и ковалентное связывание ДНК и стимулирует образование свободных радикалов.
Целью исследования была оценка окислительной модификации белков (ОМБ) в эритроцитах больных раком яичников после полихимиотерапии по схеме САР.
Материал и методы
Обследуемая группа состояла из 25 первичных больных раком яичников (РЯ) на III стадии по FIGO, подвергавшихся обследованию в гинекологическом отделении Ульяновского областного клинического онкологического диспансера. Контрольную группу составили практически здоровые женщины. Больные были обследованы через 3 и 14 дней после первого и 3 и 14 дней после второго курса полихимиотерапии по схеме САР (цисплатин 75 мг/м2, доксорубицин 40 мг/м2 и циклофосамид 600 мг/м2). Интервал между курсами составил 21 день. В эритроцитах, полученных из венозной крови, для оценки уровня ОМБ, проводили реакцию с 2,4-динитрофенилгидрозином по методу Дубининой Е.В. [4], которую регистрировали спектрофотометрически при λ=356 нм (альдегидные группы нейтрального характера), λ=370 нм (кетонные группы нейтрального характера), λ=430 нм (альдегидные группы основного характера) и λ=530 нм (кетонные группы основного характера). Значения продуктов ОМБ пересчитали на 1 мг белка. Поскольку распределение в выборках отличалось от нормального, для оценки достоверности различий между группами использовали непараметрический критерий Манна-Уитни (Stata v.6.0). Различия считались статистически значимыми при р≤0,05 от уровня контрольной группы.
Результаты и их обсуждение
В результате проведенных исследований установлено повышение уровня продуктов ОМБ у больных РЯ по сравнению с донорами. Содержание альдегидных групп нейтрального характера при 346 нм у больных РЯ составило 1,35±0,106 ед против 1,24±0,06 ед в контроле. Количество кетонных групп нейтрального характера, регистрируемое при 370 нм, составило 1,37±0,74 ед против 1,25±0,56 ед в контроле. Содержание карбонильных производных основного характера, регистрируемых при λ=530 нм, составило 0,501±0,035 ед против 0,368±0,028 ед в контроле. Повышение уровня продуктов ОМБ может свидетельствовать о возникновении карбонильного стресса на III клинической стадии РЯ.
Первые исследования по изучению уровня карбонильных производных окисленных белков проводились на модельных системах, в том числе на эритроцитах человека [12].
Показано, что повышение уровня карбонильных производных является одним из ранних и значимых маркеров окислительного повреждения при многочисленных патологических состояниях и старении организма. В результате проведенных исследований нами установлено, что химиотерапия по схеме САР у больных РЯ на III-ей клинической стадии заболевания через 3 дня после I-го курса вызывает достоверное и значимое увеличение в эритроцитах кетонных и альдегидных групп нейтрального характера, содержание которых продолжает нарастать к 14 дню после введения (рисунок). Содержание альдегидных и кетонных групп основного характера при этом снижалось и значимое и достоверное снижение имело место через 14 дней после введения.
Второй курс ПХТ по схеме САР на 3-й день после введения сопровождался снижением уровня всех изучаемых продуктов ОМБ как относительно показателей у первичных больных РЯ (рисунок).
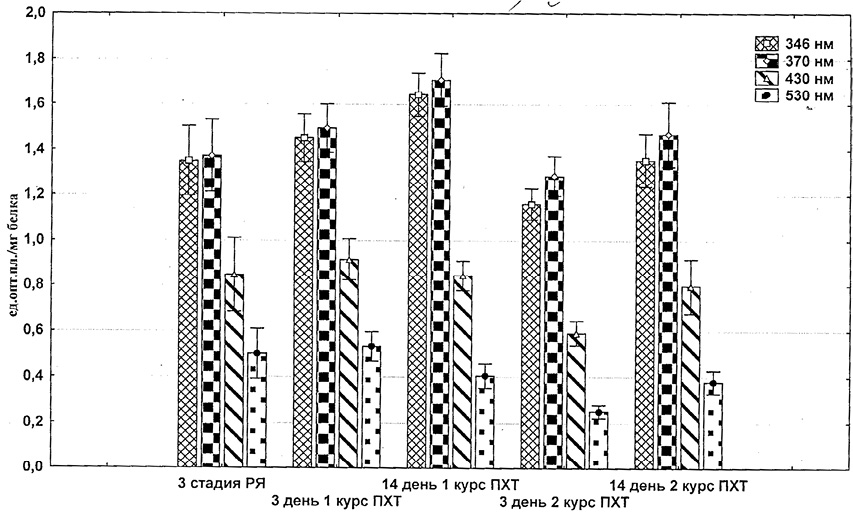
Содержание продуктов ОМБ в эритроцитах больных РЯ при полихимиотерапии по схеме САР
Однако через 14 дней после введения содержания продуктов ОМБ в эритроцитах вновь возрастает. Уровень кетонных и альдегидных групп нейтрального характера возрастает до уровня первичных больных РЯ; количество альдегидных и кетонных групп не достигает уровня первичных больных.
Заключение
Используемые при ПХТ РЯ по схеме САР препараты призваны индуцировать в опухолевых клетках генерацию АФК, осуществляя, таким образом, редокс-направленную терапию рака. Полученные нами результаты позволяют предполагать при этом изменение редокс-статуса эритроцитов, что повышает вероятность нарушения редокс-сигнализации и в тканях организма-опухоленосителя.
Работа поддержана гос. заданием МИНОБРНАУКИ России.
Рецензенты:
Родионов В.В., д.м.н., профессор, заведующий II хирургическим отделением ГУЗ Областной клинический онкологический диспансер, врач высшей квалификационной категории, ГУЗ ОКОД, г. Ульяновск;
Песков А.Б., д.м.н., профессор, декан постдипломного медицинского и фармацевтического образования ФГБОУ ВПО «Ульяновский государственный университет, г. Ульяновск.
Работа поступила в редакцию 30.06.2014.



