По данным ООН, за последние 100 лет средняя температура земной поверхности возросла на 0,75 °С [10]. Исследователи О.Д. Сиротенков и В.Н. Павлова из Всероссийского научно-исследовательского института сельскохозяйственной метеорологии сообщают о возможности положительного и отрицательного влияния на окружающую среду повышения температуры, сопровождающегося изменением годовой и суточной амплитуды. Например, авторы называют увеличение продолжительности безморозного периода как положительный фактор, а повышение температуры в период налива и созревания зерна, ведущего к сокращению данных периодов и соответственно уменьшению урожайности, отрицательным [9]. В соответствии со сценарием глобального развития, составленного межправительственной группой экспертов по изменению климата «A1FI» (предусматривает высокие темпы экономического роста при интенсивном использовании ископаемого топлива), Всероссийским НИИ сельскохозяйственной метеорологии, предложена динамика отклонения урожайности зерновых культур при изменении климата в федеральных округах России от современного уровня. Из полученных ими данных следует, что в Уральском федеральном округе данный показатель составит на 2030 год 26 % и в 2050 году 38 %. Наиболее оптимальным выходом из складывающейся ситуации являются селекционные работы по созданию генетического материала или сортов, обладающих широким адаптивным потенциалом в меняющихся условиях среды [2].
Идея создания генетического материала, адаптированного под постоянно меняющиеся погодные условия и обладающего качественно новыми селекционно ценными признаками, была и остается ведущей в селекции растений. Одним из способов реализации поставленной задачи, по мнению Иосифа Абрамовича Рапопорта, является химический мутагенез, позволяющий в короткие сроки получить большое разнообразие новых признаков и свойств у мутационного материала [11].
Целью настоящего исследования явилось изучение влияния химического препарата на основные показатели роста, развития, выживаемости и продуктивности двух исходных сортов мягкой яровой пшеницы и их гибридного потомства; выявление оптимальной концентрации мутагенного вещества.
Материалы и методы исследований
В качестве исходного материала в индуцированном мутагенезе принимали участие гибридная (F4) комбинация Cara х Скэнт 3, полученная нами методом гибридизации в 2009 году (биостанция Тюменского государственного университета «Озеро Кучак», г. Тюмень) в системе неполных диаллельных скрещиваний, а также родительские формы: Cara (Мексика, из мировой коллекции ВНИИ растениеводства им. Н.И. Вавилова) и Скэнт 3 (Казахстан, районирован в Тюменской области) [5]. Из вышеназванных образцов отбирали по 50 зерен для каждой из двух концентраций мутагена и контроля. Обработку изучаемого материала диэтиленимид 2-амидопиримидилфосфорной кислотой проводили в лаборатории биотехнологических и микробиологических исследований Тюменского государственного университета. Семена погружали в растворы двух различных концентраций мутагена (0,002 %; 0,01 %), контроль в дистиллированную воду, экспозиция составила 3 часа. Затем семена промывали 45 минут в проточной воде [1, 6]. Одну часть обработанных семян использовали в лабораторном эксперименте, другую их часть высушивали и хранили до посевного периода.
Химический препарат диэтиленимид 2-амидопиримидилфосфорная кислота, фосфемид или фосфазин (Phosphemidum), – белый кристаллический порошок, растворимый в воде и спирте. Препарат синтезирован по заказу на химическом факультете Московского государственного университета им. Ломоносова.
Для определения энергии прорастания семян, а также морфометрических параметров проростков часть обработанных мутагеном семян и контроль проращивали в чашках Петри на увлажнённой дистиллированной водой фильтровальной бумаге в соответствии с ГОСТ 12038-84 для мягкой яровой пшеницы [3].
Другая часть семян использована для полевого изучения на биостанции Тюменского государственного университета «Озеро Кучак» в 2013 году. Экспериментальный участок расположен в Нижнетавдинском районе Тюменской области на границе двух агроклиматических зон: подтайги и северной лесостепи. Почва участка окультуренная, дерново-подзолистая супесчаная. Анализ почвенных проб проведён на базе лаборатории «Экотоксикологии» Тобольской комплексной научной станции Уральского отделения РАН. Отбор проб выполнен в соответствии с ГОСТ 28168-89. Валовое содержание элементов в образцах почвы определяли атомно-эмиссионным методом на спектрометре OPTIMA-7000DV. Кислотность в солевой вытяжке почвы экспериментального участка составила 6,6, относится к слабощелочному типу (ГОСТ 26423-85). Содержание гумуса - 3,67 %. Сухой остаток равен 0,47% (норма 0,30%, ГОСТ 26423-85). Определено количество анионов (мг•экв): Cl- (ГОСТ 26425-85, п.1) – 0,43±0,00; SO42- (ГОСТ 26426-85) – 0,2±0,00; HCO3- (ГОСТ 26424-85) – 0,23±0,01. Катионов (мг•экв): Mg2+ (ГОСТ 26487-85) – 1,66±0,04; Ca2+ (ГОСТ 26487-85) – 6,86±0,06. Содержание биогенных веществ (мг/кг): NH4+ (ГОСТ 26489- 85) – 19,5±0,12; NO2- (ГОСТ 26107-84) – 9,15±0,73; NO3- (26488-85) – 18,8±0,32; H2PO4- и HPO4- (ГОСТ 26207-84) – 433,3±34,51. Валовое содержание макро- и микроэлементов (мг/кг): As - 2,09; Ca – 3362,33; Сd – 25,02; Сo – 17,52; Cr – 92,27; Сu – 55,41; Fe – 3553,51; Mg – 1125,37; Mn – 382,64; Mo – 68,61; Ni – 61,84; Pb – 38,99; Sr – 29,69; Zn – 402,52.
Посев семян, обработанных различными концентрациями мутагена, и контроль проводили блоками отдельно для каждого образца (М1). При закладке опыта использовали методические указания Всероссийского НИИ растениеводства им. Н.И. Вавилова [4].
Условия 2013 года характеризовались рядом особенностей гидротермического режима. По показателю ГТК Г.Т. Селянинова вегетационный период относился к слабо засушливому (ГТК = 1,19). Сумма активных температур выше 10 °С за этот период составила 1847,9°С. Учитывая, что, по данным К.А. Фляксбергера [12], оптимальная сумма активных температур для роста и развития мягкой яровой пшеницы составляет 1500-1750 0С, превышение данного показателя равно 97,9 °С. В период посева (9.05) и всходов (20.05–23.05.) отмечалось понижение среднесуточной температуры воздуха на 1,6°С по сравнению со средним многолетним значением в сочетании с большим количеством осадков (140,9% к норме). В фазы выход в трубку (16.06) и созревания (1.08-2.09) наблюдалось повышение среднесуточной температуры воздуха и недостаток влаги в июне (0,2°С; 62,0 %) и августе (1,4°С; 62,7 %), в периоды, очень важные для формирования колоса и налива зерна.
Результаты исследований и их обсуждение
Впервые применение химического мутагенеза в селекции растений в России предложил И.А. Рапопорт, за что был номинирован на Нобелевскую премию. На сегодняшний день в селекции растений широко применяются мутагены химического характера, ведутся поиски новых химических индукторов мутаций [16].
Авторским коллективом под руководством Н.С. Эйгес получены сорта озимой пшеницы с высокой адаптивной способностью в результате отдалённой гибридизации и химического мутагенеза. За семнадцатилетний период, шесть лет из которых являлись крайне неблагоприятными, удалось доказать преимущество по адаптивным свойствам образцов, полученных с помощью химического мутагенеза. Причинами возникновения высоких адаптивных свойств при химическом мутагенезе авторы называют множественные мутации, гетерозис и увеличение содержания гетерохроматина в клетке [15].
Успех в получении мутаций и жизнеспособных мутантов при индуцированном химическом мутагенезе во многом зависит от химического препарата, его концентрации [14, 15]. Диэтиленимид 2-амидопиримидилфосфорная кислота по химическому строению относится к соединениям группы этиленимина и этилендиамина. Соединения данной группы широко известны и интересны своей способностью алкилировать ДНК и белки, вызывая нарушения хромосомного аппарата. Особенностью фосфемида является присутствие у него двух этилиниминновых групп и пиримидинового основания. В статье, основанной на многолетних исследованиях Л.И. Вайсфельд цитогенетического действия противоопухолевого препарата фосфемида, сообщается, что данный препарат способен подавлять митотическую активность и вызывать перестройки в клетках проростков Crepis capillaris. При цитогенетическом анализе было установлено, что больше перестроек возникает при большей концентрации препарата, также показано, что высокая концентрация (1 · 10-2М) фосфемида вызывала разрушение веретена деления и множественные разломы хромосом [1, 11]. Большое значение концентрации в работах с сильным химическим мутагеном этилениминам (ЭИ) приводит Н.С. Эйгес, сообщая о наиболее эффективном влиянии низких доз (0,01-0,04 %), вызывающих возникновение исключительно генных мутаций и повышающих количество гетерохроматина в клетках, что и является следствием широкого разнообразия, высокой жизнеспособности и продуктивности полученных мутантов. Высокие дозы мутагена (0,09-0,12 %, экспозиция 24 часа) в исследованиях, проведённых автором, вызывали повреждение ядерного аппарата клетки (перестройки хромосом и анеуплоидию), хозяйственно ценные признаки при таком способе обработке отсутствовали [17].
Нами проведено изучение чувствительности двух сортов, различающихся по эколого-географическому происхождению, методам создания, принадлежности к ботанической разновидности, и гибрида, полученного от скрещивания этих сортов, к двум концентрациям фосфемида. При этом активность мутагена определялась по изменчивости в М1 как популяционных признаков (энергия прорастания, всхожесть семян, выживаемость растений), так и индивидуальных (длина проростков, высота растений, продуктивность).
Л.А. Кротова и другие исследователи сообщают о влиянии химических мутагенов на всхожесть семян, выживаемость и продуктивность растений М1 в зависимости от мутагена, его концентрации, экспозиции, а также видовой принадлежности и генотипа исследуемых растений [7, 8, 14, 16]. По нашим данным можно судить о неоднозначном влиянии диэтиленимид 2-амидопиримидилфосфорной кислоты на основные морфобиологические признаки образцов мягкой яровой пшеницы.
Изучение чувствительности яровой пшеницы к воздействию мутагена было начато с лабораторных исследований. Биологическая активность мутагена определялась по способности семян к прорастанию, а также по морфометрическим параметрам проростков. Фосфемид оказал ингибирующее действие на показатели энергии прорастания семян. При этом ингибирующий эффект оказался в прямой зависимости от дозы мутагена. Вместе с тем у гибрида Cara х Скэнт 3 отмечен эффект стимуляции, проявившийся в увеличении показателя энергии прорастания на 6% по сравнению с контролем (рис. 1). В.А. Шерер и Р.Ш. Гадиев утверждают о стимулирующем действии химических мутагенов на первых этапах эмбриональной детерминации в развивающихся семенах и стимуляции созидательных градиентов растений. Согласно закону Арндта-Шульца «Arndt-Schulz-Gesetz», слабые раздражения пробуждают деятельность живых элементов, средние усиливают, сильные тормозят, а очень сильные парализуют. Таким образом, слабые концентрации мутагенного вещества могут стимулировать процессы жизнедеятельности растений. Отражение стимулирующего действия различных химических мутагенов на растения нашло в работах А.И. Китаева, Н.С. Эйгес, В.К. Шумного, Л.А. Кротовой и др. [7, 8, 13, 14, 16, 17].
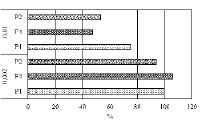
Рис. 1. Влияние фосфемида на энергию прорастания семян в М1 (% по отношению к контролю) Примечание: Р1 – Cara; F4 – Cara х Скэнт 3; Р2 – Скэнт 3; К – контроль; 0,002 и 0,01 % – концентрации фосфемида
Для полной оценки влияния различных концентраций фосфемида на рост и развитие родительских и гибридной (F4) форм мягкой яровой пшеницы нами были сняты и изучены морфометрические параметры проростков в лабораторных условиях на третьи сутки. По количеству образовавшихся зародышевых корней низкие показатели в 0,01 % концентрации отмечены у сорта Скэнт 3 (47,0 % к контролю), остальные образцы характеризовались незначительными изменениями данного признака по отношению к контролю. Резкое снижение длины зародышевых корней выявлено во всех концентрациях мутагена: Cara (0,002 % – на 40,0 % и 0,01 % – на 59,0 %), Cara х Скэнт 3 (0,002 % – на 25,0 % и 0,01 % – на 42,0 %) и Скэнт 3 (значительные изменения лишь в концентрации 0,01% на 36,0 %), наибольшие отклонения зарегистрированы в вариантах с высокими концентрациями фосфемида. Интересные результаты по изменчивости длины проростка у мексиканского сорта Cara по отношению к разным концентрациям мутагена. Так, при низкой концентрации (0,002 %) было отмечено снижение данного показателя на 61,0 %, при более высокой его концентрации (0,01 %) – лишь на 41,0 %. У остальных образцов отмечено резкое отклонение при концентрации 0,01% (Скэнт 3 – 52,0 % и Cara х Скэнт 3 – 57,0 % по отношению к контролю) (рис. 2).
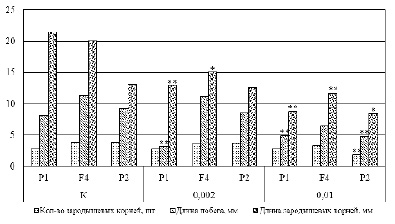
Рис. 2. Изменчивость морфологических признаков проростков яровой пшеницы в лабораторном опыте с применением химического мутагена Примечание: различия при сравнении с контролем статистически достоверны: * при Р ˂ 0,01 ** при Р ˂ 0,001; Р1 – Cara; F4 – Cara х Скэнт 3; Р2 – Скэнт 3; К – контроль; 0,002 и 0,01 % – концентрации фосфемида
В полевых исследованиях 2013 года сильное снижение показателей полевой всхожести (Cara – 37 % и Скэнт 3 – 65 %) и биологической устойчивости (Cara – 27 % и Скэнт 3 – 55 %) было отмечено у родительских форм, обработанных фосфемидом в 0,01 %-ной концентрации. При низкой концентрации значительных отклонений данных показателей от контроля не обнаружено. Ярко выраженный стимулирующий эффект выживаемости растений по отношению к контролю отмечен у гибридной комбинации на 14,0 % (0,002 %) и 80,0% (0,01 %). Полевая всхожесть у данного образца во всех концентрациях мутагена оказалась ниже контроля (0,002 % – на 33,0 % и 0,01 % на 10 %) (рис. 3).

Рис. 3. Влияние фосфемида на полевую всхожесть и биологическую устойчивость растений М1 (% по отношению к контролю)Примечание: Р1 – Cara; F4 – Cara х Скэнт 3; Р2 – Скэнт 3; К – контроль; 0,002 и 0,01 % – концентрации фосфемида
Ингибирующее действие мутагена проявилось и на высоте растений М1 в полевом опыте. Исследования показали, что увеличение концентрации фосфемида приводило к замедлению роста растений. Более чувствительным оказался мексиканский сорт Cara, у которого отмечено снижение показателя при изученных концентрациях (0,002 и 0,01 %) на 20,0 % и 77,0 % соответственно. В остальных вариантах отклонения от контроля были недостоверны (рис. 4).
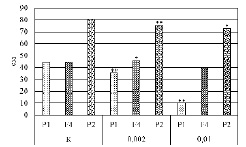
Рис. 4. Высота растений (М1) в зависимости от различных концентраций мутагена (фаза колошения) Примечание: различия при сравнении с контролем статистически достоверны: * при Р˂0,01 ** при Р˂0,001; Р1 – Cara; F4 – Cara х Скэнт 3; Р2 – Скэнт 3; К – контроль; 0,002 и 0,01% – концентрации фосфемида
Воздействие различных концентраций фосфемида на продуктивность исследуемых образцов оказалось неодинаковым. Концентрация мутагена 0,01 % имела стимулирующее влияние на данный показатель у гибридной комбинации Cara х Скэнт 3 – на 16,0 %, у сортов Cara и Скэнт 3 отмечалось резкое снижение семенной продуктивности - на 67,0 % и 57,0 % при сравнении с контролем. Реакция яровой пшеницы на действие химического препарата в меньшей концентрации была менее выраженной (рис. 5).
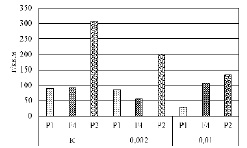
Рис. 5. Продуктивность яровой пшеницы М1 в вариантах опыта с применением химического мутагена Примечание: Р1 – Cara; F4 – Cara х Скэнт 3; Р2 – Скэнт 3; К – контроль; 0,002 и 0,01 % – концентрации фосфемида
Такое распределение данных может говорит о низкой чувствительности к мутагенному соединению гибридной (F4) формы Cara х Скэнт 3 и высокой чувствительности сортов Cara и Скэнт 3. Неодинаковая реакция родительских и гибридной (F4) формы на воздействие фосфемидом указывает на генотипические особенности исследуемого материала.
Заключение
На основании полученных нами данных можно сделать заключение о неоднозначном влиянии различных концентраций диэтиленимид 2–амидопиримидилфосфорной кислоты на показатели энергии прорастания, морфометрические параметры проростков, полевой всхожести, высоты растений, биологической устойчивости и продуктивности различных сортов и гибрида мягкой яровой пшеницы. По морфометрическим параметрам проростков и полевой всхожести семян выявлено максимальное ингибирующие действие химического препарата, наибольший стимулирующий эффект отмечен по показателю выживаемости растений.
Изученные образцы проявили различную чувствительность к воздействию химического мутагена, что может указывать на генотипические особенности исследуемого материала и необходимость тщательного изучения и подбора концентраций мутагенного вещества - фосфемида. Выявлено, что созданная нами гибридная комбинация Cara х Скэнт 3 обладает меньшей чувствительностью к мутагену по сравнению с родительскими формами.
В целом данная работа направлена на изучение эффективности использования мутагенного агента в нескольких дозах для расширения генетического разнообразия растений и реального увеличения возможности отбора, которые можно значительно повысить при сочетании рекомбинационной и мутационной изменчивости.
Рецензенты:
Белкина Р.И., д.с.-х.н., профессор кафедры технологии производства, хранения и переработки продукции растениеводства ФГБОУ ВПО «Государственный аграрный университет Северного Зауралья», г. Тюмень;
Пак И.В., д.б.н., заведующий кафедрой экологии и генетики ФГБОУ ВПО «Тюменский государственный университет Минобрнауки России», г. Тюмень.
Работа поступила в редакцию 04.06.2014.



