Растительные препараты имеют важное значение в разработке современных инновационных технологий не только в области растениеводства и животноводства, но и в медицине и природоохранной сфере (Терехин и Вандышев, 2008). Одной из важных задач биотехнологии является разработка биопрепаратов для увеличения роста и продуктивности растений без ущерба для окружающей среды (Егорова, 1986). Род Шалфей принадлежит к большой семье Lamiaceae и состоит из около 900 видов, организованных в пять подродов, распространенных во всем мире (Hedge, 1992). Salvia officinalis L. – растение, хорошо известное своими лечебными свойствами и приятным ароматом. Считается, что данное растение обладает целебными свойствами, которые выражаются в антиоксидантном и противодиабетическом действии. Однако подобные эффекты не имеют биологического экспериментального подтверждения (Lima et al., 2004).
Экстракты шалфея, в основном эфирное масло, также широко используются при изготовлении продуктов питания, лекарств, напитков, косметических и парфюмерных средств. В последние десятилетия активно изучаются антиоксидантные свойства шалфея (Deans et al., 2000). Кроме того, он обладает вяжущим, желчегонным, антиспастическим, вазодилатирующим, стимулирующим и тонизирующим свойствами. Эфирное масло шалфея лекарственного обладает ярко выраженными антисептическими свойствами (Губанов, 1993; Казаринова и Ткаченко, 2000).
Инсектицидная активность характерна для метанольного экстракта шалфея (Pavela, 2004), в то время как водная экстракция обладает антимутагенным свойством (Samejima et al., 1995). Вегетативные части растения содержат α-туйон, 1,8-цинеол и камфару, из чашечек цветков также выделяются α-туйон, 1,8-цинеол, однако наиболее велико содержание β-пинена (Байкова и соавт., 2002).
Цель настоящей работы – хроматографическая характеристика метаболитов Trichoderma harzianum, Fusarium oxysporum, Aspergillus niger, Aspergillus flavus и Aspergillus awamori до и после обработки маслом Salvia officinalis.
Материалы и методы исследования
Объектом исследования явились грибы Trichoderma harzianum, Fusarium oxysporum, Aspergillus niger, Aspergillus flavus и Aspergillus awamori. Штамм Trichoderma harzianum, выделенный из почвы на территории Египта, был предоставлен кафедрой сельскохозяйственной микробиологии, факультета сельского хозяйства, университета Минья, г. Эль-Минья, Египет. Штамм Fusarium oxysporum и Aspergillus niger был выделен из семян кукурузы и почв РТ. A. flavus был получен из музея кафедры низших растений МГУ. Трансформированный штамм Aspergillus awamori был любезно предоставлен лабораторией исследования клеток микромицетов Эдинбургского университета.
Растительное масло Salvia officinalis было привезено из Египта (фирма El Hawag Factory (Badr city), Египет).
Все исследуемые штаммы грибов высеивали в колбы со стерильной жидкой средой Чапека (г/л раствора): сахароза – 30, NaNO3 – 3, KH2PO4 – 1, MgSO4·7H2O – 0,5, KCl – 0,5, FeSO4·7H2O – 0.01. Обработку грибов проводили маслом Salvia officinalis: 50 мкл масла на 50 мл среды. В качестве контроля высеивали грибы без масла. На 1 сутки помещали грибы в термостат при 28 °С. Культивировали их на качалке со скоростью 128 об/мин в течение 7 дней, 28 °С. В дальнейшем культуральную жидкость освобождали от мицелия фильтрацией (Millipore, диаметр пор 0,22 мкм).
Метаболиты исследуемых грибов в культуральной жидкости определяли методом гель-фильтрации на хроматографе ÄKTA™ avant 25, колонка Superose 12 10/300 GL (GE Healthcare, Швеция). Колонку уравновешивали 0,05 М фосфатным буфером, 0,15 М NaCl, pH 7,0 при скорости потока 0,5 мл/мин согласно инструкции фирмы производителя.
Колонку калибровали по молекулярной массе нанесением 300 мкл смеси маркеров, содержащего бычий сывороточный альбумин (БСА) (67000 Да) с концентрацией 2,66 мг/мл, цитохром С (12700 Да) с концентрацией 0,33 мг/мл, витамин B12 (1355 Да) с концентрацией 0,16 мг/мл при скорости потока 0,5 мл/мин. Концентрацию белка в исследуемых образцах культуральной жидкости определяли спектофотометрически по коэффициенту экстинкции при длинах волн 260 и 280 нм на приборе Nano Drop 2200 (Thermo Scientific).
Для разделения метаболитов на колонку наносили до 500 мкл культуральной жидкости в количестве 0,2–1,6 мг белка. Хроматографию проводили при скорости потока 0,45 мл/мин в 0,05 М фосфатном буфере, 0,15 М NaCl, pH 7,0 с детекцией биомолекул при 254, 280 и 335 нм.
Результаты исследования и их обсуждение
Однако до сегодняшнего дня не было проведено оценки влияния масла шалфея на состав метаболитов Trichoderma и фитопатогенных грибов. Таким образом, актуальным является исследование влияние масла шалфея на состав метаболитов Trichoderma harzianum, Fusarium oxysporum, Aspergillus niger, Aspergillus flavus и Aspergillus awamori.
Изучение влияния масла шалфея лекарственного на метаболизм Trichoderma и фитопатогенных грибов проводили методом гель-фильтрации для разделения компонентов культуральной жидкости по молекулярной массе (рис. 1, а) после культивирования контрольных и опытных образцов. Хроматографический профиль биомолекул среды Чапека без грибов и масла (контроль), кульвированной в условиях, аналогичных экспериментальным, представлен на рис. 1, б.
а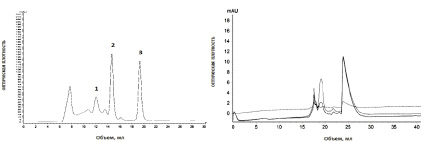 б
б
Рис. 1. Хроматографический профиль: а – белки-маркеры; б – среда Чапека (контроль); 1 – (БСА (67000 Да); 2 – цитохром С (12700 Да); 3 – витамин B12 (1355 Да). ― (сплошная линия) E280; -- (пунктирная линия) E254; -.- (пунктир с точкой) E335
На первом этапе было изучено влияние масла шалфея на состав метаболитов Trichoderma harzianum. Как видно на рис. 2, а, в контроле присутствуют соединения, элюируемые с колонки в объеме 12,5–25 мл (от 67000 и ниже 1355 Да), а также высокомолекулярные соединения с молекулярной массой около 98000 Да (7,5 мл) и биомолекулы с низкой молекулярной массой (ниже 1355 Да), элюируемые в объеме 32–34 мл. В опытном образце (рис. 2, б) изменяется профиль веществ, элюируемых в объеме 12.5–25 мл (от 67000 и ниже 1355 Да) и отсутствуют высокомолекулярные соединения с молекулярной массой более 67000 Да (7,5 мл) и перестает выделяться метаболит аминокислотно-пептидной природы с низкой молекулярной массой (ниже 1355 Да), элюируемый в объеме 32–34 мл.
а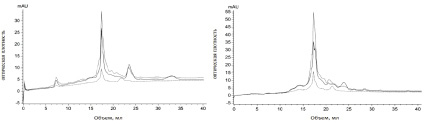 б
б
Рис. 2. Хроматографический профиль: а – метаболитов Trichoderma harzianum в культуральной среде Чапека (контроль); б – метаболитов Trichoderma harzianum, обработанного маслом шалфея ― (сплошная линия) E280; -- (пунктирная линия) E254; -.- (пунктир с точкой) E335
Данные результаты свидетельствуют о том, что масло шалфея отменяет и/или стимулирует выработку у Trichoderma определенных веществ, которые могут влиять на фитотоксическую или антагонистическую активность гриба.
На втором этапе было исследовано влияние масла шалфея на состав метаболитов Fusarium oxysporum. Обнаружено что добавление масла шалфея приводит к изменению состава метаболитов (рис. 3): изменяется молекулярная масса и состав метаболитов в культуральной среде. Отмечено, что по сравнению с контролем в опытном образце присутствуют высокомолекулярные (около 98000 Да) и низкомолекулярные соединения (элюированы в объеме 35 мл), уменьшается содержание веществ, поглощающих при 280 нм с молекулярной массой около 12000 Да. Следовательно, масло шалфея влияет на метаболизм Fusarium oxysporum.
а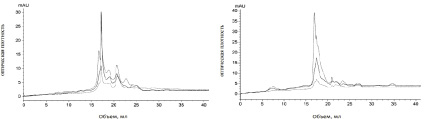 б
б
Рис. 3. Хроматографический профиль: а – метаболитов Fusarium oxysporum в культуральной среде Чапека (контроль); б – метаболитов Fusarium oxysporum, обработанного маслом шалфея. ― (сплошная линия) E280; -- (пунктирная линия) E254; -.- (пунктир с точкой) E335
При исследовании влияния масла шалфея на состав метаболитов A. niger выявлено, что в опытном образце (рис. 4, б) в сравнении с компонентами контроля (рис. 4, а) изменяется соотношение веществ, повышается концентрация низкомолекулярных метаболитов, поглощающих при 254 нм. Исходя из результатов, можно сделать вывод о том, что масло шалфея приводит к увеличению низкомолекулярных метаболитов у Aspergillus niger.
а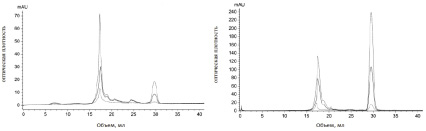 б
б
Рис. 4. Хроматографический профиль: а – метаболитов Aspergillus niger в культуральной среде Чапека (контроль); б – метаболитов Aspergillus niger, обработанного маслом шалфея. ― (сплошная линия) E280; -- (пунктирная линия) E254; -.- (пунктир с точкой) E335
Выявлено, что по сравнению с контролем (рис. 5, а) в опытном образце (рис. 5, б) изменяется хроматографический профиль компонентов культуральной среды, в том числе отсутствуют вещества, элюируемые в объеме 18–19 мл (около 1355 Да), но появляются новые метаболиты, элюируемые с колонки в объеме 16–17 и 22,5–29 мл с молекулярной массой менее 1355 Да. Таким образом, масло шалфея приводит к выделению новых метаболитов у Aspergillus flavus.
а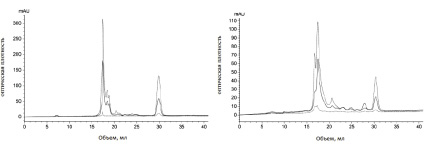 б
б
Рис. 5. Хроматографический профиль: а – метаболитов Aspergillus flavus в культуральной среде Чапека (контроль); б – метаболитов Aspergillus flavus, обработанного маслом шалфея. ― (сплошная линия) E280; -- (пунктирная линия) E254; -.- (пунктир с точкой) E335
С учетом рекомендаций для лабораторных исследований в опытах in vitro была произведена замена патогенного для человека вида A. niger на сапротрофный его аналог. В связи с этим на последнем этапе исследования нами было изучено влияния масла шалфея на состав метаболитов A. awamori. Изучение влияния масла шалфея на состав метаболитов A. awamori, показало, что по сравнению с контролем (рис. 6, а) в опытном образце (рис. 6, б) радикально изменяется состав культуральной жидкости, присутствуют разнообразные по молекулярной массе метаболиты.
а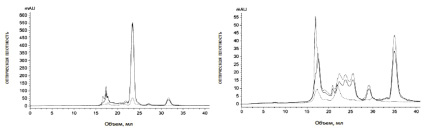 б
б
Рис. 6. Хроматографический профиль: а – метаболитов Aspergillus awamori в культуральной среде Чапека (контроль); б – метаболитов Aspergillus awamori, обработанного маслом шалфея. ― (сплошная линия) E280; -- (пунктирная линия) E254; -.- (пунктир с точкой) E335
Заключение
Следует отметить, что масло шалфея изменяет метаболизм Trichoderma и фитопатогенных грибов, что может влиять на фитотоксическую или антагонистическую активность гриба. В дальнейшем будет проведена идентификация метаболитов и определена значимость воздействия масла шалфея лекарственного на метаболизм исследованных грибов.
Рецензенты:
Багаева Т.В., д.б.н., зав. кафедрой биотехнологии Казанского (Приволжского) федерального университета, г. Казань;
Канарский А.В., д.т.н., профессор кафедры пищевой биотехнологии Казанского национального исследовательского технологического университета, г. Казань.
Работа поступила в редакцию 28.05.2014.



