Австралийские красноклешневые раки культивируются уже более 25 лет, но их ежегодная товарная продукция в настоящее время ещё незначительна. Тем не менее выращивание этого вида десятиногих раков становится для многих стран (Австралия, Китай, Белиз, Индонезия, Бразилия, США и других) экономически выгодным [5]. Этот вид не требователен к качеству воды: активная реакция в пределах pH 6,5–8,5, жесткость от 5 до 20. Оптимальная температура воды при содержании – 20–28 °С, и рак может выживать при низком содержании кислорода и высоком содержании нитратов [2]. Они имеют простой жизненный цикл и простую технологию производства, потребляют корма с невысоким процентом протеина, что существенно снижает затраты при интенсивном выращивании [4]. При освоении биотехники выращивания десятиногих раков приходится решать ряд вопросов, связанных с изучением их биологии. Одним из важнейших вопросов является изучение размножения и развития объектов аквакультуры.
В связи с этим целью работы являлось изучение особенностей созревания яичников австралийских раков.
Материал и методы исследования
Исследование проводили на базе малого инновационного предприятия «Эко-тропик» и эколого-гистофизиологической лаборатории кафедры «Гидробиология и общая экология» Астраханского государственного технического университета в 2012–2013 гг. Объектом исследования служили самки красноклешневых раков разных возрастных групп. Отбор проб гонад производили у особей в возрасте от 10 дней до половозрелых. Гистологический анализ проведен по общепринятым методикам [1]. После удаления хитинового слоя фрагменты с половой железой фиксировали в растворе Буэна. Полученные срезы окрашивались гематоксилин-эозином. Фотографии серий микропрепаратов гонад осуществляли с помощью микроскопа «Оlimpus BH-2» при окуляре 22× и объективах 4, 10, 40×. Размеры половых клеток измерили с помощью окуляр-микрометра.
Результаты исследования и их обсуждение
Было много попыток выделить стадии зрелости у десятиногих раков, главным образом у креветок. При этом разные исследователи использовали различные способы и виды креветок и предлагали выделить разное количество стадий развития – от четырех до восьми. Вследствие исследования всего периода размножения, характеристики развития половых продуктов, формирования и функционирования половых желез, изменения морфофизиологических показателей позволили нам разделить созревание половых клеток самок австралийских раков на пяти стадий.
Первая стадия – неполовозрелые молодые особи (в возрасте 30–90 дней). Яичники данной стадии зрелости обнаружены у рачат с длинной карапакса 7,5–17,7 мм. Половые железы имели вид тонких прозрачных тяжей, расположенных между долями гепатопанкреаса и под сердцем. В начальной стадии развития яичников половые клетки были представлены только оогониями (рис. 1). Оогонии образуются у самок из зачаткового эпителия в течение всей жизни. Они развиваются и делятся, что приводит к увеличению их численности. Затем часть оогоний перестает делиться, проходит период ядерных преобразований и начинает увеличиваться в размерах, образуя ооциты первого порядка (рис. 1, б). В свою очередь, ооциты первого порядка делятся на один ооцит второго порядка и два полярных тельца.
а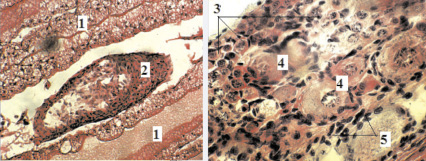 б
б
Рис. 1. Яичники австралийского рака в возрасте 40–45 дней (а) и в возрасте 70 дней (б) (стадия I). Увеличение 22×40. Гематоксилин-эозин: 1 – печень, 2 – яичник, 3 – оогонии, 4 – ооциты первого порядка, 5 – фоликулярные клетки
В возрасте 60–90 дней (длина карапакса 11,8–17,7 мм) половые клетки самок были представлены оогониями и молодыми ооцитами периода протоплазматического роста. Яичники по-прежнему оставались прозрачными и почти бесцветными (рис. 1, б). Оогонии австралийских раков имели округлую или шаровидную форму и очень небольшие размеры с крупным ядром, окруженным тонким слоем цитоплазмы. Средние размеры оогоний на разных стадиях незначительно были различны и составили в 9,51–9,81 мкм (таблица).
Ооциты этой стадии еще маленькие, их диаметр 42,35 мкм, меньше диаметра ооцитов первого порядка других стадий в 1,5–1,6 раз. Диаметр их ядер колебался в пределах от 7,81 до 34,14 мкм (среднее значение 19,42 ± 1,33 мкм). Отношение объема между ядрами и клетками достигло значения наибольшего по сравнению с другими стадями (0,096).
Вторая стадия – созревающие особи с длиной карапакса 19,7–29,2 мм (в возрасте 90–150 дней). У самок второй стадии яичники некрупные. Средний диаметр ооцитов I составил 63,36–67,01 мкм, а диаметр ооцитов II колебался от 130 до 181,8 мкм. Округлые ооциты протоплазматического роста из свежих яичников были хорошо видны под бинокуляром, которые составляют основную массу половых клеток. Они имели крупные размеры за счет увеличившегося ядра и объема протоплазмы. Их ядра занимают центральное положение или смещены к периферии. Наряду с ооцитами, прошедшими период протоплазматического роста, в яичниках присутствовали также оогонии и ооциты начальных фаз периода трофоплазматического роста (рис. 2).
Достижение половозрелости в большей степени определяется не возрастом, а размером десятиногих раков. Размер яичников зависит от размерных показателей тела гидробионтов. В возрасте 90 дней самка с длиной карапакса 19,7 мм имела длину яичника 5,35 ± 0,048, а в возрасте 120 дней (23,9 мм) и 150 дней (23,5 мм) – длины яичников 6,5 ± 0,145 и 6,25 ± 0,13 мм соответственно. В этой стадии вокруг ооцитов закладывался слой фолликулярных клеток, образующихся из зародышевого эпителия яичников. Ооциты имели большое ядро и относительно небольшой слой цитоплазмы (отношение объема ядра и клетки – от 0,043 до 0,0485). Оболочка ооцитов тонкая, при световом микроскопировании выглядит бесструктурной. В яичнике были видны ооциты разных стадий развития. На периферии более крупных ооцитов начиналось отложение мелких гранул. В ядрах хорошо был выражен хроматин.
Показатели размеров половых клеток самок в зависимости от возраста и длины карапакса австралийских раков
|
Показатели |
Возраст и длина карапакса Cherax quadricarinatus |
||||
|
70 дней CL = 14,5 ± 1,05 мм |
90 дней CL = 19,7 ± 1,1 мм |
120 дней CL = 23,9 ± 1,2 мм |
150 дней CL = 23,5 ± 1,5 мм |
180 дней CL = 31,2 ± 1,3 мм |
|
|
Длина яичника (мм) |
2,32 ± 0,09 |
5,35 ± 0,048 |
6,5 ± 0,145 |
6,25 ± 0,13 |
8,9 ± 0,065 |
|
Диаметр оогония, мкм |
9,51 ± 0,72 |
9,81 ± 0,99 |
9,67 ± 0,76 |
9,67 ± 0,72 |
9,64 ± 0,6 |
|
Диаметр ооцитов I, мкм |
42,35 ± 2,79 |
63,36 ± 3,88 |
67,01 ± 3,58 |
70,43 ± 0,32 |
76,93 ± 6,44 |
|
Диаметр ооцитов I, мкм |
─ |
130,03 ± 4,07 |
181,87 ± 8,08 |
166,56 ± 6,55 |
237,56 ± 14,67 |
|
Диаметр ядра ооцитов I, мкм |
19,42 ± 1,33 |
27,57 ± 1,9 |
24,42 ± 1,43 |
25,61 ± 1,33 |
27,56 ± 1,88 |
|
Диаметр ядра ооцитов II, мкм |
─ |
41,49 ± 2,31 |
43,73 ± 1,74 |
41,06 ± 1,66 |
43 ± 2,01 |
|
Количество Оц. I Количество Оц. II |
Только ооциты I |
1,78 |
1,2 |
1,01 |
0,89 |
|
Объем ядра Объем клетки I |
0,096 |
0,082 |
0,0485 |
0,048 |
0,045 |
|
Объем ядра Объем клетки II |
─ |
0,033 |
0,014 |
0,0148 |
0,006 |
Обозначения: CL – длина карапакса, Оц. I – ооциты первого порядка, Оц. II – ооциты второго порядка.
а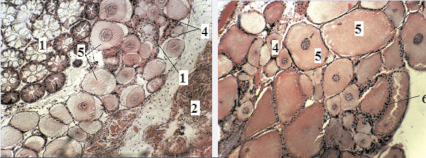 б
б
Рис. 2. Строение яичников австралийских раков в возрасте 120 дней (а) и в возрасте 150 дней (б). Увеличение 22×10 (стадия II). Гематоксилин-эозин: 1 – печень, 2 – сердце, 3 – оогонии, 4 – ооциты первого порядка, 5 – ооциты второго порядка, 6 – фолликулярная оболочка
Третья стадия была обнаружена у самок, имевших хорошо развитые половые железы. Их яичники были увеличены в размерах по сравнению с предыдущей стадией (в 1,3–1,8 раз по сравнению со стадией II и в 5 раз со стадией I). Яичники занимали от трети до половины длины панциря и содержали ооциты, видимые невооруженным глазом. Ооциты растут не только за счет увеличения объема протоплазмы, но и в результате накопления в плазме питательных или трофических веществ, представленных зернами (гранулами) желтка и каплями жира (рис. 3, б).
а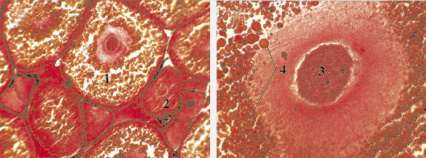 б
б
Рис. 3. Яичники австралийских раков в возрасте 150–180 дней с увеличением 22×10 (а) и с увеличением 22×40 (б). Гематоксилин-эозин: 1 – ооциты трофоплазматического роста, 2 – ооциты протоплазматического роста, 3 – ядро, 4 – зерна желтка
В этом периоде роста ооциты в 20–25 раз превышали исходные размеры оогониев. Ооциты становились непрозрачными, мутными и приобретали за счет жировых капель и гранул желтка окраску от светло-желтой до ярко-оранжевой. Соответственно изменился и цвет яичников. Одновременно с отложением трофических веществ развивается оболочка ооцитов, представляющая к концу трофоплазматического роста.
Четвертая стадия – зрелая стадия (стадия созревания). Ооциты достигали дефинитивного состояния и затем переходили к созреванию. В этой стадии завершалось образование оболочек яйца, подготовка ооцитов к оплодотворению и происходило освобождение ооцитов от фолликулярной оболочки. Во время созревания яичников у самок развиваются вторичеые половые признаки: расширение абдомена и хорошо развитые щетинки по бокам абдомена и на плеоподах.
Пятая стадия характеризует посленерестовое состояние половых желез. Яичники данной стадии сильно уменьшены в размерах. Отличительной чертой яичников V стадии зрелости является присутствие лопнувших фолликулов. После икрометания через 10 дней лопнувшие фолликулы рассасываются, и яичники соответственно переходят на II стадию зрелости (рис. 4, а).
а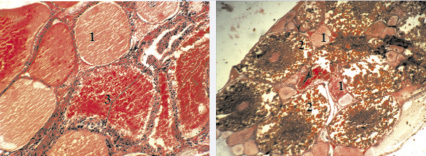 б
б
Рис. 4. Строение половых клеток самки после икрометания с увеличением 22×10 (а) и после вылупления рачат с увеличением 22×4 (б). Гематоксилин-эозин: 1 – ооциты малого роста, 2 – ооциты большего роста, 3 – лопнувшие фолликулы
Эмбрионы Cherax quadricarinatus развиваются под брюшком матери. После вылупления рачат половые железы самок переходят в третью стадию зрелости (рис. 4, б).
Заключение
Значение исследования зрелости половых желез заключается в решении ряда практических задач при культивировании водных организмов: зная время начала и конца интенсивного накопления питательных веществ в ооцитах (продолжительность трофоплазматического роста ооцитов), можно получить зрелую икру в разное время для искусственного разведения [3].
Впервые нами проведено исследование степени зрелости половых желез самок у австралийских раков. Следовательно, настоящее исследование может явиться теоретической основой широкого применения шкалы по определению стадий зрелости не только для австралийских раков, но и для других ракообразных в аквакультуре
Рецензенты:
Крючков В.Н., д.б.н., профессор кафедры «Гидробиология и общая экология», ФГБОУ ВПО «Астраханский государственный технический университет», г. Астрахань;
Котельников А.В., д.б.н., профессор кафедры «Гидробиология и общая экология», ФГБОУ ВПО «Астраханский государственный технический университет», г. Астрахань.
Работа поступила в редакцию 28.05.2014.



