Метил-трет-бутиловый эфир (МТБЭ) используется как компонент автомобильных бензинов и служит в качестве кислородосодержащего, высокооктанового компонента при получении неэтилированных, экологически чистых бензинов. Введение метил-трет-бутилового эфира позволяет улучшить экологические свойства топлива, снижает содержание токсичных продуктов в выхлопных газах, увеличивая полноту сгорания углеводородов [1]. Вместе с тем многолетнее применение метил-трет-бутилового эфира в составе автомобильных бензинов показало, что он оказывает отрицательное влияние на здоровье человека. Исследованиями установлено, что при хроническом воздействии метил-трет-бутиловый эфир вызывает такие заболевания, как астма, кратковременная потеря памяти, головная боль, раздражение кожи, оказывает слабое токсическое действие, угнетающее центральную нервную систему, обусловленное наркотическим эффектом [2]. Доказано, что ведущей системой-мишенью при хроническом воздействии в условиях производства МТБЭ является репродуктивная система мужчин [3].
В зарубежной литературе опубликовано значительное количество методов определения МТБЭ в биологических жидкостях, основанных на газовой хроматографии. Основные трудности определения МТБЭ в биологических объектах заключаются в высоком матричном эффекте, недостаточной селективности процедур пробоподготовки и необходимости использования дорогих стандартов меченных изотопов [2H12] МТБЭ и дорогостоящего оборудования, что невозможно для ежедневных рутинных анализов [6, 7, 8].
Также опубликованы статьи, касающиеся методов определения МТБЭ в крови, которые требуют длительной, продолжительной процедуры подготовки образцов крови к анализу, дополнительного оборудования и отличаются недостаточной селективностью, низкой чувствительностью и трудоемкостью выполнения [7].
В рамках данной работы предложена современная и доступная для практических исследований химико-аналитическая методика газохроматографического анализа равновесной паровой фазы с детектором ионизации в пламени (ДИП) и масс-спектрометрическим детектором для определения и идентификации МТБЭ в крови. Методика аттестована в соответствии с документом ГОСТ Р ИСО 5725-1-6-2002 и РМГ 61-2010 [4, 5].
Материалы и методы исследования
Реактивы и материалы. Для приготовления стандартных растворов и проведения пробоподготовки использовали метил-трет-бутиловый эфир квалификации «чистые вещества для хроматографии», содержание основного вещества 99,98 %, cas номер № 1634-04-4 (ООО «ХромЛаб», Москва); толуол квалификации «особой чистоты ос.ч 22-5», ТУ 2631-065-44493179-01, массовая доля основного вещества, %, не менее 99,5 (ЗАО «ЭКОС-1», Москва); серная кислота квалификации 11–5 особо чистая, ГОСТ 14262-78, массовая доля основного вещества 95,6 %, CAS-номер № 7664-93-9 (ООО Компонент-Реактив, Москва).
Аппаратура. Работу выполняли на газовом хроматографе «Кристалл-5000» ЗАО СКБ «Хроматэк» с пламенно-ионизационным детектором и капиллярной колонкой длиной, состоящей из неполярной капиллярной колонки DB-624- 60 м×0,32 мм с толщиной пленки неподвижной жидкой фазы на внутренней поверхности капилляра 1,8 μm фирмы «Agilent» (США) и полярной HP-1 30 м×0,32 мм с толщиной пленки неподвижной жидкой фазы на внутренней поверхности капилляра 0,25 μm фирмы «Agilent» (США). Для исключения влияния изменений температуры и общего давления на точность анализа при количественных измерениях применяли технику пневматического парофазного дозирования биопроб в капиллярную колонку хроматографа дозатором DANI HSS 86.50 HEAD SPACE SAMPLER. Для исследования стабильности использовали холодильник Bosch (от +5 до –20 °С) и морозильник микропроцессорный ММ-180/20/35-Позис (от –20 до –40 °С).
Идентификация выполнена при использовании системы газовая хроматография – масс-спектрометрия (ГХ-МС). Хроматографическое разделение проводили на газовом хроматографе Agilent 7890А с использованием масс-селективного детектора 5975 С с квадрупольным масс-анализатором и применением капиллярной колонки HP-VOC 60 m×0,2 mm×1,12 µm. Поиск характеристических ионов метил-трет-бутилового эфира выполняли с помощью банка библиотеки масс-спектральных данных NIST 08.L.
Приготовление стандартных растворов. Исходный стандартный раствор метил-трет-бутилового эфира с концентрацией 0,296 мг/мл готовили в мерной пробирке растворением 2 мм3 метил-трет-бутилового эфира в 5 мл толуола. Полученный раствор устойчив при температуре–15 °С, в течение 10 дней. Рабочий стандартный раствор метил-трет-бутилового эфира для градуировки с концентрацией 0,0592 мг/мл готовили в мерной пробирке растворением 1 мл исходного стандартного раствора в 4 мл толуола. Из рабочего стандартного раствора метил-трет-бутилового эфира для градуировки путем последовательного разбавления бидистиллированной водой готовили градуировочные растворы (0,00592, 0,01184, 0,0236, 0,0355, 0,0592 мг/л) и растворы для контроля качества QC (0,00592, 0,01184, 0,0296, 0,04736, 0,0592 мг/л).
Пробоподготовка. В виалы объемом 20 мл помещали дозатором 5 мл крови, градуировочных растворов либо раствора QC, доводили рН образца до 2–3 с помощью 1 % раствора серной кислоты. Виалы закрывали алюминиевыми колпачками с септами и ставили в дозатор равновесного пара. По истечении 10 минут осуществляли автоматический отбор парогазовой пробы объемом 2 мл и ее ввод в хроматографическую колонку для определения метил-трет-бутилового эфира методом капиллярной газовой хроматографии.
Условия определения метил-трет-бутилового эфира методом капиллярной газовой хроматографии. На основании результатов предварительных экспериментальных исследований установлены оптимальные условия хроматографирования: составная капиллярная колонка; режим линейного программирования температуры колонки (начальная температура 50 °С, линейное программирование со скоростью 10 °С/мин, конечная температура колонки 200 °С). Газ-носитель азот расход = 32 мл/мин. Пробу в испаритель хроматографа вводили с делением потока азот:воздух 1:20. Температура испарителя 200 °С. Хроматограмма экстракта крови после извлечения стандартного раствора метил-трет-бутилового эфира при оптимальных параметрах хроматографического процесса представлена на рис. 1.
Условия хромато-масс-спектрометрической идентификации
В процессе эксперимента установлены оптимальные условия хромато-масс-спектрометрической идентификации метил-трет-бутилового эфира: масс-спектры, характеристические ионы (m/z = 73, 57; 41), время удерживания характеристического молекулярного иона (1,578 мин); режим хроматографа: температуры колонки (начальная температура 50 °С, линейное программирование со скоростью 10 °С/мин, конечная температура колонки 240 °С). Газ-носитель гелий расход = 20 мл/мин., деление потока гелий:воздух 1:20. Для получения воспроизводимости масс-спектров ионизацию молекул метил-трет-бутилового эфира проводили в газовой фазе методом электронного удара. Масс-хроматограмму (рис. 2) строили по полному ионному току и по характеристическим ионам метил-трет-бутилового эфира (m/z 73,1; 57; 41).
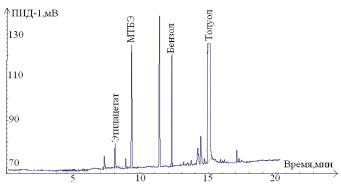
Рис. 1. Хроматограмма стандартного раствора метил-трет-бутилового эфира (0,116 мкг/мл) и мешающие соединения бензол (с = 0,04 мкг/мл), толуол (с = 1,04 мкг/мл). Время удерживания метил-трет-бутилового эфира 9,7 ± 0,02 мин
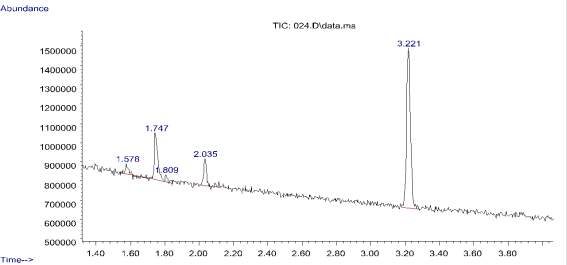
Рис. 2. Фрагмент хроматограммы по полному ионному току образца крови, содержащей метил-трет-бутиловый эфир (время удерживания 1,578 мин)
Индивидуальную идентификацию метил-трет-бутилового эфира в крови выполняли по параметрам удерживания (определено по градуировочным растворам) и путем сравнения характеристических ионов масс-спектров метил-трет-бутилового эфира с библиотечными масс-спектральными данными (рис. 3).
Наличие на масс-спектре пика с точно заданной массой (m/z 73) и определенным временем удерживания (1,57) для изучаемого соединения (МТБЭ) является весомым доказательством его присутствия в образце крови.
Аналитические характеристики методики. Оценку селективности и интерференций выполняли с использованием биологической матрицы путем анализа образцов крови 11 различных доноров. Критерий селективности составил 98 %.
Чувствительность метода (LOQ) оценивали путем определения минимальной концентрации метил-трет-бутилового эфира в образце крови с заданной степенью точности, которая характеризуется предельно допустимой величиной относительного стандартного отклонения не более 20 % от предела количественного определения с достоверностью 80–100 %. Для этого проводили эксперимент по внесению известных количеств аналитического стандарта метил-трет-бутилового эфира в образцы крови на уровне предела определения в 5 повторениях.
Степень извлечения метил-трет-бутилового эфира из крови определяли на трех уровнях концентраций (образцы QC) в 5 измерениях каждого уровня методом «введено-найдено». После этого вычисляли среднее значение степени извлечения.
Точность (среднеквадратическое отклонение погрешности результатов анализа) и достоверность определяли также на трех уровнях концентраций образцов QC. Содержание определяемого вещества в полученных растворах находилось на нижней границе, верхней границе (75 % от верхней точки линейного диапазона) и середине (50 %) линейного диапазона методики. Проводили 5 измерений каждого уровня в течение 3 дней. Рассчитывали точность и достоверность за один день (одна аналитическая серия) и за три дня (между тремя аналитическими сериями). Согласно критериям FDA и ЕМА [9, 10] значение среднеквадратического отклонения не превышало 15 % для уровня концентраций, соответствующих пределу количественного определения и не более 20 % для верхней границы диапазона. Достоверность рассчитывали как отношение среднего значения концентрации внутри одной или между тремя аналитическими сериями к истинному значению концентрации. Предельно допустимые значения достоверности составили 85–100,5 % для нижней границы диапазона и 90,5–100,3 % для остальных уровней концентраций.
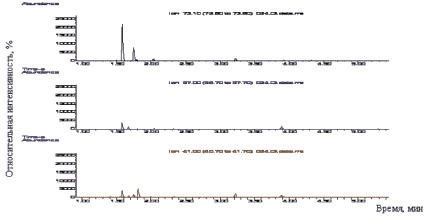 а
а
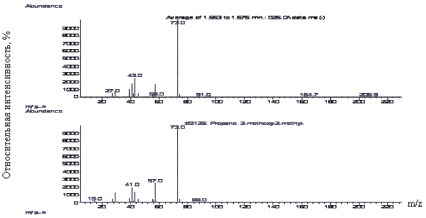 б
б
Рис. 3. Масс-хроматограмма (а) и масс-спектр электронного удара (б) МТБЭ в образце крови
Стабильность концентрации метил-трет-бутилового эфира в биологической матрице оценивали при различных условиях хранения: при Т = +4 °С, Т = + 20 °С и Т = –24 °С в течение 7, 14, 20 и 30 дней и измерялась на верхнем и нижнем уровнях диапазона в параллельных пробах крови.
Матричный эффект оценивали путем анализа подготовленных образцов крови от 11 различных доноров с внесенными стандартными добавками метил-трет-бутилового эфира. Среднеквадратическое отклонение между образцами составило 14 %.
Результаты исследования и их обсуждение
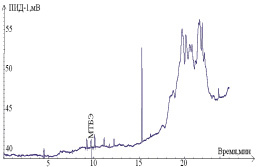
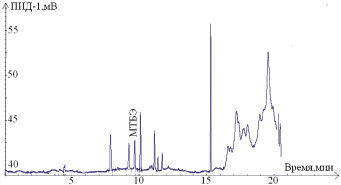
Хроматографическое определение метил-трет-бутилового эфира с пламенно-ионизационным детектированием. Для увеличения разрешения между аналитом (метил-трет-бутиловый эфир) и матричными соединениями, улучшения формы пика изучены условия разделения на капиллярных колонках с различными характеристиками неподвижных жидких фаз – GasPro-25 m×0,32 mm×0,5 µm, PoraPlot Q – 25 m×0,53 mm×0,5 µm и DB-624 50 m×0,32 mm×1,8 µm. Хроматограммы представлены на рис. 4.
 а
а
 б
б
 в
в
Рис. 4. Хроматограммы стандартного раствора метил-трет-бутилового эфира в крови, полученные на капиллярных колонках с различными неподвижными жидкими фазами: а – колонка PoraPlot Q – 25 m×0,53 mm×0,5 µm; б – колонка GasPro – 25 m×0,32 mm×0,5µm; в – колонка DB-624 50 m×0,32 mm×1,8 µm
Оптимальное разделение метил-трет-бутилового эфира с матричными компонентами достигнуто на капиллярной колонке серии DB-624 50 m×0,32 mm×1,8 µm. Для повышения чувствительности и оптимизации селективности определения варьировали температуру колонки, скорость нагревания, расход газа-носителя и деление потока (табл. 1).
Таблица 1
Газохроматографические параметры для эффективного разделения стандартного раствора метил-трет-бутилового эфира в крови
|
Режим |
Температура, °С |
Расход газа-носителя, мл/мин |
Деление потока азот:воздух |
|
|
колонка |
Скорость нагревания, °С/мин |
|||
|
1 |
50–220 |
10 |
32 |
1:20 |
|
2 |
70–160–180 |
15 |
20 |
1:14 |
|
3 |
70–160–200 |
25 |
30 |
1:0 |
При температуре колонки в режиме линейного программирования 50–200 °С со скоростью нагревания 10 °С/мин, расходе газа-носителя 32 мл/мин и делении потока 1:20 не наблюдалось интерференций с компонентами матрицы.
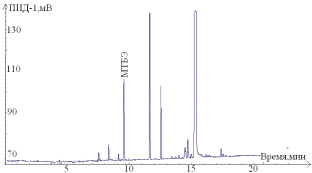
Количественное определение метил-трет-бутилового эфира осуществляли методом газохроматографического анализа равновесной паровой фазы. Нижний предел количественного определения метил-трет-бутилового эфира в газохроматографическом методе в сочетании с анализом равновесной паровой фазы с учетом условий пробоподготовки составил Clim = 0,00425 мг/л (рис. 5).
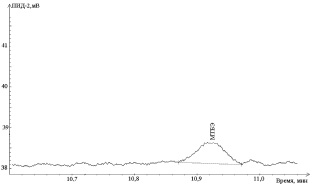
Рис. 5. Хроматограмма стандартного раствора метил-трет-бутилового эфира с концентрацией на уровне предела определения после извлечения из образца крови. Время удерживания составило 9,7 ± 0,02 мин
Среднеквадратическое отклонение при оценке матричного эффекта составило 3,3 %, т.е. в предлагаемых условиях анализа эффект подавления или увеличения сигнала метил-трет-бутилового эфира не наблюдается.
Пробоподготовка крови к анализу. При отработке способа подготовки пробы крови к хроматографическому анализу исследованы различные условия процедуры экстракции: применение ряда органических кислот различной концентрации и времени встряхивания биопробы до установления в системе динамического равновесия. Подобраны различные условия проведения экстракции (табл. 2) с высокими степенями извлечения метил-трет-бутилового эфира (90–98 %).
В процессе экспериментальных исследований установлено, что высокая степень извлечения метил-трет-бутилового эфира из образцов крови при максимальной селективности достигнута с использованием 1 % раствора серной кислоты (0,5 см3 кислоты на объем биопробы 5 см3) рН = 2–3, встряхивании биопробы в течение 5 мин в сочетании с газохроматографическим анализом равновесной паровой фазы, что позволяет исключить влияние матричного эффекта биосреды и обеспечивает полное извлечение аналита.
Таблица 2
Степень извлечения метил-трет-бутилового эфира из крови с использованием различных условий подготовки биосреды к анализу (концентрация, мг/л)
|
Условия извлечения |
Степень извлечения, % |
||
|
Концентрация серной кислоты, % |
Введено |
Найдено |
|
|
10 |
0,296 ± 0,031 |
0,274 ± 0,0137 |
92,57 ± 7,2 |
|
5 |
0,296 ± 0,033 |
0,205 ± 0,025 |
69,26 ± 6,0 |
|
1 |
0,296 ± 0,041 |
0,284 ± 0,032 |
95,95 ± 5,7 |
|
0,5 |
0,296 ± 0,019 |
0,209 ± 0,027 |
70,60 ± 6,4 |
|
Время встряхивания, мин |
Введено |
Найдено |
|
|
10 |
0,296 ± 0,033 |
0,289 ± 0,0198 |
97,60 ± 8,6 |
|
5 |
0,296 ± 0,041 |
0,290 ± 0,0276 |
97,97 ± 8,9 |
|
2 |
0,296 ± 0,019 |
0,285 ± 0,0312 |
96,28 ± 7,8 |
Среднее значение степени извлечения метил-трет-бутилового эфира из крови в данных условиях составило 97,97 ± 8,2 % (n = 6). При использовании других неорганических (соляная 1 % р-р, фосфорная 1 % р-р) и органических кислот (щавелевая 1 % р-р) полнота извлечения метил-трет-бутилового эфира из крови не превышала более 90 %.
Линейный диапазон. В газохроматографическом методе анализа равновесной паровой фазы использовали метод абсолютной градуировки. На каждом из 7 уровней концентраций метил-трет-бутилового эфира в диапазоне 0,00592–0,059 мкг/мл проводили по пять измерений. Градуировочный график линеен с коэффициентом корреляции 0,99, стандартное квадратическое отклонение не более 10 %.
Точность и достоверность. Проанализированы три серии образцов QC, результаты приведены в табл. 3.
Таблица 3
Точность и достоверность определения метил-трет-бутилового эфира в крови газохроматографическим методом анализа равновесной паровой фазы
|
Введено, мг/л |
Найдено, мг/л |
Точность, % |
Достоверность, % |
|
Внутри одной аналитической серии |
|||
|
0,0059 |
0,00593 ± 0,00044 |
5,9 |
100,5 |
|
0,0296 |
0,02970 ± 0,00081 |
2,2 |
100,3 |
|
0,059 |
0,05882 ± 0,00162 |
2,2 |
99,6 |
|
Между тремя аналитическими сериями |
|||
|
0,0059 |
0,005 ± 0,00012 |
2,0 |
85,0 |
|
0,0296 |
0,0268 ± 0,00088 |
2,6 |
90,5 |
|
0,059 |
0,0552 ± 0,00162 |
1,8 |
93,6 |
Достоверность внутри аналитической серии изменялась от 99,6 до 100,5 %, точность определения – от 1,8 до 5,9 %, а между сериями – от 85 до 93,6 % с точностью 1,8–2,6 %.
Стабильность. Исследование стабильности результатов измерений метил-трет-бутилового эфира с концентрацией на верхнем уровне диапазона (С = 0,059 мг/л) и на нижнем уровне диапазона (С = 0,0059 мг/л) в пробах крови было выполнено путем проведения 5-кратного анализа биопроб при различных условиях хранения при Т = +4 °С, Т = +20 °С и Т = –24 °С в течение 7, 20 и 30 дней. Относительная ошибка (%) результатов измерений была рассчитана сравнением определяемых концентраций метил-трет-бутилового эфира в пробах крови при различных условиях хранения со стандартным раствором. Анализируемое соединение рассматривалось стабильным, если процент относительной ошибки средней концентрации был не выше 15 %.
Данные стабильности показывают, что изменение концентрации метил-трет-бутилового эфира в пробах крови в процессе хранения относительно свежеприготовленных образцов в течение 30 дней при температуре Т = –24 °С не превышают допустимый предел 15 %. При температуре Т = +4 °С концентрация метил-трет-бутилового эфира стабильна в течение 20 дней и при температуре Т = +24 °С в течение 7 дней с отклонением 15–18 %.
Таблица 4
Стабильность метил-трет-бутилового эфира при различных условиях хранения
|
Условия |
Отклонение от концентрации свежеприготовленного образца, % |
|
|
0,0059 мг/мл |
0,059 мг/мл |
|
|
Хранение крови при Т = –24 °С, 30 дней |
6,0 |
5,0 |
|
Хранение крови при Т = +4 °С, 20 дней |
12,0 |
12,5 |
|
Хранение крови при Т = +20 °С, 7 дней |
18,2 |
15,0 |
Хромато-масс-спектрометрическая идентификация. В режиме полного сканирования 5 проб крови пациентов было установлено, что на масс-хроматограмме (рис. 6) пик со временем удерживания в диапазоне 1,567–1,615 мин является результатом взаимного наложения нескольких индивидуальных пиков соединений-изомеров с совпадающими временами удерживания: 2-метилпентан (время удерживания 1,567 мин), метил-трет-бутиловый эфир (время удерживания 1,575 мин) и 3-метилпентан (время удерживания 1,615 мин).
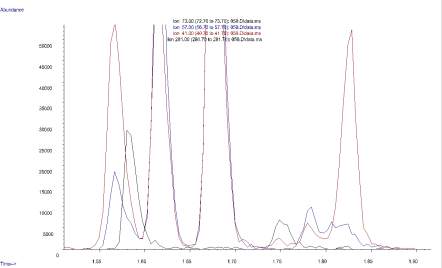
Рис. 6. Масс-хроматограмма образца крови
Для улучшения и устранения недостаточного разрешения в исследованиях использовали специальные колонки, которые позволили разделить изомеры и метил-трет-бутиловый эфир в образце крови. Применяли две последовательные ГХ колонки: неполярную с рабочей жидкой фазой на основе полиметилсилоксана DB-624 60 м×0,32 мм×1,8 μm и полярную на основе полиэтиленгликоля с высоким разрешением и низким пределом детектирования HP-1 30 м×0,32 мм×0,25 μm. При этих условиях на хроматограмме отсутствует пик, соответствующий изомерам 2-метилпентан и 3-метилпентан. Время удерживания метил-трет-бутилового эфира при этих условиях составило 11,3 мин.
Заключение
Разработанный метод определения метил-трет-бутилового эфира в крови показал высокую селективность, чувствительность, стабильность и надежность, а также удовлетворительную точность. Метод соответствует критериям международного стандарта FDA и может быть использован для практического применения научными учреждениями, работающими в области профпатологии и экологии человека, научно-исследовательскими институтами, занимающимися вопросами гигиены окружающей среды.
Предлагаемый метод с использованием газовой капиллярной хроматографии позволяет решить аналитическую проблему химических лабораторий, т.к. удовлетворяет требованиям чувствительности с применением недорогого оборудования.
Рецензенты:
Шуров С.Н., д.х.н., профессор кафедры органической химии Пермского государственного национального исследовательского университета, г. Пермь;
Вайсман Я.И., д.м.н., профессор кафедры охраны окружающей среды Пермского национального исследовательского политехнического университета, г. Пермь.
Работа поступила в редакцию 28.05.2014.



