Известно, что успешное течение репаративного процесса в ране с мягкими тканями требует мероприятий, направленных как на восстановление поврежденных тканевых структур и борьбу с инфекционными осложнениями, так и на предотвращение вторичной ишемии, которая осложняет функционирование антимикробных систем периферической крови [1]. При этом в качестве клеток-эффекторов выступают нейтрофильные гранулоциты, которые признаны в настоящее время мультифункциональными клетками, имеющими не только эффекторную направленность действия посредством осуществления фагоцитарной функции и секреции микробицидных пептидов, но и клетками, способными к презентации антигена, синтезу и секреции цитокинов и реализации регуляторных воздействий на микроокружение.
Благоприятный эффект на течение репаративных процессов в мягких тканях может оказывать низкоинтенсивное лазерное излучение (НИЛИ), которое стимулирует эти процессы на клеточном уровне, однако они еще недостаточно изучены [2, 5, 7, 9].
В своей работе мы использовали новую, созданную в «Лаборатории новейших технологий» экспериментальную модель лазера с длиной волны 4‒6 мкм. Поскольку функциональные возможности нейтрофилов определяются состоянием микробицидных систем, основные компоненты которых локализованы в цитоплазматических гранулах (азурофильные, специфические, третичные) и секреторных везикулах, то активность этих микробицидных пептидов, являясь информативным критерием оценки функционирования системы НГ, вносит определенный вклад в изучение патогенетических механизмов при заболеваниях как инфекционного, так и неинфекционного генеза. Интерес к исследованию функционирования микробицидных систем НГ при различных заболеваниях не ослабевает и в настоящее время [6, 7].
Целью настоящего исследования явилось определение уровня функциональной активности НГ у лабораторных животных с ранами мягких тканей в эксперименте с использованием дозированного воздействия на раневую поверхность НИЛИ.
Материалы и методы исследования
Материалом для исследования послужили мазки венозной крови и раневого экссудата экспериментальных животных, в качестве которых использовались крысы-самцы. У всех животных под местным обезболиванием (0,25 % раствор новокаина) была создана модель раны мягких тканей спины, подвергшейся естественному инфицированию. Далее животных разделили на 3 группы. Первая группа была контрольная. Вторая и третья группы экспериментальные. Во второй группе животных раневая поверхность облучалась НИЛИ длиной волны 4–6 мкм с дистанции 35 см по 4 минуты ежедневно с интервалом 24 часа в течении 14 суток, в третьей группе при тех же условиях длительность облучения составила 6 минут. Для облучения использовали экспериментальную модель лазера, созданного в «Лаборатории новейших технологий» КубГУ. Забор крови из хвостовой вены проводили до начала эксперимента, а также на 1-е, 4-е, 7-е и 14 сутки от его начала. Забор экссудата осуществляли тупфером на 1-е, 4-е, 7-е сутки от начала эксперимента. Мазки крови и отпечатки экссудата фиксировали парами 40 % формалина, окрашивали на катионный белок (КБ) прочным зеленым FCF при рН 8,2 по В.М. Пигаревскому (1979). Активность миелопероксидазы (МП) определяли по Sato (модификация) [3]. Отпечатки раневого экссудата окрашивали по Май – Грюнвальду с подсчетом количества лейкоцитов, наблюдаемых в 10 произвольно выбранных полях зрения микроскопа. Количественному исследованию подвергались только клетки экссудата, которые могли быть четко идентифицированы как НГ и лимфоциты. Ежедневно на протяжении всего эксперимента проводили визуальный осмотр экспериментальных ран с фоторегистрацией их состояния: размер ран, наличие, характер и объем экссудата, состояние грануляционной ткани, площадь эпителизированной раневой поверхности, появление и наличие волосяного покрова в зоне экспериментальной раны.
Документирование результатов исследования осуществляли методом цифровой фотографии камерой FS 7000 в макрорежиме и системой цифровой микрофотографии при увеличении 630х. Результаты обрабатывали методами вариационной статистики с помощью программы Micro Stat фирмы Borland Corparations.
Результаты исследования и их обсуждение
Анализ результатов показал, что уровень активности МП НГ периферической крови лабораторных животных контрольной группы до начала эксперимента составляет в среднем 2,27 ± 0,04 усл.ед., через сутки после формирования экспериментальной раны мягких тканей активность МП НГ снижается на 6 %, составляя в среднем 2,13 ± 0,13 усл.ед. (Р < 0,01). На четвертые сутки от начала эксперимента активность МП НГ периферической крови снизилась еще больше и достигла уровня 1,77 ± 0,06 усл.ед., при этом данное снижение являлось статистически значимым, как от исходного уровня, так и от уровня зарегистрированного на 1-е сутки эксперимента (Р < 0,001 и Р < 0,05 соответственно). На 7-е сутки от начала эксперимента активность МП НГ периферической крови продолжала снижаться как относительно исходного уровня, так и относильно предыдущих значений, составляя в среднем 1,52 ± 0,03 усл.ед. (Р < 0,01). На 14-е сутки от начала эксперимента активность МП НГ периферической крови экспериментальных животных оставалась существенно ниже исходных значений, составляя в среднем 1,22 ± 0,01 усл.ед. В то же время активность МП НГ экссудата в контроле, зарегистрированная на 1-е, 4-е и 7-е сутки, составила соответственно 2,53 ± 0,2 усл.ед., 2,64 ± 0,14 усл.ед. и 2,09 ± 0,01 усл.ед., проявляя тенденцию к снижению ее активности к 7-м суткам эксперимента (рис. 1).
Содержание КБ НГ периферической крови лабораторных животных контрольной группы составляет в среднем 1,25 ± 0,07 усл.ед., через сутки после формирования экспериментальной раны мягких тканей содержание КБ НГ повысилось на 14 % и составило в среднем 1,43 ± 0,07 усл.ед., однако это увеличение не являлось статистически значимым (Р > 0,05). На четвертые сутки от начала эксперимента содержание КБ НГ периферической крови лабораторных животных существенно снизилось и достигло уровня 1,07 ± 0,01 усл.ед., при этом данное снижение являлось статистически значимым, как от исходного уровня, так и от уровня зарегистрированного на 1-е сутки эксперимента (Р < 0,05 и Р < 0,01) соответственно. На 7-е сутки от начала эксперимента содержание КБ НГ периферической крови существенно возросло и достигло исходного уровня, составляя в среднем 1,25 ± 0,03 усл.ед. На 14-е сутки от начала эксперимента содержание КБ НГ периферической крови экспериментальных животных практически соответствовало уровню контроля – 1,20 ± 0,06 усл.ед. Содержание КБ НГ экссудата у животных на 1-е, 4-е и 7-е сутки плавно снижается и средний показатель для упомянутых сроков составил 1,30 ± 0,03 усл.ед., 1,09 ± 0,08 усл.ед. и 1,01 ± 0,01 усл.ед. (Р < 0,01) соответственно.
Среднее количество лейкоцитов, зарегистрированное в этот же период в расчете на одно поле зрения, колебалось от 32,4 ± 2,74 до 26,55 ± 4,48, при этом данные различия не были статистически значимы (Р > 0,05). Визуально определяемое количество экссудата существенно снизилось к 7-м суткам эксперимента, а к 14-м он уже не определялся. Процесс заживления экспериментальной раны у животных контрольной группы протекал вяло, грануляционная ткань формировалась медленно, эпителизация раневой поверхности шла с явной задержкой, даже на 14-е сутки от начала эксперимента в области экспериментальной раны, сохранялись очаги незавершенной репарации.
Во второй группе животных, которым проводили облучение НИЛИ, спустя сутки после формирования экспериментальной раны активность МП НГ увеличилась на 12 % и составила в среднем 2,47 ± 0,01 усл.ед. (Р < 0,01). Эта тенденция к увеличению уровня активности МП НГ периферической крови прослеживается и на 4-е сутки и составляет 2,63 ± 0,06 усл.ед. На 7-е сутки активность МП НГ периферической крови снизилась относительно предыдущих значений, составляя 2,34 ± 0,01 усл.ед. (Р < 0,05). На 14-е сутки эксперимента активность МП НГ снизилась еще больше и достигла уровня 1,01 ± 0,01 усл.ед. (Р < 0,001). В зоне локализации эксудата у этих же животных активность МП НГ на 1-е, 4-е и 7-е сутки составила 2,74 ± 0,05, 2,93 ± 0,08 и 2,67 ± 0,01 усл.ед. соответственно.
Содержание КБ НГ периферической крови лабораторных животных через сутки после лазерного облучения повысилось на 14 % и составило 1,39 ± 0,07 усл.ед. (Р < 0,05). На четвертые сутки содержание КБ НГ периферической крови лабораторных животных продолжая увеличиваться, достигло уровня 1,58 ± 0,05 усл.ед., при этом данное увеличение являлось статистически значимым и по отношению к исходному уровню, и к уровню зарегистрированному на 1-е сутки эксперимента (Р < 0,01 и Р < 0,05 соответственно). На 7-е и 14-е сутки от начала эксперимента содержание КБ НГ периферической крови практически не меняется, составляя в среднем 1,66 ± 0,1 усл.ед. и 1,52 ± 0,01 усл.ед. (Р > 0,05) соответственно. Содержание КБ НГ на 14-е сутки эксперимента на 24,5 % превышало уровень контроля (Р < 0,001). Нейтрофильные лейкоциты экссудата у этих же животных на 1-е, 4-е и 7-е сутки эксперимента обнаруживали уровень содержания катионного белка, соответствующий изученным срокам: 1,28 ± 0,01, 1,44 ± 0,02 и 1,60 ± 0,03 усл.ед. (Р < 0,01).
Среднее число лейкоцитов в этот же период в одном поле зрения колебалось от 16,95 ± 0,61 до 36,45 ± 6,48. Визуально определяемое количество экссудата существенно снизилось к 7-м суткам эксперимента, а к 14-м экссудат уже не определялся. В целом процесс заживления экспериментальной раны у животных второй группы протекал активно, грануляционная ткань формировалась быстро, эпителизация раневой поверхности была практически завершена, к 7-м суткам эксперимента сохранялись лишь единичные участки незавершенной репарации со скудным отделяемым.
В третьей группе животных, у которых облучение НИЛИ было пролонгированным, спустя сутки после формирования раны активность МП НГ оставалась на уровне контроля, составляя в среднем 2,36 ± 0,01 усл.ед. (Р > 0,05). На 4-е сутки активность МП НГ увеличилась на 12 % и составила в среднем 2,90 ± 0,01 усл.ед. (Р < 0,01). Однако на 7-е сутки активность МП НГ периферической крови снизилась относительно предыдущих значений и составила 2,58 ± 0,01 усл.ед. (Р < 0,05). Эта тенденция к снижению активности МП НГ сохранилась и на 14-е сутки эксперимента, где она в среднем составила 0,72 ± 0,01 усл.ед. (Р < 0,01), что было значительно ниже исходного уровня.
В зоне локализации экссудата у этих же животных активность МП НГ на 1-е, 4-е и 7-е сутки колебалась в пределе 2,72 ± 0,05, 2,82 ± 0,08 и 2,53 ± 0,01 усл.ед. соответственно (рис. 2), а содержание КБ в нейтрофильных лейкоцитах экссудата обнаруживало результаты, приведенные на рис. 1.
Содержание КБ НГ периферической крови у этих же животных через сутки после лазерного облучения повысилось на 39 % и составило 1,68 ± 0,06 усл.ед. (Р < 0,001). На четвертые сутки содержание КБ НГ периферической крови лабораторных животных практически не изменилось. На 7-е сутки содержание КБ НГ периферической крови повысилось на 16 % и составило 1,91 ± 0,04 усл.ед., а на 14-е сутки эксперимента несколько снизилось и составило 1,59 ± 0,04 усл.ед., что оказалось на 31 % выше исходного уровня (Р < 0,001).
Несмотря на значительный прогресс в медикаментозном и хирургическом лечении больных с ранами мягких тканей различной локализации, проблема раннего и полноценного восстановления функции травмированной зоны остается чрезвычайно актуальной, при этом особенно важным представляется участие нейтрофильных гранулоцитов в течении раневого процесса. Поскольку антимикробный потенциал НГ сконцентрирован в гранулярном аппарате и секреторных везикулах, то эти клетки являются не только простыми хранилищами протеолитических и бактерицидных протеинов, которые содержатся там до момента их активации и высвобождения либо во внеклеточное пространство, либо в фагоцитарные вакуоли, но и содержат важный резерв мембранных белков, встраивающихся в поверхностную мембрану нейтрофилов при экзоцитозе этих органелл. Решающую роль в деструкции фагоцитированных микробов отводится миелопероксидазе [6]. Лизосомально-катионные белки – это группа ферментных и неферментных протеинов. Обладая повышенной способностью к взаимодействию по электростатическому механизму с полианионными структурами клеточных оболочек микробов, они вызывают нарушение структурной целостности микроорганизмов, тем самым создавая условия для широкого антимикробного потенциала других физиологически активных соединений гранулярного аппарата нейтрофилов [4].
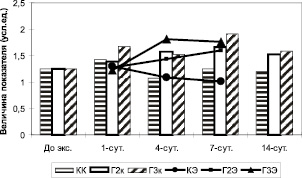
Рис. 1. Динамика содержания катионного белка нейтрофильных гранулоцитов (КК – контроль; Г2к – группа 2, кровь; Г3к – группа 3, кровь; КЭ – контроль, экссудат; Г2Э – группа 2, экссудат; Г3Э – группа 3, экссудат)
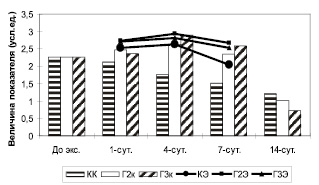
Рис. 2. Динамика содержания миелопероксидазы нейтрофильных гранулоцитов (КК – контроль; Г2к – группа 2, кровь; Г3к – группа 3, кровь; КЭ – контроль эксудат; Г2Э – группа 2, экссудат; Г3Э – группа 3, экссудат)
Полученные данные показали, что у животных контрольной группы, в качестве которой использовали крыс с моделью раны мягких тканей без лечения, динамика микробицидного статуса НГ характеризуется однонаправленностью изменений, связанных с падением активности миелопероксидазы (МП) и уровня содержания КБ. При этом относительно МП НГ значительное падение ее активности регистрируется с первых суток эксперимента до 14 дня. Этот эффект, вероятно, связан с усилением расходования активных компонентов цитоплазмы НГ, находящихся в периферическом кровотоке, поскольку НГ в экссудате в этот период сохраняют высокий уровень активности МП. По срокам это увеличение регистрируется на первые и четвертые сутки от начала эксперимента, не исключено, что этот эффект связан с перераспределением пулов НГ, мигрирующих в ткани. Уровень содержания катионного белка НГ периферической крови в первые сутки эксперимента в ответ на травму нарастает, а затем снижается. В то же время катионный белок НГ экссудата в этих условиях эксперимента снижается, но этот эффект наблюдается на 4-ые и 7-е сутки эксперимента. При естественном течении раневого процесса у крыс контрольной группы к 14-м суткам эксперимента полной репарации не происходит, о чем свидетельствует наличие визуально определяемых дефектов кожных покровов, стабильно высокое содержание лейкоцитов в раневом экссудате и низкий уровень МП НГ периферической крови.
У крыс второй группы при облучении раны НИЛИ в течение 4 минут активность МП в цитоплазме НГ в первой фазе раневого процесса (1–4-е сутки) не только не снижается, а даже существенно нарастает, но на 14-е сутки эксперимента активность МП НГ резко падает и оказывается вдвое ниже исходного. Содержание КБ НГ у животных второй группы также оказывается существенно повышенным по отношению к аналогичным значениям у животных контрольной группы. Динамика активности МП и КБ в нейтрофилах экссудата у животных второй группы сходна с процессами, регистрируемыми в периферической крови. Указанные факты позволяют предположить, что НИЛИ длиной волны 4–6 мкм при суточной экспозиции в 4 минуты оказывает не только местное стимулирующее воздействие на репаративные процессы в экспериментальной ране, но и обладает резорбтивным эффектом, стимулируя костномозговое кроветворение, которое обогащает периферическую кровь высокоактивными НГ с повышенным запасом КБ и МП. Резкое падение активности МП НГ на 14-е сутки эксперимента, возможно, связано с селекцией НГ в период завершения раневой репарации, когда в периферической крови сохраняются лишь «переживающие» формы НГ, а их активированный пул подвергся элиминации. В целом при облучении экспериментальной раны НИЛИ длиной волны 4–6 мкм в течение 4 минут происходит существенное ускорение заживления раневого процесса. Визуально определяемые признаки полного заживления в виде эпителизации раневой поверхности, восстановления волосяного покрова регистрируются уже на 8–9-е сутки. При облучении экспериментальной раны НИЛИ длиной волны 4–6 с суточной экспозицией в 6 минут течение раневого процесса также существенно ускоряется. Динамика цитохимических показателей НГ при определенных частных различиях не отличается от зарегистрированной при экспозиции в 4 минуты. Визуально определяемые признаки полного заживления (эпителизация раневой поверхности, восстановление волосяного покрова) здесь также приурочены к 8–10-м суткам эксперимента.
Итак, НИЛИ с длиной волны 4–6 мкм при облучении экспериментальной раны мягких тканей крыс в течение 4–6 минут с дистанции 35 см по нормали оказывает выраженное активирующее воздействие на активность кислородзависимой и кислороднезависимой микробицидных систем НГ, что приводит к заметному ускорению репаративных процессов в ране.
Рецензенты:
Алексанянц Г.Д., д.м.н., профессор, проректор по научно-исследовательской работе ФГБОУ ВПО КГУФКСТ, г. Краснодар;
Абушкевич В.Г., д.м.н., профессор кафедры нормальной физиологии, ГБОУ ВПО КубГМУ Минздрава России, г. Краснодар.
Работа поступила в редакцию 15.05.2014.



