Представители семейства трансформирующих ростовых факторов бета (TФР-β) впервые были описаны в 1978 г., а выделены из тромбоцитов и охарактеризованы немногим более 15 лет назад [1]. Источниками TФР-β являются преимущественно макрофаги и моноциты, содержащие его постоянно, но секретирующие только при активации [14]. Три изоформы TФР-β имеют сходные биологические эффекты, однако наиболее выраженной экспрессией и значимой ролью при воспалении, ремоделировании и фиброзировании сосудов и миокарда обладает TФР-β1, поэтому именно эта изоформа представляет наибольший интерес для исследования. TФР-β обычно секретируется в биологически неактивной форме, называемой латентным TФР-β, который не способен взаимодействовать с соответствующим рецептором [8]. В ответ на гемодинамическую перегрузку и ишемию миокарда кардиомиоциты синтезируют и секретируют TФР-β1 [7]. Кроме того, активация гена TФР-β1 происходит в ответ на повреждение тканей [8]. Существует мнение, что TФР-β1 способствует развитию атеросклеротических повреждений стенки сосудов на фоне усиления воспаления и снижения содержания коллагена, ведущих к ослаблению атеромы [13], но в то же время показано также, что TФР-β 1 играет важную роль в стабилизации атеросклеротических бляшек путем подавления местного воспаления [9]. То есть выполняет как проатерогенную, так и антиатерогенную функцию. Отечественными учеными также было показано, что ишемия миокарда сопровождается снижением уровня противовоспалительного цитокина TФР-β1 в сыворотке крови, а операция КШ, по их мнению, не оказывает влияния на его содержание в раннем послеоперационном периоде [4].
В другом исследовании установлено, что более высокий уровень TФР-β 1 в плазме крови был связан с повышенным риском инцидента сердечной недостаточности у пожилых людей [6], ассоциированный со стенозом сосудов и тромбообразованием, усиливая фиброз и подавляя регенерацию эндотелия. Аномальная экспрессия TФР-β1 ассоциируется с болезнями, при которых имеют место процессы фиброза и рубцевания [10].
Важной задачей лечения острых форм ИБС является устранение патогенетических звеньев, лежащих в основе симптомов жизнеугрожающего заболевания. Одним из эффективных методов лечения ОКС в настоящее время считается коронарное шунтирование (КШ), позволяющее увеличить продолжительность и улучшить качество жизни пациента [5].
Исследователями кафедры патофизиологии получены результаты, что важным патогенетическим звеном неблагоприятного течения и прогноза является ранняя гиперактивация продукции цитокинов на фоне депрессии маркеров клеточно-опосредованной иммунной защиты, что приводит к резкому росту концентрации кислородных радикалов и оксида азота и способствует превалированию процессов апоптоза над маркерами активации [3]. Работы по оценке результатов КШ, включающие описание содержания TФР-β1 в сыворотке крови у больных, перенесших данный тип операции, практически отсутствуют. Между тем эти сведения имеют важное значение для решения вопроса для прогнозирования осложнений и определения тактики ведения больных как в предоперационном, так и в послеоперационном периодах, что и послужило основанием для проведения настоящего исследования.
Цель исследования – проанализировать участие трансформирующего фактора роста TФР-β1 в развитии осложнений у больных кардиохирургического отделения до и после АКШ.
Материал и методы исследования
Проведено обследование 47 пациентов обоего пола до и после операции аортокоронарного шунтирования на фоне атеросклероза коронарных артерий, находившихся на лечении в кардиохирургическом отделении Приморской краевой клинической больницы № 1. Из них – 32 мужчины (68,1 %), 15 женщин (31,9 %). По возрасту пациенты распределены: 24 мужчины и 10 женщин (72,3 %) III группы, согласно классификации ВОЗ (60–74 лет) и 8 мужчин и 5 женщин (27,7 %) – II группы (45–59 лет). Были сформированы группы: по давности возникновения инфаркта миокарда (ИМ). Из них: от 3 до 6 месяцев – 14 пациентов и более 12 месяцев – 20 пациентов. По результатам коронароангиографии с поражением двух коронарных артерий (КА) – 8 пациентов, трех КА – 22, четырех и более КА – 17 пациентов. Группа больных с постинфарктным кардиосклерозом (ПИКС) составила 24 пациента и 23 пациента без ПИКС. По функциональному классу (ФК) хронической сердечной недостаточности (ХСН), согласно критериям, предложенным Нью-Йоркской ассоциацией кардиологов, 33 пациента III ФК, из них 23 пациента мужского и 10 женского пола и 14 пациентов II ФК, из них 10 мужского и 4 женского пола.
Группу сравнения (контрольная группа) составили 13 здоровых добровольцев.
Забор крови обследуемым проводился утром между 8 и 9 часами из локтевой вены после 12-часового голодания до операции, на 1-е, 3, 10 сутки после операции. Сыворотку крови получали после центрифугирования в течение 10 минут при 1500 об/мин, полученные образцы разливали по 1,0 мл и хранили при – 36 °С. Определение концентрации TФР-β1 проводили иммуноферментным методом в строгом соответствии с инструкцией производителя (R & D Systems, USA).
Статистическая обработка полученных данных выполнялась с использованием стандартного пакета программ прикладного статистического анализа StatPlus 2009 Professional с помощью критерия Стьюдента. Данные представлены в виде М ± SD. Критический уровень достоверности нулевой статистической гипотезы принимали ≤ 0,05.
Результаты исследования и их обсуждение
Как показали результаты нашего исследования, содержание TФР-β1 в сыворотке крови больных на всех сроках после операции значительно варьировало.
Выявлен значительно более высокий предоперационный уровень TФР-β 1 в сыворотке крови у пациентов обоего пола, по сравнению со здоровыми людьми (34,88 ± 2,2 нг/мл у пациентов до аортокоронарного шунтирования, против 26,05 ± 4,24 нг/мл в контрольной группе, р < 0,05) и первыми, третьими сутками послеоперационного периода (27,37 ± 2,15 нг/мл в 1-е сутки и 21,92 ± 2,13 нг/мл на 3-и сутки после АКШ, р < 0,05) (рис. 1). Высокий уровень TФР-β1 связан с наличием атеросклеротического поражения коронарных артерий у пациентов отделения кардиохирургии, а снижение синтеза данного цитокина в ранний послеоперационный период происходит в связи с развитием воспаления на фоне операционной травмы. Однако в одном из исследований установлено, что более высокий уровень TФР-β 1 в сыворотке крови связан с повышенным риском инцидента сердечной недостаточности у пожилых людей [6], ассоциированный со стенозом сосудов и тромбообразованием, усиливая фиброз и подавляя регенерацию эндотелия.
На десятые сутки зафиксировано повышение уровня TФР-β 1 (33,48 ± 3,02 нг/мл), что связано с процессом заживления ран и активацией фибробластов (рис. 1). Также можно предположить, что повышенное содержание этого фактора на поздних сроках после операции отражает степень ремоделирования сосудов и миокарда. В ряде исследований описано увеличение его уровня в клетках сосудов после хирургической травмы при заживлении и продолжающихся атеросклеротических изменениях [11].
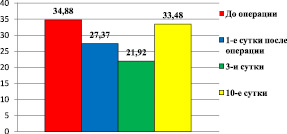
Рис. 1. Динамика уровня TФР-β1 (нг/мл) у пациентов до и после АКШ
Уровень TФР-β1 у пациентов мужского пола с коронарным атеросклерозом до реваскуляризации миокарда по сравнению с противоположным полом и контрольной группой пациентов был достоверно высок (39,39 ± 2,24 нг/мл против 26,82 ± 4,09 нг/мл у пациентов женского пола до АКШ и 26,05 ± 4,24 нг/мл в контрольной группе, р < 0,05) (табл. 1). У пациентов до и после реваскуляризации миокарда методом АКШ уровень TФР-β1 обратно коррелирует с динамикой изофермента креатинфосфокиназы (КФК-МВ), характерный для ткани сердечной мышцы (1-е сутки после АКШ: уровень ТФРβ1 у мужчин 24,75 нг/мл против уровня КФК-МВ 43,52 ед/л, р < 0,05, на 3-и сутки: 22,12 нг/мл против 64,71 ед/л у мужчин и 20,63 нг/мл против 77,75 ед/л у женщин, р < 0,05), т.е. со степенью некроза сердечной мышцы. При повреждении клеток миокарда происходит высвобождение КФК-МВ и поступление этого фермента в кровь. При снижении уровня противовоспалительного цитокина TGF-β1 отмечается повышение КФК-МВ (рис. 2). Выраженное снижение уровня TGF-β1 на 3-и сутки после операции сопровождается выраженным повышением изофермента сердечной мышцы. На 10 сутки отмечается практически равнозначные уровни как TФР-β1, так и КФК-МВ, что свидетельствует о возникновении транзиторной ишемии миокарда на 3-и сутки, обусловленной самой операцией АКШ (рис. 2).
Таблица 1
Содержание TФР-β1 у пациентов обоего пола II и III группы возрастного периодов до и после АКШ
|
Количество клеток (М ± σ), нг/мл |
||||||
|
М |
Ж |
Пациенты обоего пола |
II группа |
III группа |
Контроль |
|
|
До операции |
39,39 ± 2,241 |
26,82 ± 4,092 |
34,88 ± 2,2 |
39,14 ± 5,061 |
34,4 ± 2,18 |
26,05 ± 4,24 |
|
1-е сутки после АКШ |
24,75 ± 2,31 |
29,21 ± 4,7 |
27,37 ± 2,15 |
30,89 ± 4,86 |
24,37 ± 2,32 |
|
|
3-е сутки |
22,12 ± 2,58 |
20,63 ± 3,32 |
21,95 ± 2,13 |
25,93 ± 3,91 |
20,65 ± 2,47 |
|
|
10-е сутки |
33,88 ± 3,91 |
34,49 ± 4,86 |
33,48 ± 3,02 |
36,08 ± 7,83 |
33,33 ± 3,19 |
|
Примечания:
1 – различие с контролем статистически значимо;
2 – различие статистически значимо с группой пациентов мужского пола;
3 – различие статистически значимо между II и III группами возрастного периода.
Также нельзя исключить дефицит TФР-β1, вызванный снижением его продукции после воспаления и иммунной травмы и повышение его уровня в клетках сосудов после хирургической травмы при заживлении и продолжающихся атеросклеротических изменениях, что и отмечается на 10 сутки после операции.
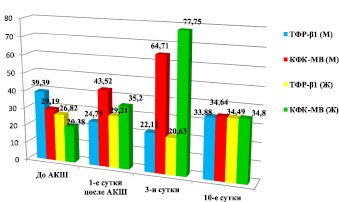
Рис. 2. Уровень TФР-β1 (нг/мл) и КФК МВ (ед/л) у мужчин (М) и женщин (Ж) до и после операции АКШ
Отсутствовала достоверная корреляция между содержанием TФР-β1 и количеством пораженных КА, но уровень TФР-β1 на 10 сутки после операции у пациентов с поражением трех и более коронарных артерий по сравнению с поражением двух коронарных артерий был повышен (33,34 ± 3,04 и 30,02 ± 5,07 нг/мл по сравнению с 22,34 ± 6,08 нг/мл у пациентов с поражением двух коронарных артерий). Зарегистрирован достоверно высокий уровень TФР-β1 у пациентов мужского пола III ФК до реваскуляризации миокарда в сравнении с уровнем данного цитокина у пациентов женского пола и здоровых добровольцев (41,58 ± 3,16 нг/мл против 24,26 ± 3,73 нг/мл у пациентов женского пола и 26,05 ± 4,24 нг/мл у людей контрольной группы, p < 0,05) (табл. 2).
Таблица 2
Содержание TФР-β1 (нг/мл) у пациентов до и после АКШ в зависимости от давности инфаркта миокарда, наличия или отсутствия постинфарктного кардиосклероза (ПИКС), количества пораженных коронарных артерий (КА)
|
Количество клеток (М ± σ), нг/мл |
||||||||
|
ОИМ от 3 до 6 месяцев |
ОИМ более 12 месяцев |
ПИКС |
без ПИКС |
2 КА |
3 КА |
4 КА и более |
Контроль |
|
|
До операции |
32,69 ± 4,27 |
36,42 ± 3,10 |
33,55 ± 2,75 |
37,94 ± 3,011 |
32,73 ± 4,44 |
38,28 ± 3,541 |
34,16 ± 3,32 |
26,06 ± 4,24 |
|
1-е сутки после АКШ |
27,54 ± 3,41 |
29,45 ± 3,83 |
29,76 ± 3,44 |
23,94 ± 2,31 |
30,51 ± 4,03 |
30,07 ± 3,59 |
22,46 ± 2,73 |
|
|
3-е сутки |
21,75 ± 2,49 |
22,10 ± 3,79 |
21,33 ± 3,38 |
21,34 ± 2,97 |
16,14 ± 3,93 |
25,84 ± 2,97 |
18,47 ± 3,61 |
|
|
10-е сутки |
38,76 ± 6,41 |
28,78 ± 3,49 |
26,81 ± 3,693 |
39,12 ± 4,621 |
22,34 ± 6,08 |
33,34 ± 3,04 |
30,02 ± 5,07 |
|
Примечания:
1 – различие с контролем статистически значимо;
2 – различие с ОИМ от 3 до 6 месяцев статистически значимо;
3 – различие с группой пациентов без ПИКС статистически значимо.
Высокий уровень TФР-β1 у пациентов III ФК до операции АКШ может свидетельствовать о риске инцидента острой сердечной недостаточности у пациентов с коронарным атеросклерозом.
А высокий уровень противовоспалительного цитокина на 10 сутки после АКШ указывает как на ремоделирование и фиброзирование сосудов и миокарда после реваскуляризации, так и на продолжающиеся атеросклеротические изменения, так как аортокоронарное шунтирование не прекращает атерогенез. Дефицит TФР-β1, по данным литературы, является одним из факторов дестабилизации атеросклеротической бляшки [4].
Таблица 3
Содержание TФР-β1 у пациентов до и после АКШ в зависимости от функционального класса (ФК) сердечной недостаточности (СН) и характера течения послеоперационного периода
|
Количество клеток (М ± m), нг/мл |
||||||
|
II ФК |
III ФК |
Контроль |
ОИМ после АКШ |
|||
|
м |
ж |
м |
ж |
|||
|
До операции |
37,69 ± 2,621 |
22,92 ± 4,983 |
41,58 ± 3,161 |
24,26 ± 3,732 |
26,05 ± 4,24 |
34,88 ± 6,12 |
|
1-е сутки после АКШ |
27,54 ± 3,41 |
29,45 ± 3,83 |
29,78 ± 3,41 |
26,13 ± 5,88 |
26,61 ± 3,31 |
|
|
3-е сутки |
21,95 ± 2,91 |
34,63 ± 4,93 |
23,51 ± 3,6 |
19,35 ± 3,75 |
22,73 ± 3,49 |
|
|
10-е сутки |
27,93 ± 3,71 |
37,62 ± 10,76 |
36,41 ± 5,25 |
31,26 ± 4,6 |
33,60 ± 7,85 |
|
Примечания:
1 – различие с контролем статистически значимо;
2 – различие с группой пациентов мужского пола III функционального класса статистически значимо;
3 – различие с группой пациентов мужского пола II функционального класса статистически значимо.
Заключение
Обнаруженная ассоциация между содержанием TФР-β1 и развитием рецидива ишемии миокарда после коронарного шунтирования позволяет рассматривать высокий уровень TФР-β1 одним из факторов риска развития или возобновления симптоматики ИБС после хирургической реваскуляризации миокарда.
Однако сомнительно, что фактор роста может быть использован как маркер ишемии, так как его снижение может быть обусловлено ишемией других органов [12]. Но следует отметить, что уровень TФР-β1 после реваскуляризации может отражать ишемию миокарда, вызванную самой процедурой реваскуляризации, то есть обусловлено транзиторной ишемией миокарда.
TФР-β1 вовлечен в процесс ремоделирования сердца и миокарда, фиброза и рубцевания после реваскуляризации миокарда методом аортокоронарного шунтирования и в стабилизации атеросклеротических бляшек путем подавления местного воспаления, что было зарегистрировано по высокому уровню противовоспалительного цитокина TФР-β1 до операции и на 10 сутки после АКШ.
Отсутствие корреляции между количеством пораженных КА и уровнем TФР-β1 объясняется тем, что именно ишемия может вызывать достоверное снижение уровня данного противовоспалительного цитокина, т.е. даже у больных с многососудистым поражением коронарного русла в условиях покоя ишемия миокарда может быть не выражена.
В развитии ССЗ существенная роль отводится факторам риска, среди которых основными являются такие, как артериальная гипертензия, избыточная масса тела, курение, нарушение липидного обмена, низкая физическая активность, способствующие развитию и прогрессированию атеросклероза, которые встречаются чаще у мужчин [2]. Нельзя исключить неприверженность мужчин к антигипертензивной, гиполипидемической, антиагрегантной терапии. Многие мужчины недооценивают серьезность заболевания и, соответственно, не выполняют в полном объеме рекомендации врача.
Полученные данные, связанные с более высоким уровнем экспрессии TФР-β1, могут указывать на доминирование проатерогенных функций этого цитокина.
Таким образом, практический интерес вызывает возможность судить об успешности реваскуляризации миокарда и риске рецидива острой сердечной недостаточности по уровню факторов роста в крови. Для подобных рекомендаций необходимо продолжить исследование динамики факторов роста.
Рецензенты:
Запорожец Т.С., д.м.н., зам. директора по научной работе, ФБГУ «Научно-исследовательский институт эпидемиологии и микробиологии имени Г.П. Сомова» СО РАМН, г. Владивосток;
Кику П.Ф., д.м.н., профессор, заведующий кафедрой профилактической медицины школы биомедицины, Дальневосточный федеральный университет, г. Владивосток.
Работа поступила в редакцию 04.06.2014.



