Избыточное поступление в организм кобальта индуцирует перекисное окисление липидов и способствует формированию окислительного стресса, сопровождающегося дисфункцией эндотелия, повреждением биологических макромолекул, мембранных структур клеток и ферментов [8]. Принимая на себя влияние солей тяжелых цветных металлов, эндотелий становится прямой мишенью для повреждения, и эндотелиальная дисфункция играет патогенетическую роль в повреждении мембран клеток внутренних органов в условиях окислительного стресса.
Цель исследования – изучение биохимических и функциональных показателей гемодинамических нарушений и повреждений внутренних органов при кобальтовой интоксикации.
Материал и методы исследования
Для реализации данной цели исследования проведены на крысах-самцах линии «Wistar» одной возрастной группы (10–14 мес.), массой 220–250 г. У экспериментальных крыс моделировали кобальтовые ангиопатии парентеральным введением хлорида кобальта в дозе 6 мг/кг веса животного в течение месяца.Содержание крыс в виварии и проведение экспериментов соответствовали «Правилам проведения работ с использованием экспериментальных животных», разработанным и утвержденным МЗ СССР (1977 г.), а также принципам Хельсинкской декларации (2000 г.). В эксперименте мы исследовали следующие показатели: интенсивность ПОЛ в эритроцитах, гомогенатах почечной, печеночной и миокардиальной тканей по данным изменения концентрации МДА, определяемого колориметрическим методом с тиобарбитуровой кислотой [9]; состояние антиокислительной системы (АОС) оценивали по активности каталазы [6] и СОД по методу аутоокисления адреналина, концентрацию церулоплазмина (ЦП) в сыворотке крови – метод Равина [5]. Изучали активность Na+, K+-АТФ-азы в корковом и мозговом слоях почечной, а также в печеночной и миокардиальной тканях по приросту неорганического фосфора в среде инкубации по методу Scou ТС (1957). Содержание в плазме крови стабильных суммарных конечных метаболитов оксида азота (NO2– и NO3– или NOx) исследовали с помощью реактива Грисса в реакции деазотирования, согласно модифицированному экспресс-методу [7]. Для оценки активности органоспецифических ферментов определяли в крови активность трансаминаз (AлАT, AсАT), ГГТП и щелочной фосфатазы наборами фирмы «Витал».
Статистическую обработку результатов проводили методом вариационной статистики, принимая во внимание вариации динамических рядов, и оценивали корреляцию, учитывая ее достоверность по стандартным таблицам (Л.С. Каминский) с использованием программы статанализа «Statistika 6.0 for Windows» фирмы «Stat Soft, Juc» и «Microsoft Office Excel 2003».
Результаты исследования и их обсуждение
Анализ полученных результатов по определению содержания кобальта в плазме крови и моче выявил прямые корреляционные связи между дозой вводимого хлорида кобальта и содержанием в плазме крови (r = +0,66) при подкожном введении хлорида кобальта в течение месяца (r = +0,61) и в моче в течение 1 месяца после введения соли (r = +0,72). На фоне хронической интоксикации хлоридом кобальта в дозе 6 мг/кг развивается окислительный стресс, который приобретает системный характер, повышается концентрация МДА в эритроцитах, гомогенатах почечной, печеночной и миокардиальной тканей сравнительно с контрольной группой (рис. 1).
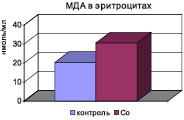
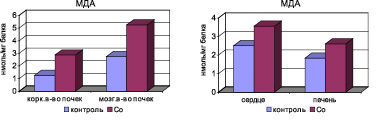
Рис. 1. Изменение биохимических показателей крови и внутренних органов на фоне интоксикации хлоридом кобальта
Анализ данных активности ферментов АОС организма показал, что в условиях оксидативного стресса у крыс с интоксикацией хлоридом кобальта в течение 1 месяца выявляется снижение активности СОД в крови (p < 0,001), тогда как активность каталазы и концентрация церулоплазмина существенно возрастают (p < 0,001) (рис. 2).
На фоне развившегося системного оксидативного стресса у крыс с кобальтовой интоксикацией снижается концентрация в сыворотке крови суммарных метаболитов NO (рис. 2). Корреляционный анализ показал наличие отрицательной сильной связи между повышением МДА в крови и снижением концентрации суммарных метаболитов NO (r = –0,74).
Эти изменения метаболизма NO и продукты ПОЛ способствуют развитию эндотелиальной дисфункции, нарушению проницаемости клеточных мембран внутренних органов: почек, печени и миокарда. Об этом свидетельствуют данные угнетения активности мембранного фермента Na+, K+-АТФ-азы в корковом и мозговом слоях почечной ткани, а также в гомогенатах печени и миокарда (рис. 3).
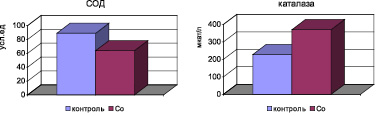
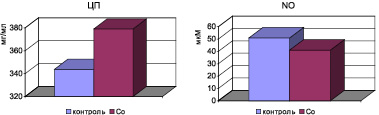
Рис. 2. Активность ферментов АОС в условиях кобальтовой интоксикации у крыс
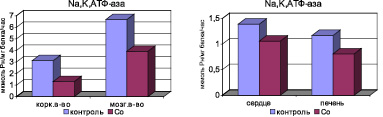
Рис. 3. Активность Na+, K+-АТФ-азы внутренних органов у крыс с экспозицией хлоридом кобальта
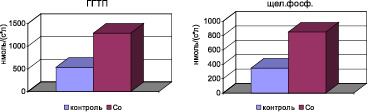
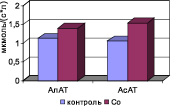
Рис. 4. Активность ферментов сыворотки крови в условиях экспериментальной кобальтовой интоксикации
Биохимическими маркерами повышения проницаемости клеточных мембран являются изменения активности ферментов сыворотки крови. В результате активации ПОЛ происходит нарушение проницаемости клеточных мембран кардиомиоцитов и гепатоцитов, повышение в крови активности трансаминаз: АлАТ, АсАТ, мембранного фермента – ГГТП и экскреторного щелочной фосфатазы (рис. 4).
Заключение
При хронической кобальтовой интоксикации в течение 1 месяца отмечается развитие системного окислительного стресса, который сопровождается снижением содержания суммарных метаболитов NO и повреждением клеточных мембран внутренних органов – почек, печени и миокарда по данным угнетения активности Na+, K+-АТФ-азы. Другим показателем нарушения проницаемости цитоплазматических мембран внутренних органов является повышение в сыворотке крови следующих ферментов: АлАТ, АсАТ, ГГТП и щелочной фосфатазы. Участие дисфункции эндотелия в нарушении функциональной способности внутренних органов установлено в нашей лаборатории в других исследованиях [3].
Рецензенты:
Брин В.Б., д.м.н., профессор, зав. отделом физиологии и патологии висцеральных систем, ФГБУН «Институт биомедицинских исследований Владикавказского научного центра РАН и Правительства РСО‒Алания», г. Владикавказ;
Джиоев И.Г., д.м.н., профессор, зав. центральной научно-исследовательской лабораторией, ГБОУ ВПО «Северо-Осетинская государственная медицинская академия» Министерства здравоохранения Российской Федерации, г. Владикавказ.
Работа поступила в редакцию 04.06.2014.



